脑胶质瘤患者血清黑色素瘤相关抗原-A 3特异性细胞毒性 T淋巴细胞免疫反应水平及临床意义
李俊,孙继程,杜国新
辽宁省健康产业集团铁煤总医院神经外一科,辽宁 铁岭 112700
脑胶质瘤是临床上常见的神经系统恶性肿瘤,现有的治疗手段包括手术、化疗、放疗、靶向治疗、免疫治疗等,整体效果都不太理想,患者5年生存率不足20%[1]。近几年,新的免疫治疗方法在脑胶质瘤领域受到越来越多的关注,例如使用重组肿瘤相关抗原(tumor associated antigen,TAA)负载树突状细胞(dendritic cell,DC)治疗被认为是最有前途的免疫治疗手段之一[2],涉及的肿瘤领域也相对较多。黑色素瘤相关抗原(melanoma-associated antigen,MAGE)家族成员是其中重要的免疫治疗靶标之一[3],由MAGE编码的抗原肽经主要组织相容性复合体Ⅰ类(major histocompatibility complexⅠ,MHC-Ⅰ)呈递给细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL),发挥抗肿瘤活性[4]。目前关于MAGE-A3在脑胶质瘤中的研究较少,对于MAGE-A3在脑胶质瘤组织中是否具有表达特异性以及是否符合肿瘤免疫治疗对抗原分子表达的要求尚存在争议。基于此,本研究首先应用蛋白质印迹法(Western blot)和甲基化特异性聚合酶链反应(methylation specific polymerase chain reaction,MSP-PCR)技术检测MAGE-A3在脑胶质瘤组织中的表达情况,并采用Gultured酶联免疫斑点法(enzyme-linked immunosorbent spot assay,ELISPOT)检测患者MAGE-A3特异性CTL免疫反应,明确两者之间的关系以及临床意义,为MAGE-A3负载DC疫苗用于脑胶质瘤治疗提供一定的实验证据,现报道如下。
1 资料与方法
1.1 一般资料
收集2018年1月至2019年8月在辽宁省健康产业集团铁煤总医院神经外一科首次接受手术切除的脑胶质瘤患者的病历资料。纳入标准:①经辽宁省健康产业集团铁煤总医院病理科副主任医师复核病理组织切片;②首次确诊,术前未经放疗、化疗、免疫治疗等。排除标准:合并免疫系统疾病、血液系统疾病、急慢性感染、严重肝肾功能障碍。根据纳入、排除标准,共纳入56例脑胶质瘤患者,男性35例,女性21例;年龄20~68岁,平均(47.41±12.59)岁;低分期(Ⅰ~Ⅱ)脑胶质瘤33例,高分期(Ⅲ~Ⅳ)脑胶质瘤23例;术后经病理确诊为胶质母细胞瘤28例,星形胶质细胞瘤11例,间变性星形细胞瘤15例,少突胶质细胞瘤2例。另选取15例脑外伤患者作为对照,男性11例,女性4例;年龄23~62岁,平均(44.80±11.98)岁。两组患者年龄、性别比较,差异均无统计学意义(P>0.05)。取56例脑胶质瘤患者的肿瘤组织标本和外周血标本及15例脑外伤患者经内减压后收集的脑组织标本进行后续研究。
1.2 主要试剂和仪器
MAGE-A3抗体、TIANamp FFPE DNA提取试剂盒均购自北京天根生化科技有限公司,SYBR Green PCR master Mix购自日本Takara公司,全细胞亚硫酸盐DNA甲基化修饰试剂盒购自美国ZYMO RESEARCH公司,Ficoll-Hypaque淋巴细胞分离液购自北京Solarbio科技有限公司,ELISPOT试剂盒购自澳大利亚MABTECH公司。MAGE-A3全基因组特异性多肽由上海强耀生物科技有限公司根据MAGE-A3多肽库的序列图合成。
1.3 研究方法
1.3.1 Westernblot法检测MAGE-A 3蛋白表达情况 取100 mg脑组织,置于预冷的研钵中,用眼科剪剪碎,研磨,加入蛋白酶裂解液消化,取上清置于2 ml EP管中,反复洗涤离心,提取组织总蛋白,分装-80℃保存。进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacryl amide gel electrophoresis,SDS-PAGE)垂直电泳,切取目标蛋白条带所在区域的凝胶,湿转法将蛋白转移至PVDF膜上,用脱脂牛奶封闭后,加入MAGE-A3一抗孵育过夜。洗涤,二抗孵育,洗涤后显色。用图像分析系统扫描蛋白条带的灰度值,采用GAPDH作为内参。
1.3.2 DNA抽提和MSP-PCR法检测MAGE-A 3基因甲基化状态 采用TIANamp FFPE DNA提取试剂盒提取组织DNA。取1.5 μg DNA样本进行亚硫酸盐修饰和纯化。取2 μg修饰后的DNA样本,进行甲基化特异性PCR。MAGE-A3甲基化引物序列:上游引物5'-ATTTAGGTAGGATTCGGTTTTC-3',下 游 引 物 5'-AAACTAAAACGTCTTCCCGCG-3';MAGE-A3非甲基化引物序列:上游引物5'-ATTTAGGTAGGATTTGGTTTTT-3',下 游 引 物 5'-AAACTAAAACATCTTCCCACA-3'。反应参数:95℃ 5 min,94℃ 30 s,60℃ 30 s,72℃ 20 s,循环35次,72℃再延伸5 min。将MSP产物进行2%琼脂糖凝胶电泳。
1.3.3 ELISPOT法[5]检测MAGE-A 3特异性CTL免疫反应 抽取肘静脉血3 ml,EDTA抗凝,采用密度梯度离心法提取外周血单个核细胞(peripheral blood mononuclear cell,PBMC),调整细胞浓度为3×106/ml。将PBMC加入至一抗包被硝酸纤维素膜的96孔板,加入MAGE-A3全基因组特异性多肽避光孵育过夜。分别用二抗、三抗孵育1 h,碱性磷酸酶系统显色液显色。
1.4 结果判断
1.4.1 MAGE-A 3蛋白表达结果 蛋白条带扫描灰度值>中位值则为高表达组,否则为低表达组。
1.4.2 MSP凝胶电泳结果 ①完全甲基化:甲基化引物扩增出目的条带,非甲基化引物未扩增出目的条带;②部分甲基化:甲基化引物和非甲基化引物均扩增出目的条带;③未甲基化:甲基化引物未扩增出目的条带,非甲基化引物扩增出目的条带。甲基化率=(完全甲基化+部分甲基化)例数/总例数×100%。
1.4.3 ELISPOT结果判断 以斑点形成细胞(spot formation cell,SFC)/106PBMC表示反应强度,SFC≥3倍阴性对照孔则视为阳性。
1.5 统计学方法
采用SPSS 17.0统计软件对数据进行处理。采用Kappa值判断一致性,Kappa值≥0.75表示一致性良好,0.75>Kappa值≥0.40表示一致性一般,Kappa值<0.40表示一致性较差;计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数及率(%)表示,组间比较采用χ2检验;相关性分析采用Spearman相关分析;以P<0.05为差异有统计学意义。
2 结果
2.1 MAGE-A 3蛋白表达量的比较
经Western blot法检测,56例脑胶质瘤组织中MAGE-A3蛋白表达量为(2.26±1.09),明显高于15例正常脑组织中的(0.44±0.18),差异有统计学意义(t=6.411,P<0.01)。(图1)

图1 Western blot检测脑胶质瘤组织和正常脑组织中MAGE-A 3蛋白表达情况
2.2 MAGE-A 3基因启动子甲基化状态的比较
经MSP-PCR法检测,脑胶质瘤组织中MAGE-A3基因启动子甲基化率为55.36%(31/56),明显低于正常脑组织的100%(15/15),差异有统计学意义(χ2=29.032,P<0.01)。(图2)

图2 脑胶质瘤组织和正常脑组织中MAGE-A 3甲基化分析
2.3 脑胶质瘤患者血清中MAGE-A 3特异性CTL免疫反应频率及强度
经ELISPOT法检测,脑胶质瘤患者血清MAGE-A3特异性CTL免疫应答阳性率为33.93%(19/56),平均反应强度为(2301.70±560.33)SFC/106PBMC。
2.4 脑胶质瘤组织中MAGE-A 3蛋白表达量与基因甲基化状态的关系
56例脑胶质瘤组织中,MAGE-A3蛋白高表达28例,低表达28例。MAGE-A3基因启动子甲基化表达的脑胶质瘤组织中MAGE-A3蛋白表达量为(1.71±0.63),明显低于未甲基化表达的脑胶质瘤组织的(2.95±1.17),差异有统计学意义(t=5.067,P<0.01)。经 McNemarχ2检验,脑胶质瘤组织中MAGE-A3基因启动子甲基化状态与MAGE-A3蛋白高表达结果一致(P=0.629);经Kappa一致性分析,同一患者脑胶质瘤组织中MAGE-A3基因启动子甲基化状态与MAGE-A3蛋白高表达结果一致性一般(Kappa=0.679,P<0.01)。
2.5 脑胶质瘤患者血清中MAGE-A 3特异性CTL免疫反应频率及强度与组织中MAGE-A 3蛋白表达量的关系
血清MAGE-A3特异性CTL免疫应答阳性患者脑胶质瘤组织中MAGE-A3蛋白表达量为(3.20±1.09),明显高于阴性患者脑胶质瘤组织中的(1.78±0.73),差异有统计学意义(t=5.805,P<0.01)。MAGE-A3蛋白高表达组织中CTL免疫应答反应强度为(2549.86±477.41)SFC/106PBMC,明显高于低表达组织中的(2053.54±532.85)SFC/106PBMC,差异有统计学意义(t=3.671,P<0.01)。
经McNemarχ2检验,脑胶质瘤患者血清MAGE-A3特异性CTL免疫应答阳性与组织中MAGE-A3蛋白高表达结果存在一定的差异(χ2=3.215,P=0.035);经Kappa一致性分析,同一患者血清MAGE-A3特异性CTL免疫应答阳性与组织中MAGE-A3蛋白高表达结果一致性一般(Kappa=0.464,P<0.01)。另外,经Spearman相关性分析,脑胶质瘤患者血清中MAGE-A3特异性CTL免疫反应强度与组织中MAGE-A3蛋白表达量呈正相关(r=0.788,P<0.01)。(表1)

表1 脑胶质瘤患者血清MAGE-A 3特异性CTL免疫应答与组织中MAGE-A 3蛋白表达情况
2.6 脑胶质瘤患者血清中MAGE-A 3特异性CTL免疫反应频率及强度与临床特征的关系
不同性别、年龄、病理类型、肿瘤位置的脑胶质瘤患者血清MAGE-A3特异性CTL免疫反应频率比较,差异均无统计学意义(P>0.05);不同肿瘤大小及临床分期的脑胶质瘤患者血清MAGE-A3特异性CTL免疫反应频率比较,差异均有统计学意义(χ2=7.004、8.887,P<0.01)。不同性别、年龄、临床分期、肿瘤大小、病理类型、肿瘤位置的脑胶质瘤患者血清MAGE-A3特异性CTL免疫反应强度比较,差异均无统计学意义(P>0.05)。(表2)
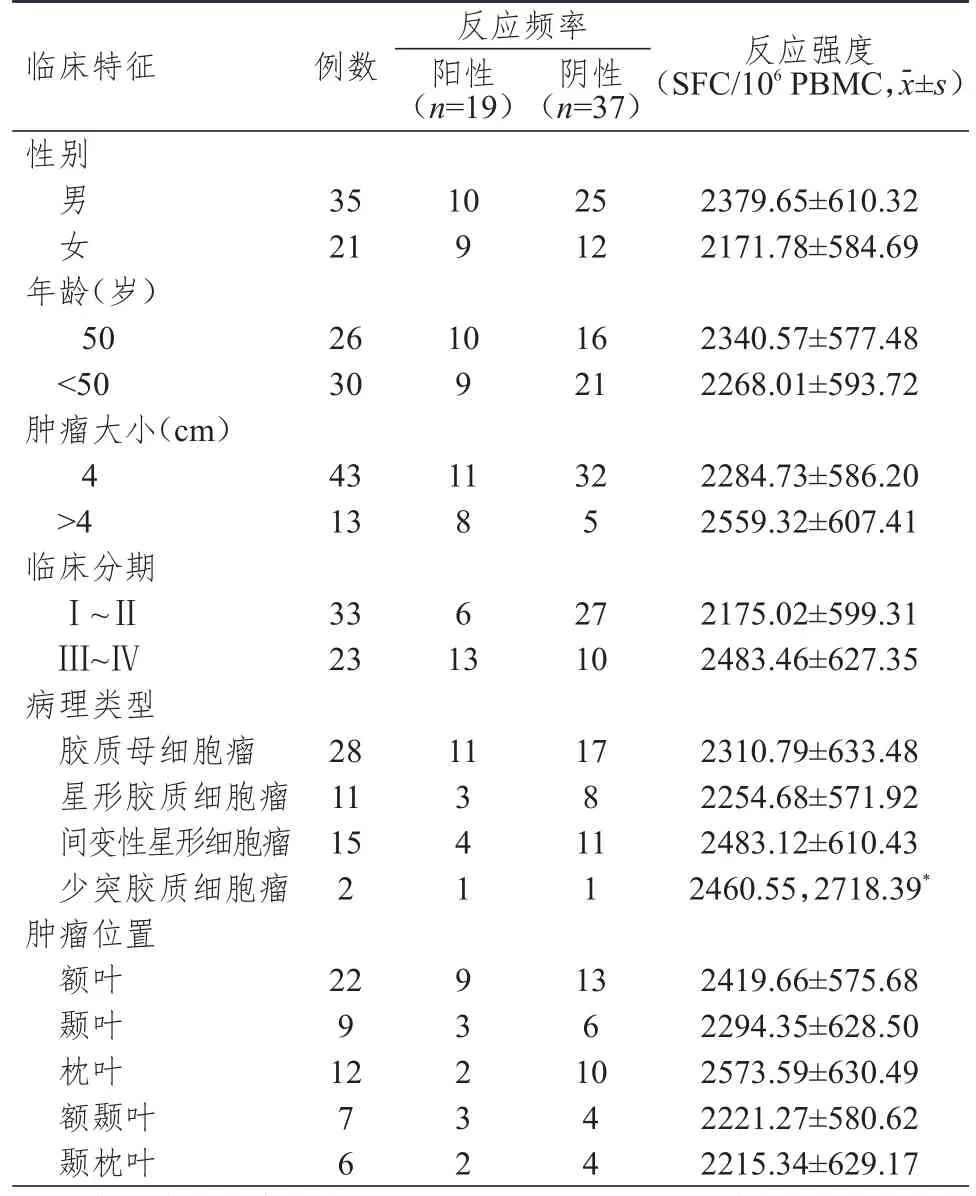
表2 不同临床特征的脑胶质瘤患者血清中MAGE-A 3特异性CTL免疫反应频率及强度( n=56)
3 讨论
近年来,MAGE-A基因亚家族成员在多种肿瘤发生、发展、预后、耐药中的作用已得到普遍证实[6-8],由MAGE-A编码的抗原肽由MHC-Ⅰ呈递诱发特异性CTL免疫反应,进而发挥抗肿瘤活性。董丹宁等[9]发现,汉族人群鼻咽癌患者血清中MAGEA1、MAGE-A3特异性CTL免疫反应强度高于维族人群,而且这种表达差异性与患者预后存在关联,因而推测深入探究癌症患者对肿瘤特异性抗原MAGE-A多肽产生的特异性CTL免疫反应有望为肿瘤的免疫治疗提供新的思路。但是随后刘凯等[10]通过检测51例食管癌初治患者血清MAGE-A3特异性CTL抗原表位肽刺激γ-干扰素的CTL免疫应答频率和强度,认为其与患者临床特征均无关,是否可作为食管癌免疫治疗的靶点尚需确认。
MAGE-A是MAGE家族成员之一,属于癌-睾丸抗原[11-12],在正常组织中表达量较低或不表达,但是却广泛表达于多种肿瘤组织和细胞中[13]。在本研究中,采用Western blot法检测证实MAGE-A3蛋白在脑胶质瘤组织中高表达,几乎是正常脑组织中MAGE-A3蛋白表达量的5倍。而且之前王柏清等[14]发现肿瘤细胞中MAGE-A3基因5'端CpG岛存在不同的甲基化状态以及特异性去甲基化位点,膀胱癌组织中MAGE-A3启动子区域DNA去甲基化率较高是导致肿瘤组织中MAGE-A3蛋白表达量升高的原因,也是膀胱癌发生发展的重要机制之一[15]。因此本研究也进一步通过MSP-PCR法检测脑胶质瘤组织中MAGE-A3基因甲基化状态,结果显示脑胶质瘤组织中MAGE-A3基因启动子甲基化率为55.36%(31/56),明显低于正常脑组织的100%(15/15),而且MAGE-A3基因启动子甲基化表达的脑胶质瘤组织中MAGE-A3蛋白表达量低于未甲基化表达的脑胶质瘤组织。经配对McNemarχ2检验,脑胶质瘤组织MAGE-A3基因启动子甲基化状态与MAGE-A3蛋白高表达结果一致(P=0.629);经Kappa一致性分析,同一患者脑胶质瘤组织MAGE-A3基因启动子甲基化状态与MAGE-A3蛋白高表达结果具有一致性,但是由于纳入的样本量偏少,也有可能因为患者病理类型、肿瘤分级存在差异等因素,二者的一致性一般(Kappa=0.679)。上述结果提示脑胶质瘤组织中MAGE-A3蛋白表达水平降低与启动子区DNA去甲基化有关。
此外,MAGE-A3作为一类重要的肿瘤特异性抗原,已有文献证实在多种癌症患者抗肿瘤免疫治疗中扮演着重要角色[16-18]。林知等[19]发现,负载乙肝核心抗原-MAGE-A3融合蛋白的外周血PBMC在体外对人非小细胞肺癌细胞具有一定的杀伤作用。但是MAGE-A3疫苗尚未全面用于临床推广,主要是由于该嵌合MAGE-A3抗原受体T细胞免疫疗法的适用人群尚不明确。王群和张嘉涛[20]曾将MAGE-A3抗原疫苗用于完全切除原发灶的ⅠB~ⅢA期MAGE-A3阳性的非小细胞肺癌患者,但是未得到明显的临床获益,观察组和对照组患者中位无疾病进展时间比较,差异无统计学意义(58.0个月vs56.9个月,P>0.05),上述结果也提示MAGE-A3疫苗的临床疗效和适用人群仍有待确认。因而在本研究中,进一步采用Gultured ELISPOT法检测脑胶质瘤患者血清中MAGE-A3特异性CTL免疫反应频率及强度,结果显示,血清MAGE-A3特异性CTL免疫应答阳性患者脑胶质瘤组织中MAGE-A3蛋白表达量高于阴性患者脑胶质瘤组织,而且脑胶质瘤患者血清中MAGE-A3特异性CTL免疫反应强度与组织中MAGE-A3蛋白表达量呈正相关性。虽然经配对McNemarχ2检验,脑胶质瘤患者血清MAGE-A3特异性CTL免疫应答阳性与组织中MAGE-A3蛋白高表达结果存在一定的差异,且两者Kappa一致性一般(Kappa=0.464<0.75),但是不能否认组织中MAGE-A3蛋白表达量升高是导致血清中MAGE-A3特异性CTL免疫反应频率和强度增加的重要原因之一,而且发现临床分期为Ⅲ~Ⅳ期患者的表达频率明显高于Ⅰ~Ⅱ期,肿瘤直径>4 cm患者的表达频率亦高于≤4 cm,说明MAGE-A3有望成为脑胶质瘤特异性免疫治疗的潜在免疫原。
综上所述,脑胶质瘤组织中MAGE-A3基因启动子区DNA去甲基化导致MAGE-A3蛋白表达量升高,进而刺激机体产生MAGE-A3特异性CTL免疫应答反应,从而促进脑胶质瘤细胞的增殖和恶性化程度。本研究为脑胶质瘤免疫研究提供一定的实验依据和线索,但仍需要从作用机制研究和扩大临床样本量进行临床试验两方面再深入综合验证本研究的结论。

