TACE不完全栓塞对兔VX2肝癌生长及Notch2通路的影响
芦凯,张帅,周石,程芝梅,徐圣杰,蒋天鹏△,李兴
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一,居全世界癌症相关死亡的第4位[1]。目前根治性切除术是早期HCC患者的主要治疗方式[2]。经肝动脉化疗栓塞术(transarterial catheter chemoembolization,TACE)指经股动脉穿刺送入导丝导管,在数字减影血管造影(digital subtraction angiography,DSA)机下超选择性插管至HCC的供血动脉后,经导管注入适量化疗药物和栓塞颗粒,从而诱导HCC缺血坏死及凋亡,是不能切除的中晚期HCC最主要的治疗方法[3]。然而,TACE术后患者的远期预后并不理想,这可能与不完全栓塞所致肿瘤不完全坏死有直接关系[4],但其具体机制尚未明确。Notch信号通路在肝脏发育[5]和肝癌进展[6-7]中的作用已被广泛认识,而肝癌中Notch信号通路与血管内皮生长因子(VEGF)密切相关[8]。TACE导致HCC局部缺氧和缺血性坏死,使缺氧诱导因子(HIF)活化和VEGF水平升高[3]。目前已有研究指出Notch信号通路参与超声不完全消融后残余肝癌的血管新生[8],TACE与超声消融同属HCC的介入治疗方式之一,均可引起HCC的不完全坏死[4,8],但TACE不完全栓塞对Notch2以及相关因子表达水平影响的相关研究较少。本研究通过建立兔VX2肝癌TACE不完全栓塞模型,检测TACE不完全栓塞前后肿瘤体积的变化及Notch2、HIF-1α、VEGF的蛋白水平,以探究TACE不完全栓塞对HCC的影响,为临床治疗HCC提供新思路。
1 材料与方法
1.1 材料清洁级新西兰大白兔18只[动物许可证号:SYXK(黔)2018-0001],均1月龄、体质量2 kg左右、雌雄各半,购自贵州医科大学实验动物中心;兔VX2肝癌细胞株购自广州吉妮欧生物科技有限公司;鼠源β-actin单克隆抗体、兔源Notch2单克隆抗体、鼠源HIF-1α单克隆抗体、鼠源VEGF单克隆抗体、羊抗兔及羊抗鼠IgG二抗购自Abcam公司;盐酸吡柔比星购自杭州翰晖制药有限公司;罂粟乙碘油注射液购自江苏恒瑞医药股份有限公司。超声设备(PHILIPS IU22);CT设备(SIEMENS Somatom DefinitionAS);DSA机(TOSHIBA INFX-9000C);光 学 显 微 镜(Nikon SMZ800N);蛋白电泳仪(Bio-Rad,Powerza)。
1.2 兔VX2肝癌模型建立根据随机数字表法抽取2只大白兔适应性喂养1周,双侧后腿外侧分别备皮、消毒、局麻,超声引导下5 F套管针穿刺进入后腿肌肉深部,退出针芯,经管鞘推入VX2细胞株,插入针芯后拔针,压迫止血并消毒包扎,常规喂养2周,待后腿肿瘤形成后建成荷瘤兔。实验兔(n=16)适应性喂养1周。操作前8 h禁食,4 h禁水。将VX2荷瘤兔用3%戊巴比妥钠(1 mL/kg)于耳缘静脉缓慢推注生效后,于后腿肿瘤体表投影区作纵行切口,暴露后腿肿瘤,于无菌条件下钝性取出肿瘤放于冰上培养皿,去除肿瘤周围肌肉、筋膜等组织后,剪取灰白鱼肉样肿瘤组织成1 mm3的小瘤块备用。实验兔麻醉方法同前,将实验兔用绷带固定于操作台,剑突下正中偏左1 cm区域备皮、消毒,用一次性手术刀逐层切开,暴露肝左叶于体外盐水纱布上,以5 F套管针鞘斜行刺入肝左叶深约1 cm,将备用小瘤块装满鞘管,在针芯配合下将小瘤块全部推送至肝脏内,用明胶海绵封堵穿刺道并压迫2 min,确认无出血及瘤块溢出后将肝左叶回纳入腹腔,逐层缝合切口,碘伏消毒、包扎。术后连续3 d肌注青霉素40万U/d预防感染。将所有实验兔采用随机数表法分为实验组(n=8)和对照组(n=8)。
1.3 超声筛查并监测肿瘤体积分别于瘤块植入后7、14、21 d行上腹部超声检测肿瘤是否生成并测量肿瘤体积,根据公式V=(1/2)×a×b2计算肿瘤体积(a为肿瘤最大径;b为肿瘤最小径)。
1.4 建立兔VX2肝癌TACE不完全栓塞模型瘤块植入后14 d行TACE不完全栓塞术。常规麻醉生效后,将所有实验兔用绷带固定于DSA检查床,右股动脉区备皮、消毒、铺敷,2%利多卡因5 mL局麻,沿股动脉走行纵行切开皮肤,暴露并钝性分离股动脉鞘,下穿4号线提紧远心端以使股动脉充盈,用20 G套管针穿刺成功后,下穿4号线将股动脉和20 G套管针固定后,退出针芯,引入EV3神经微导管、微导丝,透视下在T12~L1椎体水平依次找到腹腔动脉、肝总动脉、肝固有动脉及肝左动脉并超选至肝左动脉,手推造影确认后退出导丝回抽排空导管内气体,接高压注射器减影,造影剂总量5 mL,注射流率1 mL/s。确定肿瘤由肝左动脉供血后,实验组兔以10 mg吡柔比星加入5 mL造影剂混合成水溶液,再以水溶液∶碘油=8∶1配成碘油乳剂,透视下缓慢注入0.5 mL,待有反流至肝固有动脉及肝右动脉趋势时停止,注毕用0.5 mL生理盐水冲洗导管,再次高压减影见肝左动脉直径变窄,血流缓慢后结束手术。对照组兔经肝左动脉注入生理盐水1 mL。术毕拔管,结扎右侧股动脉,碘伏消毒股动脉鞘区,逐层缝合切口后再次消毒切口皮肤。术后肌注青霉素40万U/d,连用3 d预防感染。本研究将TACE不完全栓塞定义为:(1)术中DSA减影满足栓塞后肝左动脉仍可见造影剂通过,肿瘤染色加深。(2)术后CT可见瘤灶内碘油沉积不良的低密度区,增强呈轻度强化。(3)术后肝癌组织HE染色镜下除可见大量坏死细胞及癌细胞残影外,仍可见少量异常分化癌细胞[4,9]。
1.5 CT平扫+增强检查肿瘤形态及坏死程度分别于TACE不完全栓塞术前及术后7 d行CT平扫+增强检查。检查前8 h禁食,4 h禁饮,常规麻醉生效后,将实验组和对照组兔置于CT检查床上,腹带加压控制呼吸幅度,耳缘静脉建立通道,连接高压注射器,对比剂总量为10 mL(6 mL碘佛醇+4 mL生理盐水),注射速率1 mL/s。应用追踪系统监测膈水平主动脉,当对比剂密度达到峰值时扫描动脉期,间隔16 s后扫描门脉期。扫描所需管电压、管电流、扫描视野(field of view,FOV)分别为120 kV、250 mA、200 mm,扫描层厚2.5 mm。所有图像均以1 mm层厚重建。确诊HCC的CT标准为:平扫肝左叶见圆形、类圆形或不规则形低密度肿块影,边界不清(有假包膜者较清晰),增强扫描动脉期明显均匀或不均匀强化(肿瘤内坏死区不强化),门脉期强化程度迅速下降,延迟期强化程度持续下降呈相对低密度表现,全部增强过程表现为“快进快出”。
1.6 HE染色观察肿瘤细胞形态瘤块植入后21 d处死所有实验兔,暴露肝脏方法同前,钝性剥离并取出肝脏肿瘤,去除肿瘤周围正常肝脏及筋膜等组织,4%多聚甲醛固定,石蜡包埋切片,每只兔的肝癌组织选取最大切面做3张HE染色切片,400倍光镜观察并采集图像。
1.7 Western blot检测肝癌组织Notch2、HIF-1α及VEGF蛋白表达水平取所有实验组兔和对照组兔肝癌组织各100 mg,加入1 mL裂解液(RIPA∶PMSF=100∶1)置于冰上研磨30 min,然后12 000 r/min离心10 min,收集上清液,BCA蛋白定量法检测蛋白浓度。用10%SDS-PAGE凝胶分离蛋白,然后电转至PVDF膜上,5%脱脂牛奶室温封闭2 h,鼠抗β-actin(1∶2 000)、兔抗Notch2(1∶500)、鼠抗HIF-1α(1∶500)及鼠抗VEGF(1∶500)于4℃孵育过夜。将膜与辣根过氧化物酶标记的羊抗兔、羊抗鼠IgG(1∶10 000)二抗室温孵育2 h。现配ECL发光液浸泡条带,随后凝胶成像系统收集图像,Image J软件分析比较条带灰度值并计算表达量。每组实验重复3次。
1.8 统计学方法采用SPSS 20.0统计软件分析实验数据,符合正态分布的计量资料以±s表示,2组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤超声筛查及体积监测情况16只实验兔均成功建立VX2肝癌模型(图1);实验组DSA下均成功建立VX2肝癌不完全栓塞模型。瘤块植入后7 d(TACE不完全栓塞术前7 d)、14 d(即TACE不完全栓塞术当天)和21 d(即TACE不完全栓塞术7 d)肿瘤体积分别为实验组(0.40±0.33)、(1.30±0.90)、(2.42±0.97)cm3;对照组(0.34±0.35)、(1.76±0.69)、(6.79±4.76)cm3,瘤块植入后21 d实验组肿瘤体积明显小于对照组(n=8,t=2.543,P<0.05),7 d、14 d时2组肿瘤体积差异无统计学意义(t分别为0.348、1.147,均P>0.05)。
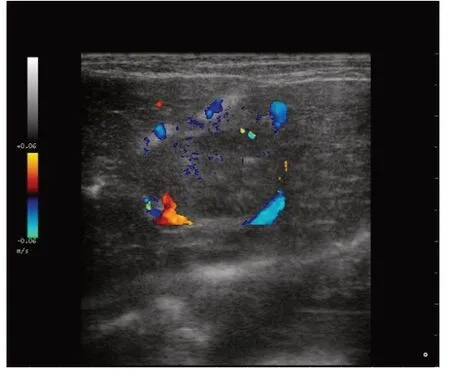
Fig.1 Ultrasound screening and volume monitoring of tumor图1 肿瘤超声筛查及体积监测情况
2.2 兔VX2肝癌TACE不完全栓塞模型的建立DSA下减影示肿瘤均由肝左动脉供血,未见其他变异及隐匿供血动脉。注入造影剂后,肿瘤大部分呈结节状染色,部分肿瘤呈先边缘环形染色,后逐渐向中央填充,肝左动脉末段及其分支增多、紊乱,包绕肿瘤,呈“抱球征”。经肝左动脉注入吡柔比星和碘油混合乳剂后见碘油乳剂逐渐沉积于瘤灶内,栓塞后减影见肝左动脉仍有造影剂缓慢通过,肿瘤染色加深,见图2。
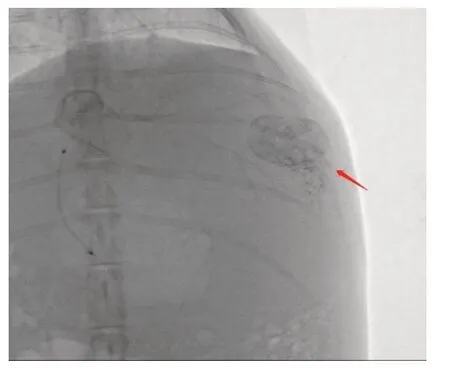
Fig.2 DSA subtraction of left hepatic artery after TACE incomplete embolization图2 TACE不完全栓塞后DSA肝左动脉减影情况
2.3 肿瘤形态及坏死程度CT表现TACE不完全栓塞术前CT平扫示实验组和对照组兔肝左叶均可见一类圆形低密度肿块影,边界欠清,部分呈分叶状,见图3A、B。增强动脉期肿块呈明显均匀/不均匀强化,与周围肝实质分界清晰。门脉期和延迟期,造影剂逐渐退出,肿块强化程度逐渐下降呈相对低密度。术后7 d再次行CT平扫+增强检查显示:实验组肿瘤内弧形及斑片状高密度碘油沉积,表示肿瘤已坏死,另见碘油沉积不良的低密度区,系肿瘤未坏死实性部分,见图3C、D,增强动脉期呈轻度强化,代表残存肿瘤;对照组除肿瘤体积增大外,余较术前变化不大。
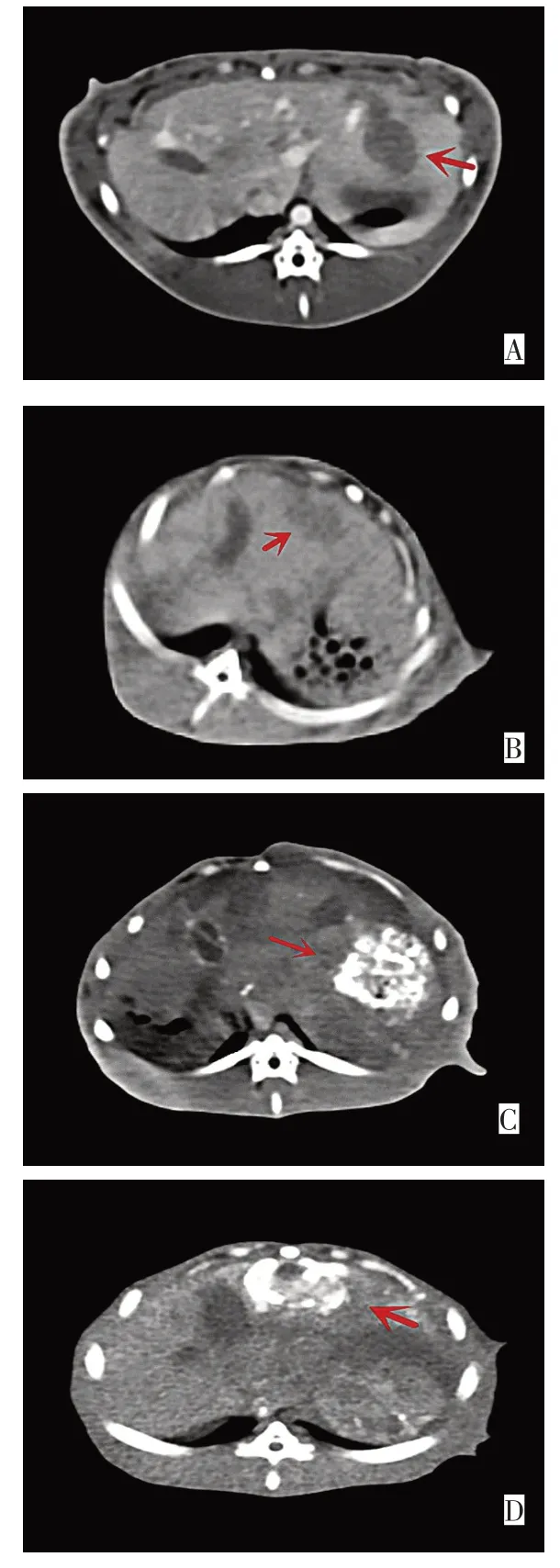
Fig.3 CT findings of tumor morphology and degree of necrosis before and after TACE incomplete embolization图3 TACE不完全栓塞前后肿瘤形态及坏死程度CT所见
2.4 2组肝癌组织HE染色情况对照组肝癌组织由大量肝癌细胞及血窦状间隔构成,由于血管的分隔较少,肿瘤细胞大部分呈片状分布,少部分呈巢状分布,瘤巢间无明显纤维间质。肿瘤细胞核深染且不规则,异型性明显,见图4A;实验组肝癌组织中心可见大片坏死细胞及少量肝癌细胞残影,周边可见少量残存肝癌细胞,核深染,异型性明显,见图4B。
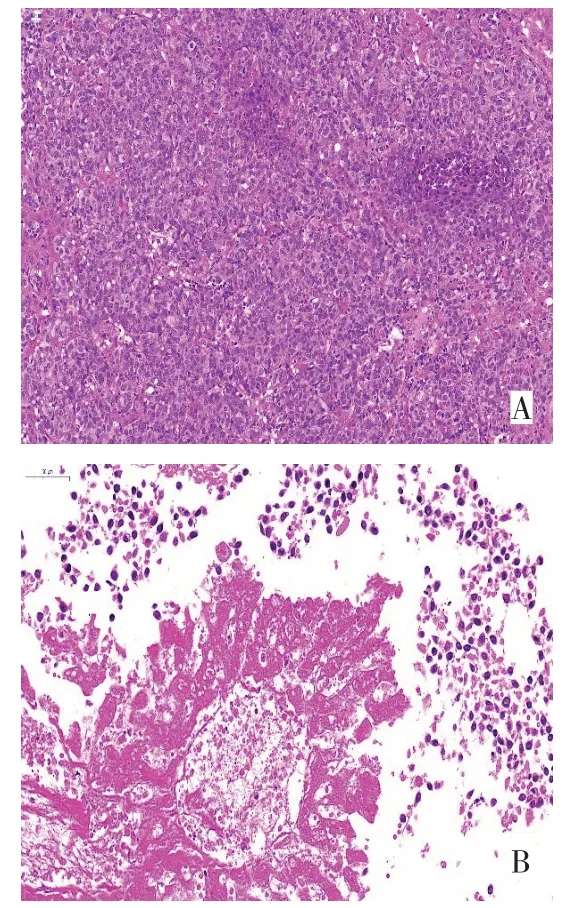
Fig.4 HE staining of tumor tissues in two groups(×400)图4 2组肝癌组织HE染色(×400)
2.5 TACE不完全栓塞对肝癌组织HIF-1α、Notch2及VEGF蛋白表达水平的影响实验组HIF-1α蛋白表达水平明显高于对照组(P<0.05),2组间Notch2与VEGF蛋白表达水平比较差异无统计学意义,见图5、表1。
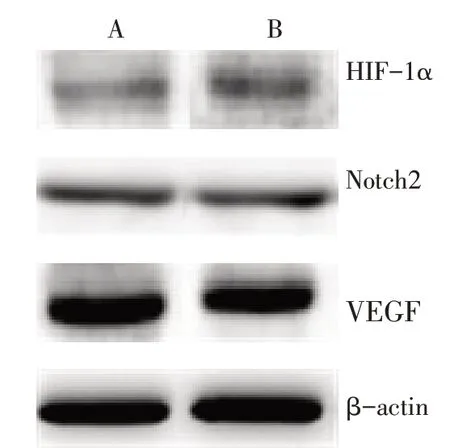
Fig.5 Expression levels of HIF-1α,Notch2 and VEGF proteins of hepatocellular carcinoma tissues in two groups图5 2组肝癌组织HIF-1α、Notch2及VEGF蛋白表达水平
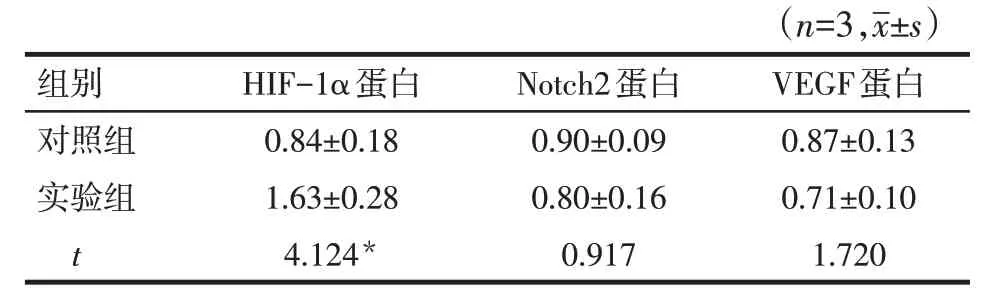
Tab.1 Expression levels of HIF-1α,Notch2 and VEGF proteins of hepatocellular carcinoma tissues in two groups表1 2组肿瘤HIF-1α、Notch2及VEGF蛋白表达水平
3 讨论
目前,原发性肝癌发病率居我国恶性肿瘤第4位及癌症相关致死原因第2位,严重危害我国公民的生命健康[10]。大多数HCC患者发现时已是中晚期,手术切除已无法获得良好预后,而TACE通过使用碘化油作为携带化疗药物的载体,使两者形成碘油乳剂沉积于HCC瘤灶内,持续发挥化疗药物对HCC的细胞毒性作用,再通过使用栓塞颗粒阻塞HCC的供血动脉而阻断肿瘤的营养供给,既可减轻全身化疗不良反应,又可达到“杀死”及“饿死”HCC的目的,相比保守及支持治疗,TACE治疗具有更明显的生存优势且安全性高[11],已成为中晚期HCC局部治疗最常用的方法[12]。TACE术后有残瘤的情况难以避免,如TACE术后肿瘤不完全坏死,这可能与HCC的肝动脉、门静脉双重供血,血管再通,栓塞后大量侧支循环形成以及TACE不完全栓塞有关[4]。但是,TACE不完全栓塞对HCC的影响目前却鲜有报道。根据改良实体瘤疗效评价标准[9]和卢维[4]的研究,本研究建立了兔VX2肝癌TACE不完全栓塞模型,除CT及HE染色结果以外,本研究增加DSA减影,用3种检查结合的方式证明兔VX2肝癌TACE不完全栓塞模型建立成功。
有研究表明TACE可造成HCC局部缺氧微环境,诱导HIF-1α高表达,进而上调下游靶基因VEGF,加速HCC血管新生[13],这可能进一步使残存肿瘤进展、转移,导致长期疗效不佳。Hayashi等[14]研究发现,Notch2通过对其下游靶基因Split多毛增强子1(HES1)的正向调控及上皮型钙黏蛋白(Ecadherin)的负向调控,促进HCC细胞向不成熟细胞转化,并增强HCC的侵袭及迁移能力,提示Notch2与HCC的发生密不可分。且HIF-VEGF-Notch信号通路参与超声不完全消融后HCC残瘤的进展[8]。临床上常使用TACE与超声消融联合的方式治疗HCC,但Notch2通路及相关因子在TACE不完全栓塞所致HCC残瘤中的表达情况尚不明确。本研究中实验组TACE不完全栓塞术后7 d肝肿瘤体积明显小于同期对照组,与Song等[15]使用常规TACE研究结果一致。实验组肝癌组织HIF-1α蛋白表达水平明显高于对照组,与陈锦隆等[16]使用常规TACE研究结果一致,提示TACE不完全栓塞对HCC生长有抑制作用,并且可以形成缺氧微环境,诱导HIF-1α高表达。实验组TACE不完全栓塞后HCC的Notch2及VEGF蛋白表达水平与对照组比较差异无统计学意义,结合既往研究分析,考虑出现种结果的原因可能有3个:(1)检测的HCC组织TACE不完全栓塞术后碘油沉积不均匀,导致不同肿瘤、同一肿瘤内不同区域的细胞活性不一,从而影响HCC细胞蛋白的表达[17-18]。(2)本实验选择的碘油乳剂比例为水溶液∶碘油=8∶1,碘油占比过低造成的不完全栓塞,或术后短时间血管再通导致肿瘤血供丰富。(3)肿瘤存在难以被发现的隐匿供血动脉。邓博文等[19]研究发现,HCC除由正常肝动脉供血外,其他肝外动脉也可能参与供血,如肾上腺动脉等。TACE不完全栓塞后肿瘤仍可获得较多血流及养分,可能导致肿瘤不会主动激发新生血管来获得营养,因此可能不会刺激VEGF及相关蛋白Notch2升高。
根据原发性肝癌诊疗规范(2019版),TACE的适应证已由中国肝癌分期为Ⅰb期~Ⅲa期扩大至Ⅰb期~Ⅲb期患者,但肝功能Child-Pugh分级为C级的HCC患者已属Ⅳ期,目前除了对症支持、舒缓疗护以及肝移植外,尚无其他较好的治疗方式。Child C级HCC患者一般情况差,肝功能严重障碍,而TACE在阻断HCC供血动脉的同时也阻断了一部分正常肝细胞的血液营养供应,这可能导致诸如肝功能衰竭等一系列严重并发症,危及患者生命,因此TACE目前无法应用于Child C级HCC患者[20]。本研究结果显示,TACE不完全栓塞对HCC的生长有一定抑制作用。与常规TACE相比,TACE不完全栓塞后的正常肝组织能获得较多的血液及营养供给。因此,笔者推测针对一般情况差、无合适的健康肝源进行肝移植,但仍有非保守治疗意愿的肝功能Child C级HCC患者,可以采用TACE不完全栓塞的方式进行治疗,可能在肝功能损伤较小的情况下延缓肿瘤的进展,降低TACE术后肝衰竭的发生率,延长患者的生存期。Notch2是促进HCC生长及迁移的重要因子[6]。本研究的局限性在于仅探讨了TACE不完全栓塞前后HCC中Notch2蛋白表达水平的变化情况,并未行TACE完全栓塞作对照实验,因此TACE栓塞程度对HCC中Notch2蛋白表达水平的影响尚不能定论。在今后的实验中在向HCC供血动脉注射碘油乳剂时,需采用更合适的比例,并加用明胶海绵或空白微球栓塞,同时增加TACE完全栓塞组进行对照,使研究更加完善。
综上所述,TACE不完全栓塞对兔VX2肝癌生长有抑制作用,并且可以形成肿瘤缺氧微环境,诱导HIF-1α高表达,为目前有非保守治疗意愿的肝功能Child C级HCC患者的治疗提供了新思路。

