应用Het-1A细胞系研究CDDO-Me对食管黏膜上皮屏障的保护作用
程凌雪,范永强,侯超,李文波
胃食管反流病(gastroesophaeal reflux disease,GERD)是消化系统常见的慢性疾病,严重影响患者的心理和生活质量。我国GERD发病率呈逐年上升趋势[1]。目前GERD的治疗以质子泵抑制剂(proton pump inhibitor,PPI)抑酸为主,但有高达30%的患者对PPI治疗反应欠佳[2],寻求新的GERD防治策略很有必要。食管黏膜上皮屏障功能损害是GERD的重要发病机制[3]。当屏障功能受损时,细胞通透性增加并出现细胞间隙增宽,胃十二指肠内容物逆行弥散进入上皮层,损害食管黏膜,从而产生GERD的临床症状。研究发现,核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)可调控食管黏膜上皮屏障功能,敲除小鼠Nrf2会降低其食管黏膜上皮的跨上皮电阻抗(transepithelial electrical impedance,TEER)和增加食管黏膜上皮的细胞间隙,故而小鼠出现食管黏膜上皮屏障功能下降[4]。2-氰基-3,12-二氧代齐墩果烷-1,9-二烯-28-酸甲酯(2-cyano-3,12-dioxooleana-1,9-dien-28-oic acid,CDDO-Me)是一种合成的齐墩果烷三萜类化合物,是有效的Nrf2激活剂,并可增强抗氧化反应[5]。CDDO-Me是否可通过激活Nrf2途径增强食管黏膜上皮的屏障功能,目前尚少见相关报道。本研究以Het-1A细胞系建立食管黏膜上皮屏障模型,观察CDDO-Me对食管黏膜屏障的保护效应,探讨CDDO-Me作为黏膜屏障增强剂的可行性。
1 材料与方法
1.1 细胞系、主要实验仪器及试剂Het-1A细胞(永生化人食管鳞状上皮细胞)购自美国组织培养库(ATCC)。倒置显微镜购自日本OLYMPUS公司;低速离心机购自德国Eppendorf公司;细胞电阻仪Millicell ERS-2购自美国Millipore公司;共培养小室、细胞培养皿、细胞培养瓶购自美国Corning公司;培养基BEBM、BEGM Single Quots购自瑞士LonzA公司;血清、L-15、Trypsin-EDTA购自美国Gibco公司;牛血清白蛋白(BSA)购自美国EQUITECH-BIO公司;CDDOMe、纤连蛋白(fibronectin)、牛Ⅰ型胶原蛋白(bovine collagen typeⅠ)购自美国Sigma公司。
1.2 方法
1.2.1 Het-1A细胞培养Het-1A细胞接种到包被好的培养方瓶中,37℃、5%CO2饱和湿度条件下培养。细胞的密度达到80%时进行传代,加入1 mL Trypsin-EDTA溶液(含0.5%聚乙烯吡咯烷酮,PVP)消化细胞,显微镜下观察,消化5~10 min,可看到细胞相互分离变圆,即消化完成;加入3 mL含0.1% FBS的L-15终止消化,用BEBM培养基悬浮细胞,按1∶3的比例接入包被好的方瓶中,37℃、5%CO2饱和湿度条件下扩大培养。
1.2.2 酸处理细胞共培养小室包被,过夜后PBS润洗2遍;提前1 d使用3%的盐酸调整培养基pH分别为4、5、6;取处于对数生长期,生长状态良好的Het-1A细胞,加入胰蛋白酶Trypsin-EDTA(含0.5%PVP)消化细胞成细胞悬液,血球计数板计数,调整细胞密度为2.5×105个/mL,在共培养小室上室加入1 mL细胞悬液,下室加入1 mL无细胞的培养基,37℃、5%CO2饱和湿度条件下培养;待共培养小室上室细胞长满后,按照实验分组,即pH4组、pH5组、pH6组、对照组,分别用pH为4、5、6的培养基及正常培养基对细胞进行处理,37℃、5%CO2饱和湿度条件下分别培养5、10、30、60 min后上下室培养基全更换为正常培养基(包括对照组),每组3个复孔,每孔选3个位点检测各小室的电阻,同时设空白组;记录每次检测的电阻值。
1.2.3 CDDO-Me处理细胞待共培养小室上室细胞长满后,按CDDO-Me浓度分组对细胞进行处理,即用含0、0.25、0.5、1、2.5、5μmol/L CDDO-Me的培养基培养,培养时间为6、12、24、48 h,37℃、5%CO2饱和湿度条件下分别培养相应的时间后,再以酸处理细胞筛选出TEER较对照组变化最大的pH值及处理时间继续培养,即pH为4的培养基培养60 min,每组3个复孔,每孔选3个位点检测各小室的电阻,同时设空白组;记录每次检测的电阻值。
1.2.4 细胞TEER计算根据检测所得的电阻值,依次计算各复孔电阻值的平均值(R总),根据公式计算每个组Het-1A细胞的TEER:TEER(Ω·cm2)=(R总-R空白)×膜面积,有效膜面积0.6 cm2。分析各组细胞TEER变化情况。
1.3 统计学方法使用SPSS 17.0软件进行统计学分析。所有实验数据以均数±标准差(±s)表示。多个时间点阻抗变量统计分析采用重复测量设计的方差分析,分析某一因素时多组样本均数比较采用单因素方差分析,其中组间多重比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 Het-1A细胞生长情况倒置显微镜下观察,Het-1A细胞生长状态良好,形态饱满,排列紧密,可作为实验细胞模型,见图1。
Fig.1 Light microscope observation of the cell growth(×100)图1 光镜观察细胞的生长情况(×100)
2.2 不同酸度和作用时间对食管上皮细胞TEER的影响重复测量设计的方差分析结果示,球形检验结果满足球形分布假设(P>0.05),不同处理时间(F=100.695)、不同pH处理因素(F=55.532)、pH和处理时间的交互作用(F=12.672)对TEER值的影响有统计学意义(均P<0.01),因此,分析pH和作用时间的单独效应。
对照组中,不同处理时间TEER比较差异无统计学意义(P>0.05)。pH为4、5、6时,不同处理时间对Het-1A细胞的TEER作用比较差异均有统计学意义(P<0.01),随着处理时间(10、30、60 min)的延长,TEER下降幅度越大。处理时间为5 min时,各组TEER比较差异无统计学意义(P>0.05);处理时间为10、30、60 min时,各组间差异均有统计学意义,以pH4组60 min时TEER下降最明显,见表1。
Tab.1 Changes of cell TEER values at different time points between different pH treatment groups表1 各pH处理组间不同时点细胞TEER的变化 (n=3,Ω·cm2,±s)

Tab.1 Changes of cell TEER values at different time points between different pH treatment groups表1 各pH处理组间不同时点细胞TEER的变化 (n=3,Ω·cm2,±s)
**P<0.01;a与对照组比较,b与pH4组比较,A与同组30 min时比较,P<0.05
组别对照组pH4组pH5组pH6组F 5 min 62.53±2.27 57.33±4.00 59.93±1.92 62.53±1.63 2.701 10 min 62.27±3.07 49.53±0.90a 54.80±2.50ab 57.67±2.72 14.286**30 min 64.27±1.40 40.87±3.35a 49.27±3.97ab 53.00±2.11a 33.869**60 min 61.20±3.14 29.93±2.89aA 41.13±2.02abA 46.47±2.76aA 67.667**F 0.732 45.681**26.078**25.480**
2.3 不同浓度及作用时间的CDDO-Me预刺激对食管上皮细胞TEER的影响球形检验结果满足球形分布假设(P>0.05),不同处理时间(F=50.045)、不同CDDO-Me浓度(F=32.357)、CDDO-Me浓度和处理时间的交互作用(F=7.907)对TEER值的影响有统计学意义(均P<0.01),因此,分析CDDO-Me浓度和处理时间的单独效应。
处理时间6 h时,不同浓度CDDO-Me预刺激组TEER比较差异无统计学意义(P>0.05)。12、24、48 h时,不同浓度CDDO-Me预刺激组TEER比较差异均有统计学意义(P<0.05),24 h时,随着刺激浓度的增加,各组TEER逐渐升高,以5μmol/L组最明显(P<0.05)。CDDO-Me预刺激浓度为0.25μmol/L时,各时点TEER比较差异无统计学意义(P>0.05);浓度为0.5、1、2.5、5μmol/L时,各时点间差异均有统计学意义(P<0.05);浓度为2.5μmol/L时,24 h、48 h TEER值均较前一时点升高(P<0.05),见表2。
Tab.2 Changes of cell TEER values at different time points between different CDDO-Me pre-stimulated concentrations表2 各CDDO-Me预刺激浓度间不同时点细胞TEER的变化 (n=3,Ω·cm2,±s)
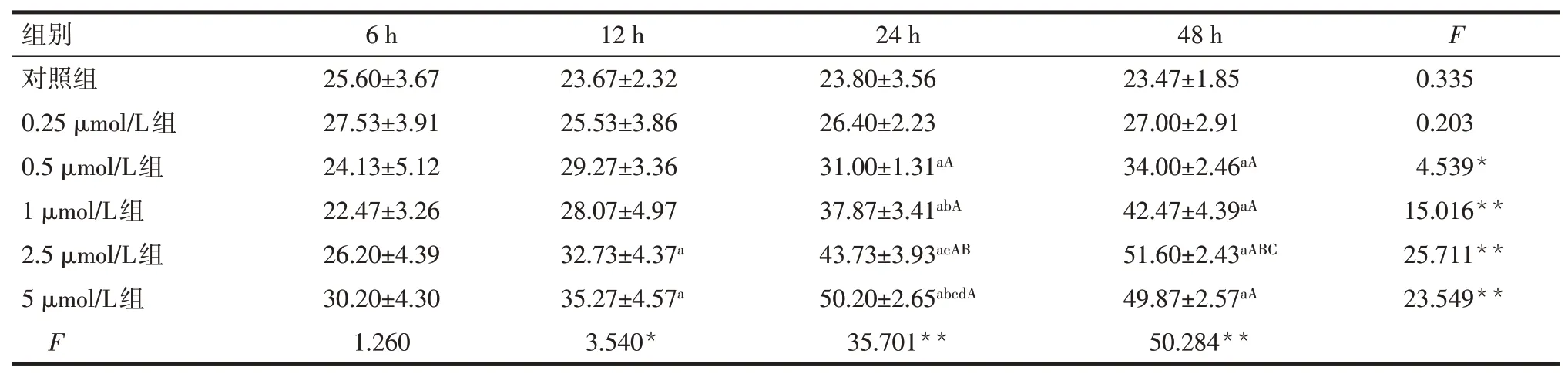
Tab.2 Changes of cell TEER values at different time points between different CDDO-Me pre-stimulated concentrations表2 各CDDO-Me预刺激浓度间不同时点细胞TEER的变化 (n=3,Ω·cm2,±s)
*P<0.05,**P<0.01;a与对照组比较,b与0.5μmol/L组比较,c与1μmol/L比较,d与2.5μmol/L组比较,A与同组6 h比较,B与同组12 h比较,C与同组24 h比较,P<0.05
组别对照组0.25μmol/L组0.5μmol/L组1μmol/L组2.5μmol/L组5μmol/L组F 6 h 25.60±3.67 27.53±3.91 24.13±5.12 22.47±3.26 26.20±4.39 30.20±4.30 1.260 12 h 23.67±2.32 25.53±3.86 29.27±3.36 28.07±4.97 32.73±4.37a 35.27±4.57a 3.540*24 h 23.80±3.56 26.40±2.23 31.00±1.31aA 37.87±3.41abA 43.73±3.93acAB 50.20±2.65abcdA 35.701**48 h 23.47±1.85 27.00±2.91 34.00±2.46aA 42.47±4.39aA 51.60±2.43aABC 49.87±2.57aA 50.284**F 0.335 0.203 4.539*15.016**25.711**23.549**
3 讨论
食管上皮屏障包括结构屏障和功能屏障两类[6]。结构屏障包括角质层上皮细胞的管腔侧细胞膜和上皮细胞间连接复合物。功能屏障包括细胞内和细胞间缓冲体系、细胞膜上的离子转运系统。食管上皮作为屏障,将有害的酸性反流物限制在食管腔内,并将其与食管伤害感受器分开[7]。食管上皮是非角化的复层鳞状上皮,提供渗透性屏障。在食管上皮细胞之间存在紧密的细胞间连接,以维持食管上皮屏障的完整性并限制细胞旁离子扩散[8]。
反流刺激物(如反流的胃酸)最初通过攻击细胞间连接复合物而导致食管上皮损伤,从而导致跨膜屏障功能降低以及细胞通透性增加[9]。研究表明,反流物刺激食管黏膜产生氧化应激或炎症反应,造成食管上皮屏障功能障碍[10]。反流物可通过直接或间接作用损伤食管黏膜上皮屏障,其中胃酸是主要损伤因素[11]。研究证实,当食管黏膜屏障受损时,离子通透性增加,TEER降低[12]。因此,本研究通过测量细胞TEER来评估食管黏膜上皮屏障功能的完整性。
本研究发现弱酸损伤食管上皮屏障功能,以pH4组60 min时TEER下降最明显,提示酸度越强,接触时间越长,食管上皮功能损伤越重。Farre等[13]研究发现,食管黏膜暴露于酸性和弱酸性溶液,出现细胞间隙扩张,进而损伤食管黏膜完整性,与本实验结果类似。
Nrf2是细胞内重要的转录因子,其参与的信号通路是细胞内重要的抗氧化应激机制[14]。在正常生理条件下,Nrf2与其生理抑制剂Kelch样ECH相关蛋白1(kelch-like ECH-associated protein 1,Keap1)结合[15]。Keap1通过蛋白-蛋白酶体途径介导Nrf2的降解。当活性氧过表达或亲电性物质刺激时,Keap1失活,导致Nrf2从蛋白酶体途径中释放出来并转移到细胞核中,随后Nrf2与小的Maf蛋白形成异二聚体,并与靶基因的抗氧化反应元件(ARE)结合,发挥抗氧化应激作用,防止细胞凋亡[16]。
抗氧化反应中的Keap1-Nrf2轴发挥关键作用,而CDDO-Me具有影响Keap1构象变化的能力,从而降低其催化Nrf2进行降解的能力,上调Nrf2,发挥抗氧化作用,因此该轴可作为CDDO-Me在疾病治疗中使用的基础模型[17]。作为一种无细胞毒性和多功能的药物,CDDO-Me已在临床试验中应用于氧化应激相关的疾病如慢性肾病和癌症的治疗[18-19]。本研究发现,CDDO-Me对于酸对食管黏膜上皮屏障的损害有保护作用,其保护效应与CDDO-Me的浓度及作用时间有关。CDDO-Me用于胃食管反流病治疗具有潜力,但其疗效和安全性需更多动物实验及临床试验验证。
综上所述,酸损害食管上皮屏障功能,与酸度和作用时间有关;CDDO-Me可干预酸损害食管上皮屏障功能,对食管黏膜上皮屏障具有保护作用。本研究为探索CDDO-Me作为药物治疗胃食管反流病奠定了基础。

