托珠单抗和硫唑嘌呤对NMOSD患者视神经炎后视神经变化的影响
杨俊峰,曾培,杜琛,江枫,张瑞,李晓文,张超,王春阳,3△
视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorder,NMOSD)是一种严重的中枢神经系统自身免疫性疾病,主要累及视神经和脊髓,具有高复发率和高致残性。病变累及视神经时,常造成明显的视力下降,甚至失明[1]。NMOSD急性期,由水通道蛋白(AQP)4-IgG介导异常的补体活化[2-3],引起星形胶质细胞损害,导致视网膜神经节细胞(RGCs)轴突坏死,进而凋亡、丢失,造成单眼或双眼视神经炎(ON)。RGCs层、内丛状层(GCIP)和视神经纤维层统称为神经节细胞复合体(GCC),可随着RGCs死亡而变薄。整个视网膜约1/2的RGCs位于黄斑区,因而黄斑区GCC及由视神经节细胞轴突构成的视盘周围视网膜神经纤维层(RNFL)厚度可用于评估RGCs的丢失情况[4-6]。
光学相干断层成像术(OCT)是一种无创高分辨率组织横断面断层扫描成像检测方法,可敏感地测定GCC和RNFL厚度,对ON后视神经变化进行动态观察。此外,视觉诱发电位(VEP)能客观反映视神经电生理功能变化。NMOSD-ON后视神经可能会发生缓慢的继发性变性。目前,临床上有多种药物用于防止NMOSD的复发,包括经典的口服免疫抑制剂硫唑嘌呤、吗替麦考酚酯,以及抗CD20单抗利妥昔单抗、白细胞介素-6受体阻断剂托珠单抗等[7-9]。托珠单抗和硫唑嘌呤被用于NMOSD的长期治疗中,但这两种药物对视网膜及视神经的影响暂不明确[9]。本研究旨在通过OCT和VEP对NMOSD患者ON后视网膜和视神经的动态变化进行观察,探讨托珠单抗和硫唑嘌呤对视神经功能的影响。
1 对象与方法
1.1 研究对象收集2017年11月—2020年3月天津医科大学总医院神经内科收治的NMOSD确诊患者102例,NMOSD均符合2015年视神经脊髓炎(NMO)诊断国际专家组(IPND)诊断标准[10]。纳入标准:(1)患者血清AQP4抗体阳性。(2)患者既往至少有1次ON病史。(3)基线时间距离上次ON发作至少间隔6个月。(4)患者随访期间规律使用小剂量激素合并托珠单抗或者小剂量激素合并硫唑嘌呤治疗方案,基线前3个月内未使用其他免疫抑制剂。排除标准:(1)距首次视力、OCT、VEP检查时间小于1年。(2)随访期间发生复发ON。(3)青光眼及其他明确的眼部疾患病史者。(4)既往有糖尿病病史者。(5)既往有梅毒等感染病史。本研究共纳入患者67例,托珠单抗组33例,受累眼42只,治疗1.3~17.5个月,平均6.4个月;硫唑嘌呤组34例,受累眼44只,治疗1.4~15.8个月,平均5.9个月。
1.2 视力检查采用人工照明,照明强度为300 lx。最佳最小分辨角对数(LogMAR)视力应用早期治疗糖尿病性视网膜病变研究(ETDRS)视力表,低对比度视力采用2.5%对比度Sloan字母表(美国Precision-Vision公司),检查距离均为2.52 m。检查时用挡眼板遮盖非受累眼,双眼先后单独进行测试。主观视力指患者主观的用眼感受和视觉体验,主要指患者自己是否感觉到视物模糊或者视力下降。
1.3 VEP检查根据国际神经生理学联合会共同协作指南,分别在患者基线和随访时在标准背景办公室照明系统下(肌电图和诱发电位响应装置,美国尼科莱特),以棋盘格翻转模式给予左、右眼图像刺激,以额中线(Fz)为接地电极,中线中央(Cz)为参考电极,从枕中线(Oz)电极记录视觉皮层诱发电位(P100)。没有检测出VEP潜伏期或波幅的参与者分别记录为200 ms和0μV。
1.4 OCT检查使用光谱域光学相干断层扫描仪(Optovu,Inc,RTVue100-2)在以视神经为中心,直径3.4 mm的范围内进行环形扫描,并在以视神经为中心,直径3.45 mm范围内进行放射状和环形扫描,测量视乳头周围RNFL(pRNFL)厚度。在黄斑区GCC扫描中,将RGCs层、GCIP和黄斑RNFL三层的总和计为一个GCC厚度。由一位经验丰富的神经内科辅助检查室评估人员仔细检查扫描质量,辨别并更正分割错误。本研究根据OCT研究专门术语和基本要素使用规范(APOSTEL)的建议进行OCT数据报告[11]。
1.5 临床资料收集收集患者一般情况,包括性别、年龄、病程等,完善双眼视力、OCT、VEP检查。距基线时间后1年以上,再次完善双眼视力、OCT、VEP检查,分析ON的受累眼检测结果。
1.6 统计学方法采用SPSS 17.0软件进行统计学分析。用Shapiro-Wilk normality test和Kolmogorov-Smirnov test检验计量资料正态性,均符合正态分布,以均数±标准差(±s)表示,2组间比较采用独立样本t检验,组内比较用配对t检验;计数资料以例(%)表示,计数资料的比较采用χ2检验或Fisher精确检验,以P<0.05为差异有统计学意义。
2 结果
2.1 2组患者基线临床资料比较托珠单抗组和硫唑嘌呤组患者的性别、年龄、病程、视力及VEP和OCT检查结果差异均无统计学意义(P>0.05),见表1、2。
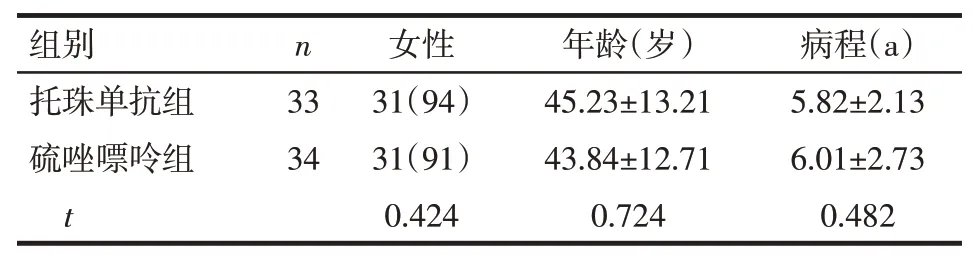
Tab.1 Comparison of baseline data of NMOSD patients between the two groups表1 2组NMOSD患者的基线资料比较
2.2 受累眼视觉功能用药前后变化与用药前相比,用药后所有患者均未察觉主观的视力下降,且所有受累眼的LogMAR视力和低对比度视力均无明显变化(P>0.05)。与用药前相比,2组患者用药后VEP P100波幅降低,受累眼黄斑区GCC厚度和视乳头周围pRNFL厚度减少(P<0.01);硫唑嘌呤组VEP P100潜伏期延长(P<0.01),而托珠单抗组VEP P100潜伏期无明显变化,见表2。

Tab.2 Changes in the visual function of the optic neuritis eyes in the tocilizumab group and azathioprine group表2 2组患者的受累眼视觉功能前后变化
2.3 2组视觉功能变化值间的差异2组患者LogMAR视力、低对比度视力变化值,黄斑区GCC厚度、视乳头周围pRNFL厚度降低程度,VEP P100潜伏期延长程度均无明显差异(P>0.05),而硫唑嘌呤组VEP P100波幅降低幅度较托珠单抗组大(P<0.05),见表2。
2.4 NMOSD-ON受试眼OCT检查的前后变化分别选取2例托珠单抗组患者和2例硫唑嘌呤组患者比较。较基线水平相比,4例患者LogMAR视力和低对比度视力治疗前后均无明显变化,但1年后却出现GCC和pRNFL厚度明显下降,见图1、2。
3 讨论
NMOSD视神经炎急性期常出现单眼或双眼ON和轴索损伤,这些病理变化常由AQP4-IgG引起,其介导星形胶质细胞损害,异常的补体活化[2-3],导致RGCs死亡,黄斑体积减少,进而出现严重的视功能障碍。随着病程进入缓解期,是否会发生持续的视神经的变性萎缩及其程度存在争议[12-13]。相关研究发现,即使没有ON复发病史,视网膜和视辐射也会发生结构上的变化。但长期的免疫调节治疗是否可延缓视神经变性尚不清楚。黄斑区GCC最能真实反映RGC的丢失情况,是评估视网膜结构改变最有意义的指标。光谱域光学相干层析成像技术(SDOCT)可以准确测量黄斑区GCC的变化,有助于ON的临床诊断及疾病特点的动态观察[14]。在视神经损害方面,GCC变薄比pRNFL变薄更为敏感[15]。整个视网膜中黄斑区GCC最厚,是视觉通路中反映神经变性的较为敏感的生物学标志[5]。既往研究发现托珠单抗可减少患者的复发;硫唑嘌呤能在体内抑制DNA、RNA及蛋白质的合成,从而抑制淋巴细胞的增殖,发挥免疫抑制作用。但是这两种药物是否可延缓或逆转这种缓慢的变性萎缩过程尚不清楚[9]
本研究显示,在大于1年的随访时间里,应用托珠单抗或硫唑嘌呤的患者均出现视神经炎后OCT平均GCC厚度变薄,黄斑区RGCs严重丢失,说明即使使用这2种免疫抑制剂治疗,视网膜仍存在持续性缓慢变性,这与国外报道基本一致[4]。提示托珠单抗和硫唑嘌呤均不能逆转GCC丢失,且托珠单抗和硫唑嘌呤组患者间差异无统计学意义,相比于硫唑嘌呤,托珠单抗并不能延缓视神经节细胞的丢失。
pRNFL厚度与视力密切相关。尤其是当pRNFL小于50μm时,患者的视力非常差,基本不能恢复。NMOSD视神经炎常影响整个视乳头pRNFL,pRNFL厚度减少是NMOSD-ON发生后较早出现的变化,尤其是前3个月变化较为明显,常降至55~83 μm[16],NMOSD-ON引起pRNFL变薄的程度较多发性硬化(MS)-ON更为严重[17-18];而预防NMOSD复发的药物对pRNFL是否有一定的影响尚不清楚。本研究纳入NMOSD-ON受累眼的基线pRNFL与国外报道一致[19-20]。2组患者在随访过程中,受累眼LogMAR视力、低对比度视力前后均未发生显著的变化;而通过1年的随访,发现托珠单抗组和硫唑嘌呤组的患者pRNFL厚度均较基线减少,但2组患者变薄的程度类似,说明NMOSD-ON后视网膜萎缩仍在缓慢发生。两种药物均不能逆转这样的变化。VEP P100波幅、潜伏期可敏感地反映视神经轴索损伤的程度。本研究结果显示硫唑嘌呤组患者VEP P100潜伏期延长,而托珠单抗组患者VEP P100潜伏期前后无明显的变化。2组患者VEP P00波幅均较基线下降,但与硫唑嘌呤相比,托珠单抗组患者受累眼的VEP P100波幅降低的幅度明显低于硫唑嘌呤组患者。这说明托珠单抗有助于延缓视神经轴索的变性萎缩程度。
综上,托珠单抗或硫唑嘌呤均不能促进NMOSD-ON后视力的恢复,但与硫唑嘌呤相比,托珠单抗能显著延缓视神经的变性萎缩。目前尚无可逆转视神经损害的药物,因此选用高效的预防复发的治疗方案很关键。由于本研究纳入样本量较小,故需要更大样本的临床研究加以验证。

Fig.1 OCT image showing changes in the ganglion cell complex(GCC)图1 OCT图显示GCC厚度地形图的变化
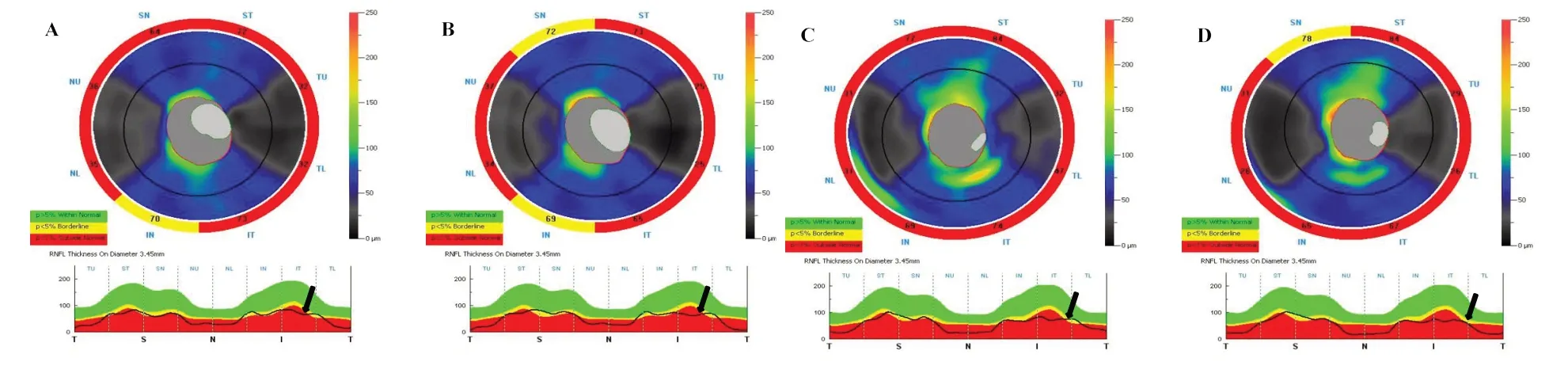
Fig.2 OCT image showing changes in the retinal nerve fiber layer(pRNFL)图2 OCT图显示视网膜视乳头pRNFL变化

