基于TCGA数据库的肾嫌色细胞癌生物信息学分析
瞿根义,王佳威,徐 勇,阳 光,聂海波,黄文琳,汤 乘
(中南大学湘雅医学院附属株洲医院泌尿外科,湖南株洲 412007)
肾细胞癌(renal cell carcinoma,RCC)是一种异源性疾病,由透明细胞肾细胞癌(clear cell renal cell carcinoma,ccRCC)和非透明细胞肾细胞癌(non-clear cell renal cell carcinoma,nccRCC)组成[1]。嫌色细胞癌(chromophobe renal cell carcinoma,chRCC),则是nccRCC第二常见的亚型,约占肾细胞癌亚型的4%~5%[2],发病年龄多为50~60岁,男女发病率无明显差异[3]。虽然有研究表明具有局部chRCC和ccRCC的患者在5年生存率方面无显著性差异(P=0.98)[4],但是大部分chRCC的患者预后比其他类型的RCC患者好,通常采取手术切除治疗即可达到满意的效果。然而对于部分进展期、预后差的患者,往往需要免疫治疗和分子靶向治疗等辅助治疗。目前,治疗chRCC的靶向药物疗效不是十分明确,药物依旧处在临床试验阶段,需要长时间的观测[5]。因此进一步研究chRCC发病的相关基因,将有助于了解chRCC的发病机制和疾病进展,并对寻找更加安全有效的治疗措施有着举足轻重的作用。
TCGA数据库作为当前世界上最大的肿瘤基因表达谱数据库,具有大样本和丰富临床数据的优势。生物信息学则是将分子生物学和电子计算机相结合的技术,可以为基因的研究提供明确的方向,帮助揭示大量生物信息中所含的奥秘。本研究采用生物信息学技术对肾嫌色细胞癌的发病相关基因芯片数据进行整合和分析,筛选出差异基因,并进行基因富集(gene ontology,GO)分析和KEGG通路富集分析,制作PPI互作网络,以求寻找肾嫌色细胞癌发病及发展的关键基因,最终对挖掘到的关键基因进行生存分析,为进一步研究肾嫌色细胞癌的研究机制奠定生物基础。
1 材料与方法
1.1 材料在TCGA Datasets(http://www.ncbi.nlm.nih.gov/geo)数据库中以“chromophobe renal cell carcinoma”为关键词进行检索,并下载公开的关于肾嫌色细胞癌的基因组数据,下载的基因组数据格式为FPKM。通过下载的基因组数据获取临床样本量共89例,其中肾嫌色细胞癌样本65例,正常组织24例。
1.2 方法
1.2.1获取差异基因 应用R软件中的edgeR算法对肾嫌色细胞癌的数据集进行标准化处理和差异表达分析,根据差异倍数(log2)绝对值>2.5和FDR调整后P<0.05作为标准,发现差异表达基因1 850个,其中表达上调基因760个,表达下调基因1 090个。并利用ggplot2软件包对数据进行图形可视化。
1.2.2差异表达基因的GO富集分析和KEGG富集分析 通过DAVID数据库(DAVID;https://david.ncifcrf.gov)对筛选的显著差异基因进行GO富集分析和KEGG通路富集分析,P<0.05为统计学具有显著差异,应用R软件及相应的clusterProfiler包进行注释及可视化。
1.2.3Hub基因的筛选 STRING数据库(https://string-db.org/)用于识别己知和预测蛋白与蛋白之间的相互作用[6-7]。使用STRING对差异表达基因进行分析并构建蛋白互作(protein protein interaction,PPI)网络,采用Cytoscape软件中的Cytohubba插件从STRING构建的PPI网络中筛选获取前10位Hub基因。
1.2.4对关键基因进行生存分析 利用R软件对筛选获取的关键基因进行生存分析,并构建Kaplan-Meier生存曲线,从而判断关键基因与肾嫌色细胞癌预后关系。使用Log-rank检验评估关键基因的表达水平与肾嫌色细胞癌患者总生存率之间的生存差异,以P<0.05为具有统计学意义。
2 结 果
2.1 肾嫌色细胞癌差异表达基因筛选该研究从TCGA数据库中下载、整理及分析了89例肾嫌色细胞癌患者的数据,其中包含65个肾嫌色细胞癌样本和24个正常样本,利用R语言软件进行差异表达基因筛选,以P<0.05且差异倍数2.5倍为显著差异获取差异表达基因。共筛选出肾嫌色细胞癌差异表达基因1 850个,其中表达上调基因760个,表达下调基因1 090个,并绘制火山图(图1)和差异最显著的前50个基因热图(图2)。
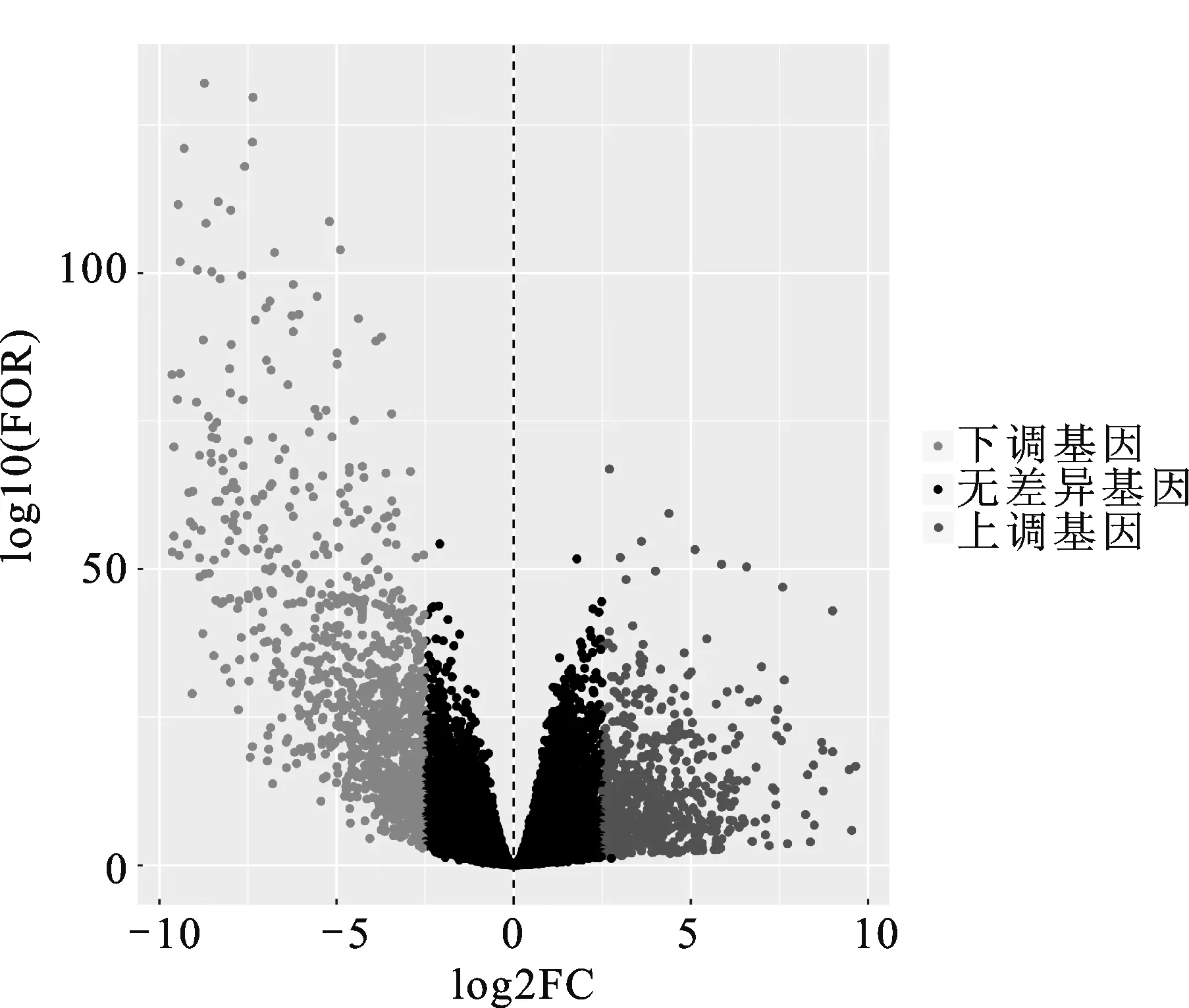
红点:基于logFC>2.5且P<0.05筛选的下调基因;绿点:基于logFC<-2.5且P<0.05筛选的下调基因;黑点:没有显著差异的基因;FOR:差异倍数。
2.2 差异表达基因的GO富集分析和KEGG通路富集分析结果通过GO富集分析和KEGG通路富集分析筛选的差异表达基因的生物学功能,在GO富集分析中包括生物学过程(biological process,BP)、细胞组成(cell composition,CC)和分子功能(molecular function,MF),在BP中差异基因主要富集于跨膜转运、化学突触传递、膜电位调节和消化排泄,在CC中差异基因主要富集于质膜的组成部分、质膜、顶质膜和细胞外区域,在MF中差异基因主要富集于激素活性、氧化还原酶活性和钙离子结合,在KEGG通路分析中主要富集于神经活性配体-受体相互作用、视黄醇代谢、类固醇激素的合成。主要富集结果见表1、表2和图3。

图2 肾嫌色细胞癌及癌旁正常组织差异表达最显著的前50个基因热图
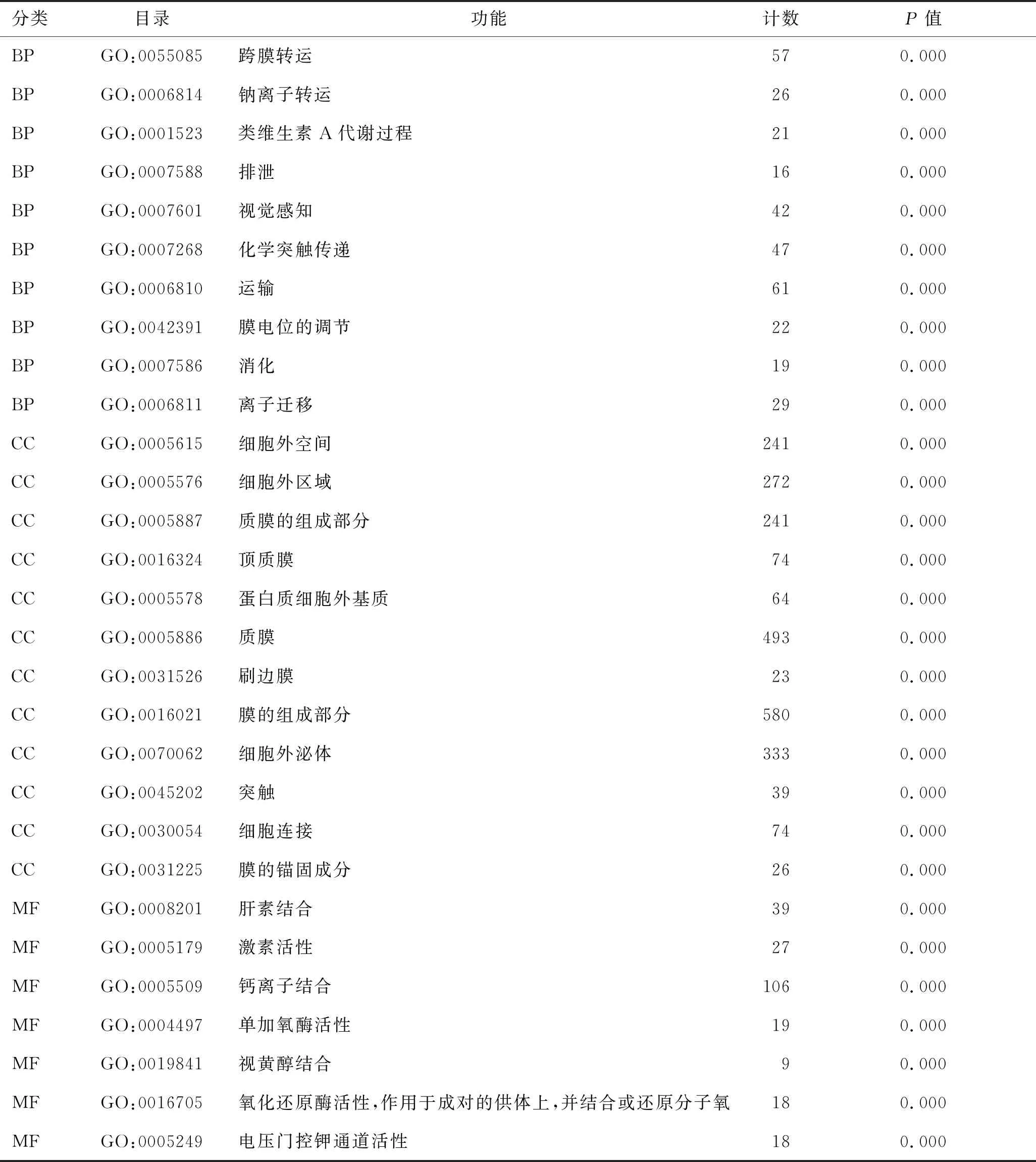
表1 肾嫌色细胞癌差异表达基因GO富集分析结果

表2 肾嫌色细胞癌差异表达基因KEGG通路富集分析结果

A:差异基因GO富集可视化;B:差异基因KEGG通路富集可视化。
2.3 差异表达基因的PPI网络分析结果通过STRING数据库对肾母细胞瘤发病的差异表达基因构建PPI网络,利用Cytoscape软件中Cytohubba筛选PPI网络中的连接程度前10位Hub基因(图4),分别是:KNG1、AGT、CASR、SST、AGTR2、PMCH、GNG4、DRD2、MCHR2、SSTR3。
2.4 关键基因的生存分析对排名前10位的Hub基因进行生存分析,构建出Kaplan-Meier生存曲线,发现只有MCHR2的表达对肾嫌色细胞癌患者的总生存率(overall survival,OS)影响差异有统计学意义(P<0.05),其余基因的表达水平都与肾嫌色细胞癌无显著相关性。
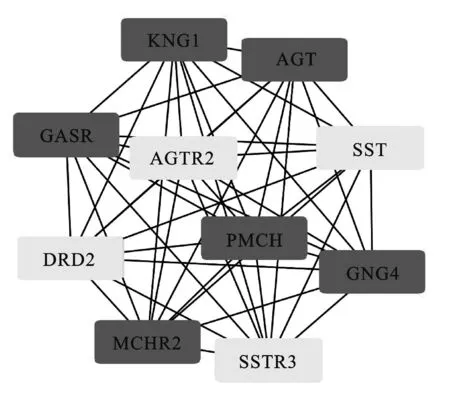
图4 PPI网络筛选的10 Hub基因
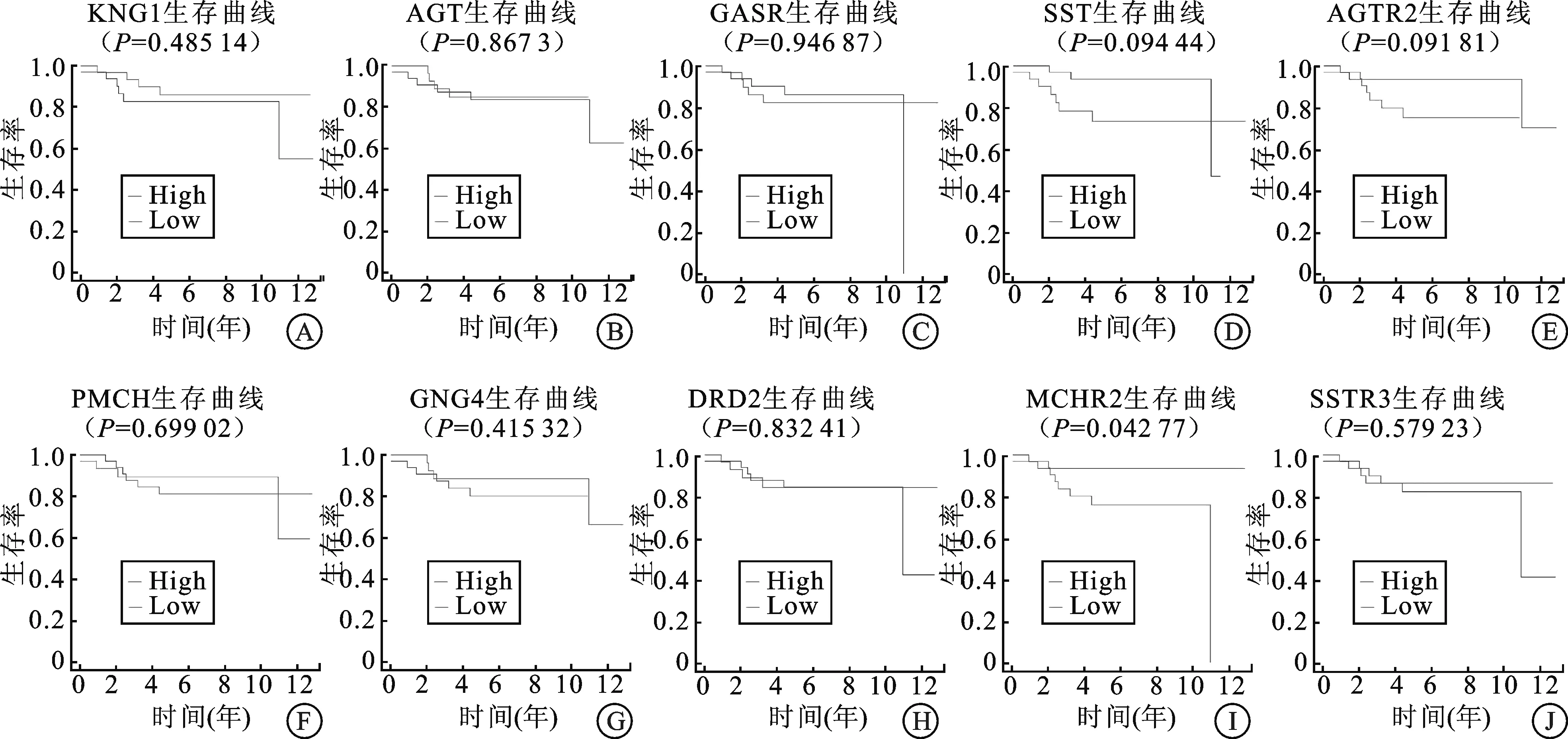
A:KNG1;B:AGT;C:CASR;D:SST;E:AGTR2;F:PMCH;G:GNG4;H:DRD2;I:MCHR2;J:SSTR3。
3 讨 论
肾嫌色细胞癌是起源于肾小管集合上皮细胞的恶性肿瘤,虽然临床上不常见,但是在nccRCC中,其发病率仅次于乳头状腺癌[8]。虽然chRCC少见且为低度恶性潜能的肿瘤,但是仍有部分预后差、进展期的患者需要辅助治疗。因此将chRCC各个时期与环节中共同表达的相关基因进行深入研究,挖掘出疾病发生与发展中起关键调控作用的基因,对了解疾病的机制、改进疾病的治疗措施以及相应靶向药物的研发十分重要。
本研究致力于筛选并分析与肾嫌色细胞癌发病及进展相关的关键基因,通过对TCGA数据库检索筛选共挖掘出肾嫌色细胞癌差异表达基因1 850个,其中包括了表达上调基因760个和表达下调基因1 090个。通过GO富集分析和KEGG富集分析来筛选与分析差异表达基因,最终得到各个差异表达基因的生物学功能。在BP中差异基因主要富集于细胞跨膜转运、化学突触传递、膜电位调节等。在CC中差异基因富集于细胞外区域、质膜。在MF中差异基因主要富集于氧化还原酶活性、钙离子结合、K离子通道等。在KEGG通路分析中主要富集于神经活性配体-受体相互作用、视黄醇代谢、类固醇激素的合成。随后进一步通过STRING数据库对肾嫌色细胞癌差异表达基因构建PPI网络,结果发现这些基因编码的蛋白调节点主要集中在KNG1、AGT、CASR、SST、AGTR2、PMCH、GNG4、DRD2、MCHR2、SSTR3。
激肽原(Kininogen 1,KNG1)重组蛋白参与机体各种生理活动,例如控制血管的扩张、维持水电解质的平衡以及调控细胞的凋亡等[9]。如今越来越多的证据表明KNG1似乎具有抗血管生成的功能,并能阻断内皮细胞的增殖,在癌症的发生起到一定的作用[10]。此外还有研究表明,在癌症患者的血清中检测到KNG1基因的低表达,因此KNG1可以作为癌症和晚期大肠腺瘤的潜在血清预测因子[11]。编码血管紧张素原的AGT则可以抑制肿瘤的进展和转移,因为有研究已证实AGT能够独立于血管紧张素Ⅱ在机体内产生非常强大的抗血管生成作用[12],实验中AGT的过度表达能明显降低肿瘤内新生血管的形成,从而延缓了肿瘤的发展[13],这代表了AGT有望成为抑制肿瘤生长和转移的新的研究方向。CASR基因在人体肾脏组织中广泛表达,对维持人体健康组织的钙稳态起着至关重要的作用[14]。最近一项研究证明,在肾部分切除术后5年内发生骨转移的细胞标本中,CASR的表达最高[15]。研究也指出CASR的过度表达可能诱导RCC癌细胞的增殖潜能以及癌细胞的钙依赖性粘附,从而增加骨转移的概率[16]。此外,DRD2缺失也与多种肿瘤的发生有关[17],大量研究显示DRD2与结直肠癌、非小细胞癌和胃癌的发病皆有关联。这是因为DRD2具有遗传多态性,这种多态性与细胞mRNA的稳定性和蛋白质翻译的改变有关[18],DRD2密度的降低会减少对细胞生长的抑制及改变细胞内凋亡信号,从而导致细胞的癌变,增加患癌症的风险。MCHR2是黑色素浓缩激素(Modifier of chinchilla,MCH)的受体之一,该基因位于人类第6号染色体长臂上[19]。本研究发现MCHR2是唯一与肾嫌色细胞癌患者的OS有显著相关性的关键基因。研究发现MCHR2和肥胖症密切相关,MCHR2受到MCH的激活后调节下丘脑的能量稳态调节器,从而控制机体的饮食行为和能量消耗[20],特别是非典型抑郁症患者MCHR2基因的变异是其BMI升高的危险因素之一[21]。在肿瘤中尚无MCHR2基因的研究,本研究显示MCHR2与肾嫌色细胞癌预后显著相关,因此MCHR2可作为肾嫌色细胞癌研究的新方向。
本研究从TCGA数据库中筛选出了与chRCC疾病发生与发展相关的基因,并挖掘及讨论与肾嫌色细胞癌相关的关键基因。MCHR2有可能成为肾嫌色细胞癌潜在的治疗靶点及预后标志物。但是,由于与肾嫌色细胞癌相关的基因层面的研究仍缺乏,因此还需要大量的研究来阐明这些基因在肾嫌色细胞癌的发病机制中的生物学功能,并为肾嫌色细胞癌的治疗提供新的线索和方向。