N-乙酰半胱氨酸在血液系统疾病治疗中的研究进展
彭秋雨 高举 陈敏

摘 要 目的:探讨N-乙酰半胱氨酸(NAC)在血液系统疾病治疗中的研究进展,为其临床应用提供参考。方法:以“N-acetylcysteine”“NAC”“Sinusoidal obstruction syndrome”“Veno-occlusive disease”“Thrombotic thrombocytopenic purpura”“Thrombotic microangiopathy”“Hematological disease”“乙酰半胱氨酸”“肝静脉窦阻塞综合征”“肝小静脉闭塞病”“血栓性血小板减少性紫癜”“血栓性微血管病”等为关键词,在中国知网、万方数据、维普、PubMed等数据库中组合查詢从建库至2020年4月发表的相关文献,对NAC在血液系统疾病治疗中的研究进行总结。结果与结论:NAC在血液系统疾病治疗中主要通过清除体内氧自由基、降低机体氧化应激反应、裂解血管性血友病因子(vWF)二硫键,以及抑制炎性介质的产生来发挥作用。已有研究显示,NAC用于治疗化疗/移植后肝静脉窦阻塞综合征(SOS),不能显著降低SOS的发生率;用于治疗血栓性血小板减少性紫癜(TTP)的文献多为观察性研究,治疗效果尚存在争议;用于治疗输血依赖性铁过载,可降低患儿的氧化应激反应、减少DNA损伤、提高输血前血红蛋白水平;用于治疗糖皮质激素抵抗型免疫性血小板减少症(ITP),虽患者血小板数量明显升高,但尚不能证明疗效和NAC直接相关;用于治疗血液系统恶性肿瘤化疗药物的不良反应,有助于改善化疗相关性肝损伤、降低重度口腔黏膜炎的发生率。NAC在一些血液系统疾病的治疗中显示出一定的治疗前景,但仍需更多的前瞻性或大样本的临床研究以验证其疗效。
关键词 乙酰半胱氨酸;血液系统疾病;疗效
从20世纪60年代起,N-乙酰半胱氨酸(N-acetylcysteine,NAC)作为一种黏蛋白裂解剂开始用于祛痰治疗[1]。近年来研究发现,NAC作为L-半胱氨酸的乙酰化产物,除了祛痰,还具有抗氧化、抑制炎性介质释放、降低病原微生物致病性、减少胶原蛋白分解、扩血管等多种作用,可广泛用于治疗呼吸系统、血液系统、心血管系统、神经系统以及对乙酰氨基酚中毒的解救等[2-5]。在血液系统疾病治疗领域,NAC用于化疗/移植相关肝静脉窦阻塞综合征(Sinusoidal obstruction syndrome,SOS)、血栓性血小板减少性紫癜(Thrombotic thrombocytopenic purpura,TTP)等疾病的治疗效果越来越受到临床关注,国内外文献可见个案报道或临床研究,但其系统综述尚未见报道。为进一步探讨NAC在血液系统疾病中的临床应用,笔者以“N-acetylcysteine”“NAC”“Sinusoidal obstruction syndrome”“Veno-occlusive disease”“Thrombotic thrombocytopenic purpura”“Thrombotic microangiopathy”“Hematological disease”“乙酰半胱氨酸”“肝静脉窦阻塞综合征”“肝小静脉闭塞病”“血栓性血小板减少性紫癜”“血栓性微血管病”等为关键词,在中国知网、万方数据、维普、PubMed等数据库中组合查询从建库至2020年4月发表的相关文献,现就NAC在血液系统疾病治疗中的研究进展作一综述,旨在为其临床应用提供参考。
1 NAC的作用机制及用法用量
1.1 作用机制
NAC为天然存在的氨基酸L-半胱氨酸乙酰化的衍生物,是细胞内还原型谷胱甘肽(GSH)的前体,具有多种药理作用,除最主要的抗氧化应激作用外,还具有抗炎、扩血管、调节机体免疫状态和细胞凋亡程序的作用[6-11]。NAC抗氧化应激作用涉及3种机制:(1)直接抗氧化效应——NAC为稳定性较好的含巯基分子,巯基可与羟自由基、过氧化氢及次氯酸相互作用从而清除氧自由基,可与GSH过氧化酶结合从而减少脂质过氧化物的生成;(2)间接抗氧化效应——NAC作为L-半胱氨酸前体分子,具有良好的细胞膜通透性,进入细胞后可被水解为L-半胱氨酸,提高了细胞内L-半胱氨酸和GSH水平,从而保护细胞免受细胞毒素损害;(3)二硫键断裂效应——NAC比GSH和半胱氨酸具有更强的硫原子亲核性,对二硫化物的还原性更强,可恢复巯基分子水平和调控氧化还原状态[6]。NAC的抗炎作用可能与其抑制核因子-κB(NF-κB)的活性有关,其可通过抑制细胞因子如肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、IL-1β的释放来发挥抗炎活性[7]。NAC的扩血管活性作用与其调节一氧化氮(NO)的生成有关,其可通过促进收缩的微循环血管扩张,改善血液对组织的氧输送,从而减轻组织缺氧损伤[8]。此外,NAC还具有调节免疫、调节凋亡、防止核酸分子损伤的作用[9-11]。近年来,NAC的临床应用领域不断拓宽至各系统疾病如肝病、造影剂肾损伤、急性胰腺炎、高血压、左心室肥厚及动脉粥样硬化等[12]。与此同时,NAC通过其抗氧化、抑制炎症反应等作用而在血液系统疾病治疗中的应用也逐渐受到临床关注。
1.2 用法用量
NAC具有多种剂型和规格,主要包括片剂(200 mg/600 mg)、胶囊(200 mg)、颗粒剂(100 mg/200 mg)、注射剂(4 g/8 g)、吸入剂(3 mL ∶ 300 mg)和滴眼液(5 mL ∶ 80 mg)。NAC用于祛痰治疗的剂量一般为:口服,成人每次200 mg,儿童每次100 mg,每天 2~4次;雾化,每次300 mg,每天1~2次。NAC用于对乙酰氨基酚中毒的解救剂量一般为:口服,负荷量140 mg/kg,4 h后给予维持剂量1次70 mg/kg,然后每4 h 1次,共17次;静脉滴注的总剂量为300 mg/kg[13]。NAC在治疗血液系统疾病时,剂量通常为50~300 mg/(kg·d)[13]。NAC临床应用总体安全,其口服最常见的不良反应为恶心、呕吐和腹泻,静脉为皮疹、荨麻疹和瘙痒[14]。2019年美国食品药品监督管理局(FDA)修订NAC说明书,增加了单剂量静脉使用超过150 mg/kg致死的案例说明,故临床使用大剂量NAC时应谨慎[14]。
2 NAC治疗血液系统疾病
2.1 治疗SOS
SOS也称肝小静脉闭塞病(Veno-occlusive disease,VOD),是由各种原因导致的肝血窦、肝小静脉和小叶间静脉内皮细胞水肿、坏死、脱落进而形成微血栓的一种肝脏血管性疾病,可继发引起肝内淤血、肝功能损伤和门静脉高压等疾病[15]。SOS以黄疸、腹水、腹胀、肝肿大和右上腹痛为临床特征,最常发生于造血干细胞移植(HSCT)患者,少部分发生于化疗、大剂量放疗、吡咯生物碱(如三七、千里光)摄入后的患者,重度SOS致死率超过90%[15]。因此,对SOS的预防意义远大于治疗,其治疗效果取决于疾病的严重程度。去纤苷是目前唯一被美国FDA批准用于预防和治疗HSCT后SOS的药物,但却未在我国上市[16-17]。
研究发现,SOS的发生可能和肝窦内皮细胞GSH的耗竭有关,化疗或放疗可消耗体内GSH,而且移植前预处理方案会导致血管内皮损伤和凝血因子沉积[18-19]。NAC可提高细胞内GSH的生物合成,清除氧自由基从而促进解毒,维持细胞内膜性结构的稳定,促进收缩的微循环血管扩张,有效增加血液对组织的氧输送,纠正组织缺氧,防止细胞进一步坏死,已被《肝脏炎症及其防治专家共识》推荐用于药物性肝损伤的治疗[3,20]。
但目前NAC用于SOS的治疗效果仍然存在争议,未获得英国血液学标准委员会/英国血液和骨髓移植学会(BCSH/BSBMT)指南推荐[16]。5篇回顾性病例研究报道了24例急性淋巴细胞白血病、肾母细胞瘤化疗后或HSCT后发生SOS的患者,结果显示,使用NAC 50~280 mg/(kg·d)治疗后,患者的SOS症状逐渐得到改善,血清丙氨酸转氨酶(ALT)、天冬氨酸转移酶(AST)或胆红素水平均下降,凝血时间恢复正常[5,21-24]。然而,对照性研究结果并未显示出明显差异,其中1项随机对照试验纳入了160例HSCT后肝功异常患者,治疗组使用NAC 100 mg/(kg·d)联合熊去氧胆酸,对照组单用熊去氧胆酸,结果显示,NAC组患者移植后SOS的发生率与对照组无差异,提示NAC不能显著降低肝损后SOS的发生率[25]。另一项对照研究纳入108例SOS患者,于HSCT前单用熊去氧胆酸(对照组)或NAC联合熊去氧胆酸(NAC组)预防SOS,结果显示,NAC组与对照组之间的SOS发生率无差异,但NAC组患者肝酶升高的发生率更低[26]。NAC用于治疗SOS的研究见表1。
2.2 治疗TTP
TTP是一种罕见、致死率高达90%的血栓性微血管病(TMA),由血管性血友病因子(vWF)裂解酶 ADAMTS13的活性严重下降所致[27]。其特征为小血管内出现富含血小板的血栓、血小板减少和微血管病性溶血性贫血(MAHA) [28]。
自20世纪90年代起,随着血浆置换(PEX)的应用,TTP患者的总体生存率已超过80%,但仍有约40%的患者复发或经治疗恢复后再次发病,并进展为难治性TTP[29]。
vWF的结构和黏蛋白类似,也是二硫键的聚合物。体外和动物研究发现,NAC可取代ADAMTS13,断裂超大型vWF(ULVWF)A1区域的1272-1458二硫键,从而降低ULVWF多聚体的浓度,减少微脉管系统内ULVWF多聚体的蓄积;还可抑制vWF依赖的血小板聚集,有效治疗获得性TTP[30-31]。另一项动物研究发现,预防性使用NAC可防止严重TTP的发生,但不能减轻已存在的急性TTP症状[32]。
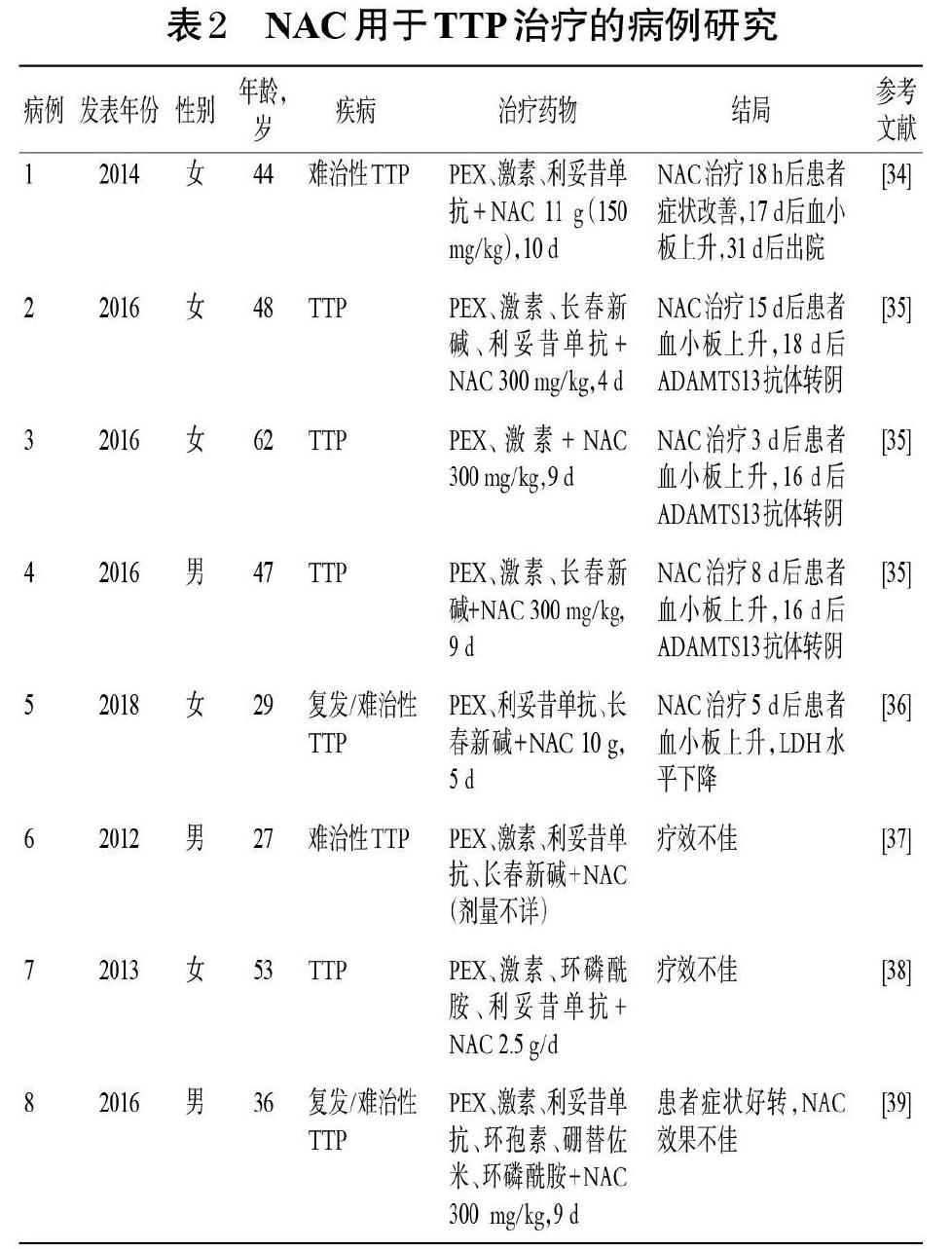
2012年前,NAC未应用于TTP或TMA的治疗,2012-2019年的6篇病例报道研究结果显示,NAC用于治疗TTP或TMA的疗效存在争议,且使用剂量远超过常规剂量[33]。NAC用于TTP的病例研究见表2。其中,3篇病例报道中的5例TTP患者使用PEX、激素、利妥昔单抗或其他免疫抑制剂(长春新碱)治疗后效果欠佳,而加用NAC治疗后患者的症状改善,血小板计数和 ADAMTS13活性恢复正常[34-36]。另3篇病例报道中的3例TTP患者使用PEX、激素、利妥昔单抗或其他免疫抑制剂(如长春新碱、环磷酰胺、环孢素)治疗后,再加用NAC治疗,其治疗效果不佳[37-39]。上述研究结果的差异可能与NAC的剂量差异有关[40]。
2.3 治疗输血依赖性铁过载
贫血导致的铁调素表达降低和长期输血易造成机体铁过载,增加的非转铁蛋白结合铁可诱导自由基的产生和活性氧(ROS)的累积,ROS能够对大分子造成氧化损伤,导致脂質过氧化、氨基酸侧链氧化和多肽链氧化,使蛋白质断裂和DNA损伤[41]。研究表明,使用祛铁药物联合抗氧化剂(如NAC)可减少细胞损伤[42- 43]。1项纳入75例地中海贫血铁过载患儿使用祛铁药物联合抗氧化剂(NAC或维生素E)的RCT结果显示,与对照组(不使用抗氧化剂)比较,NAC组[10 mg/(kg·d)]可降低患儿氧化应激反应、减少DNA损伤,提高输血前血红蛋白水平(P<0.05)[44]。另一项RCT结果显示,地中海贫血患者以10 mg/(kg·d)的剂量连续口服NAC 3个月可降低其铁过载[45]。
2.4 治疗激素抵抗型免疫性血小板减少症(ITP)
ITP又称特发性血小板减少性紫癜,是血液系统最常见的出血性疾病[46-47]。其一线治疗方案为糖皮质激素和大剂量丙种球蛋白,但约30%的患者可出现糖皮质激素抵抗,继而发展为慢性或难治性ITP。体外研究发现,内皮祖细胞(EPCs)在骨髓造血微环境中发挥着重要作用,EPCs数量减少、功能失调及高水平ROS表达在糖皮质激素抵抗ITP患者的发病机制中起着重要作用[48]。NAC作为抗氧化剂,可阻止ROS聚集、调节EPCs功能[49]。1项纳入21例糖皮质激素耐药或抵抗ITP患者的回顾性研究发现,阿托伐他汀联合NAC在糖皮质激素抵抗ITP患者的治疗过程中效果显著,可使血小板数量显著升高,但因缺乏单因素分析证据,但其疗效尚不能证明和NAC直接相关[50]。
2.5 治療化疗药物的不良反应
化疗是血液系统恶性肿瘤的主要治疗手段,其不良反应常导致化疗延迟或终止,影响患者预后。化疗药物(如环磷酰胺、甲氨蝶呤、巯嘌呤、阿糖胞苷)和分子靶向药物(如伊马替尼、利妥昔单抗)等易导致化疗相关性肝损伤(CILI)[51]。Eroglu N等[52]开展的1项回顾性研究发现,在包括急性淋巴细胞白血病(ALL)、非霍奇金淋巴瘤(NHL)内的102例CILI儿童中,化疗后使用NAC和不使用NAC相比,患儿体内ALT和γ-谷氨酰胺转移酶(GGT)水平下降更快 (P<0.05)。1项纳入80例白血病患者使用NAC或安慰剂的RCT结果显示,与对照组(不使用抗氧化剂)比较,NAC可降低患者重度口腔黏膜炎的发生率、缩短口腔黏膜炎的病程[53]。此外,体外研究和动物研究结果显示,NAC对甲氨蝶呤导致的皮肤损害和化疗药物导致的骨髓抑制具有一定的改善作用[54-55]。
3 结语
NAC在血液系统疾病的治疗中主要通过清除体内氧自由基、降低机体氧化应激反应、断裂vWF二硫键以及抑制炎性介质的产生等发挥作用。已有研究显示,NAC用于治疗化疗/移植后SOS,并不能显著降低SOS的发生率;用于治疗TTP的文献多为观察性研究,治疗效果尚存在争议;用于治疗输血依赖性铁过载,可降低患儿的氧化应激反应、减少DNA损伤、提高输血前血红蛋白水平;用于治疗糖皮质激素抵抗型ITP,虽然患者血小板数量明显升高,但尚不能证明疗效和NAC直接相关;用于治疗血液系统恶性肿瘤化疗药物的不良反应,有助于改善化疗相关性肝损伤、降低重度口腔黏膜炎的发生率。
本研究主要通过现有的临床指南及临床研究对NAC治疗血液系统疾病的进展进行了综述,但因受到相关临床研究不足和(或)证据质量不高的限制,故所得结论存在一定的局限。目前,NAC在一些血液系统疾病的治疗中显示出一定的治疗前景,但仍需更多的前瞻性或大样本的临床研究以验证其疗效。
参考文献
[ 1 ] 慢性阻塞性肺疾病诊治专家组.祛痰/抗氧化药治疗慢性阻塞性肺疾病中国专家共识[J].国际呼吸杂志,2015,35(16):1201-1209.
[ 2 ] SHAHRIPOUR RB,HARRIGAN MR,ALEXANDROV AV,et al. N-acetylcysteine (NAC) in neurological disorders:mechanisms of action and therapeutic opportunities[J]. Brain Behav,2014,4(2):108-122.
[ 3 ] 王宇明,于乐成.肝脏炎症及其防治专家共识[J].中国实用内科杂志,2014,34(2):152-162.
[ 4 ] DINICOLA S,GRAZIA SD,CARLOMAGNO G,et al.N- acetylcysteine as powerful molecule to destroy bacterial biofilms: a systematic review[J]. Eur Rev Med Pharmacol Sci,2014,18(19):2942-2948.
[ 5 ] LEE AC,AUNG L. Treatment of hepatic veno-occlusive disease in children with N-acetylcysteine[J]. Pediatr Blood Cancer,2019. DOI:10.1002/pbc.27518.
[ 6 ] SADOWSKA AM,OVERVELD FJ,G?RECKA D,et al.The interrelationship between markers of inflammation and oxidative stress in chronic obstructive pulmonary di- sease:modulation by inhaled steroids and antioxidant[J].Respir Med,2005,99(2):241-249.
[ 7 ] DHOUIB IE,JALLOULI M,ANNABI A,et al. A minireview on N-acetylcysteine:an old drug with new approaches[J]. Life Sciences,2016. DOI:10.1016/j.lfs.2016.03.003.
[ 8 ] CAGLIKULEKCI M,PATA C,APA DD,et al. The effect of N-acetylcysteine (NAC) on liver and renal tissue inducible nitric oxide synthase (iNOS) and tissue lipid peroxidation in obstructive jaundice stimulated by lipopolysaccharide (LPS)[J]. Pharmacol Res,2004,49(3):227- 238.
[ 9 ] SUDHEER AR,MUTHUKUMARAN S,DEVIPRIYA N,et al. Ellagic acid,a natural polyphenol protects rat peri- pheral blood lymphocytes against nicotine-induced cellular and DNA damage in vitro:with the comparison of N-acetylcysteine[J]. Toxicology,2007,230(1):11-21.
[10] 張静,吴瑜,徐敬根,等. N-乙酰-L-半胱氨酸对H2O2引起的血管内皮细胞损伤的拮抗效应[J].中国呼吸与危重监护杂志,2003,2(2):91-94.
[11] DE FLORA S,IZZOTTI A,DAGOSTINI F,et al. Mechanisms of N-acetylcysteine in the prevention of DNA da- mage and cancer,with special reference to smoking-related end-points[J]. Carcinogenesis,2001,22(7):999-1013.
[12] 王振花,李潮生,李晓丽,等.乙酰半胱氨酸在各系统疾病防治中的研究进展[J].医学综述,2019,25(11):2138- 2142.
[13] CHIEW AL,REITH D,POMERLEAU A,et al. Updated guidelines for the management of paracetamol poisoning in Australia and New Zealand[J]. Med J Aust,2020,212(4):175-183.
[14] Food and Drug Administration. Highlights of prescribing information (ACETADOTE)[EB/OL].(2020-01-13)[2020-08-13].http://www.accessdata.fda.gov/drugsatf-da_docs/label/2019/021539s017lbl.pdf.
[15] 张玮,诸葛宇征. 《吡咯生物碱相关肝窦阻塞综合征诊断和治疗专家共识意见(2017年,南京)》解读[J].医学新知,2019,29(1):17-20.
[16] DIGNAN FL,WYNN RF,HADZIC N,et al. BCSH/ BSBMT guideline:diagnosis and management of veno- occlusive disease (sinusoidal obstruction syndrome) following haematopoietic stem cell transplantation[J]. Br J Haematol,2013,163(4):444-457.
[17] MOHTY M,MALARD F,ABECASSIS M,et al.Sinusoidal obstruction syndrome/veno-occlusive disease:current situation and perspectives:a position statement from the European Society for Blood and Marrow Transplantation (EBMT)[J]. Bone Marrow Transplant,2015,50(6):781- 789.
[18] SHULMAN HM,HINTERBERGER W. Hepatic veno-occlusive disease:liver toxicity syndrome after bone marrow transplantation[J]. Bone Marrow Transplant,1992,10(3):197-214.
[19] ALLEN JR,CARSTENS LA,KATAGIRI GJ. Hepatic veins of monkeys with veno-occlusive disease. Sequential ultrastructural changes[J]. Arch Pathol,1969,87(3):279- 289.
[20] BAUMGARDNER JN,KARTIK S,LEAH H,et al. N-acetylcysteine attenuates progression of liver pathology in a rat model of nonalcoholic steatohepatitis[J]. J Nutr,2008,138(10):1872-1879.
[21] RINGD?N O,REMBERGER M,LEHMANN S,et al. N- acetylcysteine for hepatic veno-occlusive disease after allogeneic stem cell transplantation[J]. Bone Marrow Transplant,2000,25(9):993-996.
[22] SJ?? F,ASCHAN J,BARKHOLT L,et al.N-acetyl-L- cysteine does not affect the pharmacokinetics or myelosuppressive effect of busulfan during conditioning prior to allogeneic stem cell transplantation[J]. Bone Marrow Transplant,2003,32(4):349-354.
[23] LEE AC,GOH PY. Dactinomycin-induced hepatic sinusoidal obstruction syndrome responding to treatment with N-acetylcysteine[J]. J Cancer,2011,2(1):527-531.
[24] SAHOO RK,SHARMA A. Sinusoidal obstruction syndrome during induction therapy for acute lymphoblastic leukemia managed with N-acetylcysteine[J]. Pediatric Blood Cancer,2011. DOI:10.1002/pbc.23142.
[25] BARKHOLT L,REMBERGER M,HASSAN Z,et al. A prospective randomized study using N-acetyl-L-cysteine for early liver toxicity after allogeneic hematopoietic stem cell transplantation[J]. Bone Marrow Transplant,2008,41(9):785-790.
[26] EL-SERAFI I,REMBERGER M,EL-SERAFI A,et al.The effect of N-acetyl-L-cysteine (NAC) on liver toxicity and clinical outcome after hematopoietic stem cell transplantation[J]. Sci Rep,2018,8(1):1-10.
[27] SCULLY M,HUNT BJ,BENJAMIN S,et al. Guidelines on the diagnosis and management of thrombotic thrombocytopenic purpura and other thrombotic microangiopathies[J]. Br J Haematol,2012,158(3):323-335.
[28] BLOMBERY P,SCULLY M. Management of thrombotic thrombocytopenic purpura:current perspectives[J]. J Blood Med,2014,5:15-23.
[29] COPPO P. Management of thrombotic thrombocytopenic purpura[J]. Transfus Clin Et Biol,2017,109(3):496-507.
[30] GEORGE JN,L?PEZ JA,KONKLE BA. N-acetylcysteine:an old drug,a new insight,a potentially effective treatment for thrombotic thrombocytopenic purpura[J]. Transfusion,2014,54(5):1205-1207.
[31] CHEN J,REHEMAN A,GUSHIKEN FC,et al. N-acetylcysteine reduces the size and activity of von Willebrand factor in human plasma and mice[J]. J Clin Invest,2011,121(2):593-603.
[32] TERSTEEG C,ROODT J,VAN RENSBURG WJ,et al.N-acetylcysteine in preclinical mouse and baboon models of thrombotic thrombocytopenic purpura[J]. Blood,2016,129(8):1030-1038.
[33] SAYANI FA,ABRAMS CS. How I treat refractory thrombotic thrombocytopenic purpura[J]. Blood,2015,125(25):3860-3867.
[34] LI GW,RAMBALLY S,KAMBOJ J,et al. Treatment of refractory thrombotic thrombocytopenic purpura with N-acetylcysteine:a case report[J]. Transfusion,2014,54(5):1221-1224.
[35] ROTTENSTREICH A,HOCHBERG-KLEIN S,RUND D,et al. The role of N-acetylcysteine in the treatment of thrombotic thrombocytopenic purpura[J]. J Thromb Thrombolys,2016,41(4):678-683.
[36] DEMIRCIO?LU S,EKINCI ?,DO?AN A,et al. Relapsed/refractory thrombotic thrombocytopenic purpura treated with N-acetylcysteine:a case report[J]. Scott Med J,2018,63(4):122-124.
[37] CHAPIN J,WEKSLER B,MAGRO C,et al.Eculizumab in the treatment of refractory idiopathic thrombotic thrombocytopenic purpura[J]. Br J Haematol,2012,157(6):772-774.

