基于网络药理学预测双莲方对肝细胞癌作用的机制
陈元堃,曾 奥,何树苗,贺思晴,李春梅,卢 群
(广东药科大学 生命科学与生物制药学院,广东 广州 510002)
肝细胞癌是肝脏中最常见的原发性恶性肿瘤,是导致肝硬化患者死亡的主要原因之一,其病死率在所有的恶性肿瘤中排名第三[1]。据报道,每年约有84万人患肝细胞癌,其中约78万人死亡。发展中国家肝细胞癌的患病率极高,且呈现患病男性多于女性的趋势[2]。当前肝细胞癌主要以手术切除为主要的治疗方案,但这仅仅是早期患者的选择,肝细胞癌晚期患者错过了手术的最佳时期,只能采用化疗、介入等手段进行治疗,且预后也并不乐观[3]。近年来,科研人员对肿瘤的研究已逐步进入分子水平,在分子水平上对肝细胞癌的发生及发展进行了深入的研究,为肝细胞癌的诊断、治疗和预防提供了新的思路。目前肝细胞癌的多种治疗手段仍有缺陷及局限性,故综合治疗开始受到更多临床医生的重视。
在肝细胞癌的治疗中,中药治疗具有独特的优势和疗效,是中西医结合治疗中极其重要的一部分[4,5]。双莲方是由半枝莲、半边莲及夏枯草三味中药组合而成的新方剂,在临床上广泛运用于肝细胞癌的治疗[6]。据报道,组成双莲方的三味中药对肿瘤细胞均有抑制作用[7,8]。在过去的几年里,生物信息学和微阵列技术被广泛应用于挖掘多种疾病的多种靶点,帮助研究者识别差异表达的基因和可能的信号通路。目前,对于双莲方中具体有效成分治疗肝细胞癌的潜在作用机制未见系统性报道,故本研究结合网络药理学及生物信息学分析双莲方中的主要活性成分,预测其作用靶点,探索双莲方治疗肝细胞癌的分子机制,为传统中医药治疗肝细胞癌提供理论依据。
1 材料与方法
1.1 获取微阵列数据
本研究以“hepatocellular carcinoma”为关键词,从GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/)中搜索得到GSE121248数据集,数据集共有107个样本(包括37个邻近组织的正常样本和70个肝细胞癌样本)。根据网站中的平台注释文件,将其探针转化为相对应的基因符号(Gene symbol)。
1.2 筛选差异表达基因
利用Bioconductor中的limma包对收集到的芯片进行差异基因分析及校正,筛选条件设定为P<0.01,差异倍数(FC)>2。若一个基因出现多行,则对其取均值。利用R语言将其中表达上调及下调的基因逐个筛选出来。
1.3 双莲方主要成分的获取及筛选
通过中药系统药理学数据库及在线分析平台TCMSP(http://tcmspw.com/tcmsp.php)收集半枝莲、半边莲、夏枯草的主要活性成分。以生物利用度(OB)≥30%、类药性(DL)≥0.18 作为筛选条件来筛选候选的活性成分。
1.4 潜在靶点的预测及筛选交集基因
利用Perl脚本筛选出候选活性成分的作用靶点,剔除没有对应活性成分的靶点。通过R脚本将前文获得的疾病差异表达基因与药物作用靶点取交集。将获得的交集部分以及中药、候选活性成分整合为“network”“node”文件,将其导入Cytoscape_v3.7.2中构建药物-活性成分-作用靶点的网络图。
1.5 蛋白互作网络的构建与分析
利用Cytoscape_v3.7.2的插件BisoGenet构建前文获得的交集靶点的蛋白互作网络(PPI网络),用插件CytoNCA分析PPI网络中节点的重点网络特征,依据网络拓扑的理念选出此网络中的重要节点。筛选条件为:度中心性(DC)大于全部DC节点中位数的2倍,介度中心性(BC)、接近中心性(CC)均大于节点对应值中位数。
1.6 KEGG和GO富集分析
将交集靶点导入DAVID数据库中,于基因列表中输入交集靶点的集合,基因标示符检选官方基因符号,背景栏选择物种为人,最后选功能富集工具进行GO、KEGG通路的富集分析,并应用Cytoscape_v3.7.2进行可视化。
2 结果与分析
2.1 肝细胞癌差异基因的挖掘
通过R语言分析肝细胞癌组织与邻近正常组织后共得到580个差异表达基因,其中有167个上调基因,有413个下调基因,用上调及下调最显著的各20个差异基因绘制聚类热图,见图1。

图1 肝细胞癌差异基因的聚类热图(红色表示上调差异基因,绿色表示下调差异基因,C表示邻近正常样本,T表示癌症样本)Figure 1 Clustering heat map of differential gene in HCC (red:up-regulated gene.blue:down-regulated gene.C:adjacent normal sample.T:tumor sample)
2.2 收集及筛选双莲方中候选化学成分
通过TCMSP数据库检索收集到94个半枝莲的化学成分、71个半边莲的化学成分和60个夏枯草的化学成分。对得到的各中药化学成分依据OB ≥30%、DL ≥0.18的条件进行筛选,并剔除没有靶点的化学成分,共得到50个有效的活性成分,其中半边莲有17个,半枝莲有29个,夏枯草有11个。其中槲皮素(quercetin)、木犀草素(luteolin)同时存在于半边莲、半枝莲、夏枯草中,山柰酚(kaempferol)存在于半边莲与夏枯草中,而β-谷甾醇(beta-sitosterol)、豆甾醇(stigmasterol)存在于半枝莲与夏枯草中,具体成分见图2。
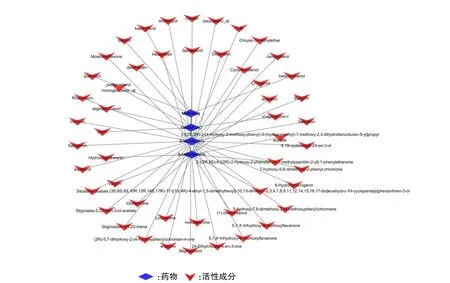
图2 双莲方药物-活性成分网络图Figure 2 Drug-active ingredient network of Shuanglianfang
2.3 收集靶点
利用TCMSP数据库收集得到半枝莲、半边莲、夏枯草中50个化学成分的对应靶点共1 385个,其中半边莲有417个,半枝莲有591个,夏枯草有377个。研究发现,存在多个药物共同拥有多个靶点、一个活性成分对应多个靶点和多个活性成分对应一个靶点的情况。将双莲方活性成分作用靶点与肝细胞癌差异基因匹配之后,共得到28个双莲方治疗肝细胞癌的潜在靶点,见表1。
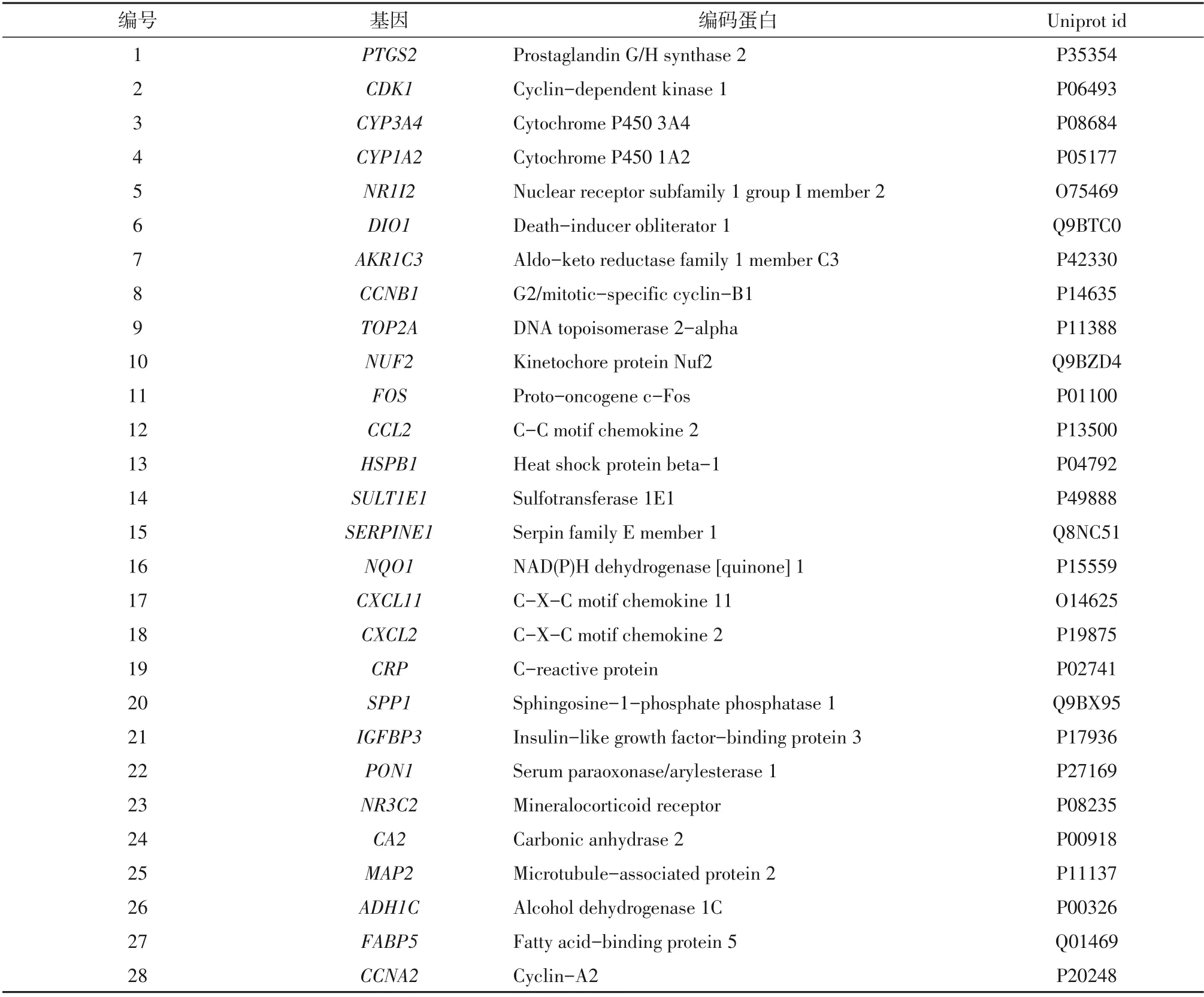
表1 双莲方治疗肝细胞癌的潜在靶点Table 1 Potential targets of Shuanglianfang in the treatment of HCC
2.4 药物-活性成分-靶点网络构建及分析
利用Cytoscape构建药物-活性成分-作用靶点网络,见图3。网络中有63个节点及83条边,节点为活性成分及靶点基因,边为它们之间的相互关系。从图3可以发现,三种药物中的活性成分对多个靶点有作用,存在一个活性成分对多个靶点起作用和多个活性成分对一个靶点有作用的情况,体现了双莲方多成分、多靶点相互协同治疗肝细胞癌的特点。
2.5 蛋白互作网络构建与分析
通过Cytoscape_v3.7.2 的插件BisoGenet 构建交集靶点调控的蛋白质之间的相互作用关系网络(数据源于DIP、BIND、HPRD、MINT、INTACT、BIOGRID 数据库),见图4。网络中共有1 439 个蛋白和27 515 条相互关系通道。以这1 439 个蛋白做进一步的CytoNCA 分析,筛选的参数包括DC、BC、CC、NC、LAC。通过网络拓扑分析筛选出14个关键节点和91个关系,筛选过程见图4(A)。将其导入STRING构建蛋白互作网络,见图4(B)。图4(C)中,检索基因调控的蛋白质为红色,有相互作用的蛋白质为蓝色。结果提示双莲方可能通过影响这些关键节点起到治疗肝细胞癌的作用。
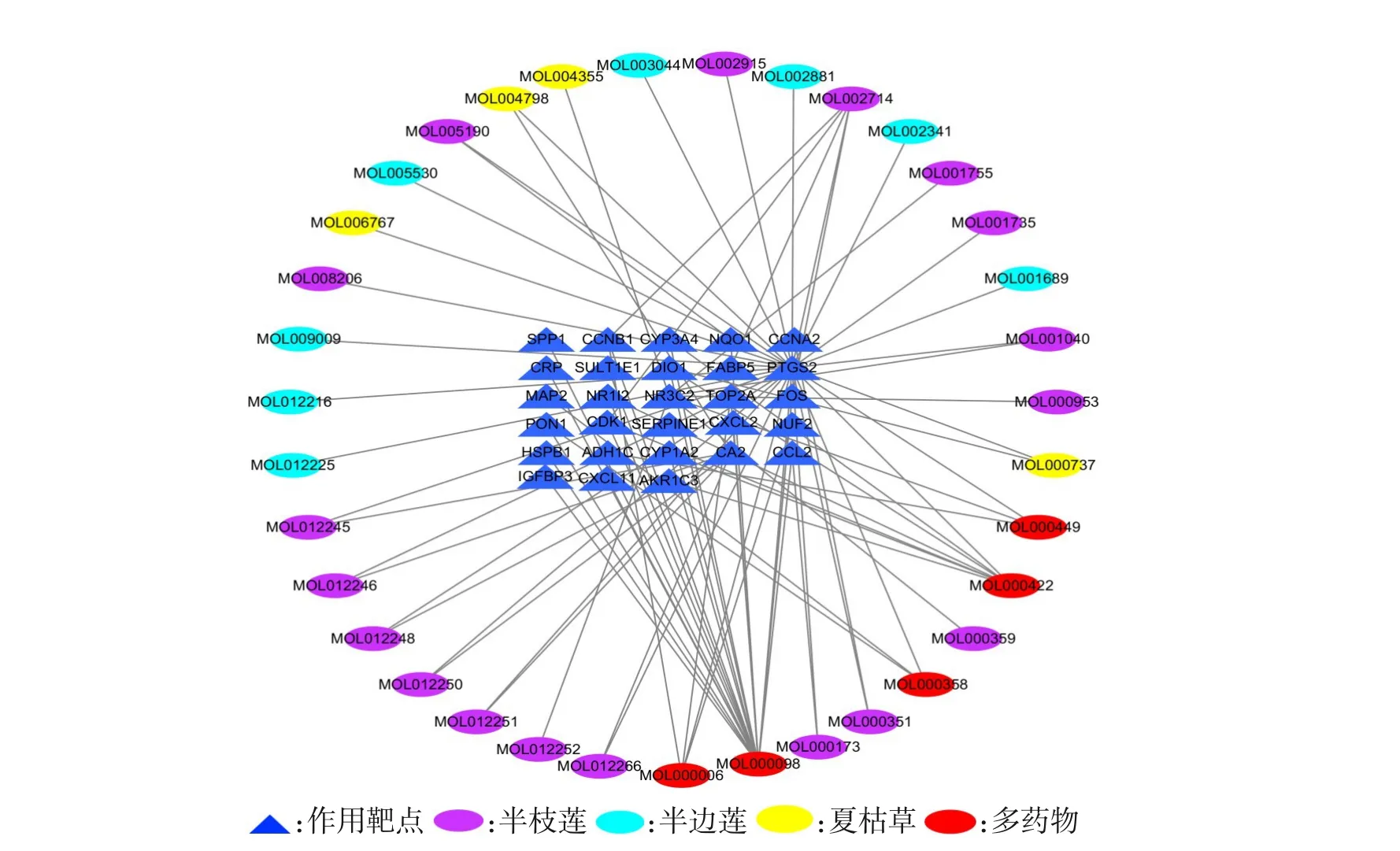
图3 双莲方药物-活性成分-靶点网络Figure 3 Drug-active ingredient-target network

图4 蛋白互作网络Figure 4 Protein interaction network

图4 蛋白互作网络(续)Figure 4 Protein interaction network(continued)
2.6 GO富集分析
通过DAVID 对交集靶点进行GO 富集分析,得到314个富集结果,其中生物过程(BP)有286个,主要涉及激素代谢过程、细胞对无机物的反应过程、类固醇分解代谢过程等方面;细胞成分(CC)有5个,主要涉及蛋白激酶复合物、丝/苏氨酸蛋白激酶复合物、细胞周期蛋白依赖性蛋白激酶全酶复合物等;分子功能(MF)有23个,主要涉及细胞因子活性、趋化因子活性、趋化因子受体结合等。CC的前五项富集结果及BP、MF的前10项富集结果见图5。
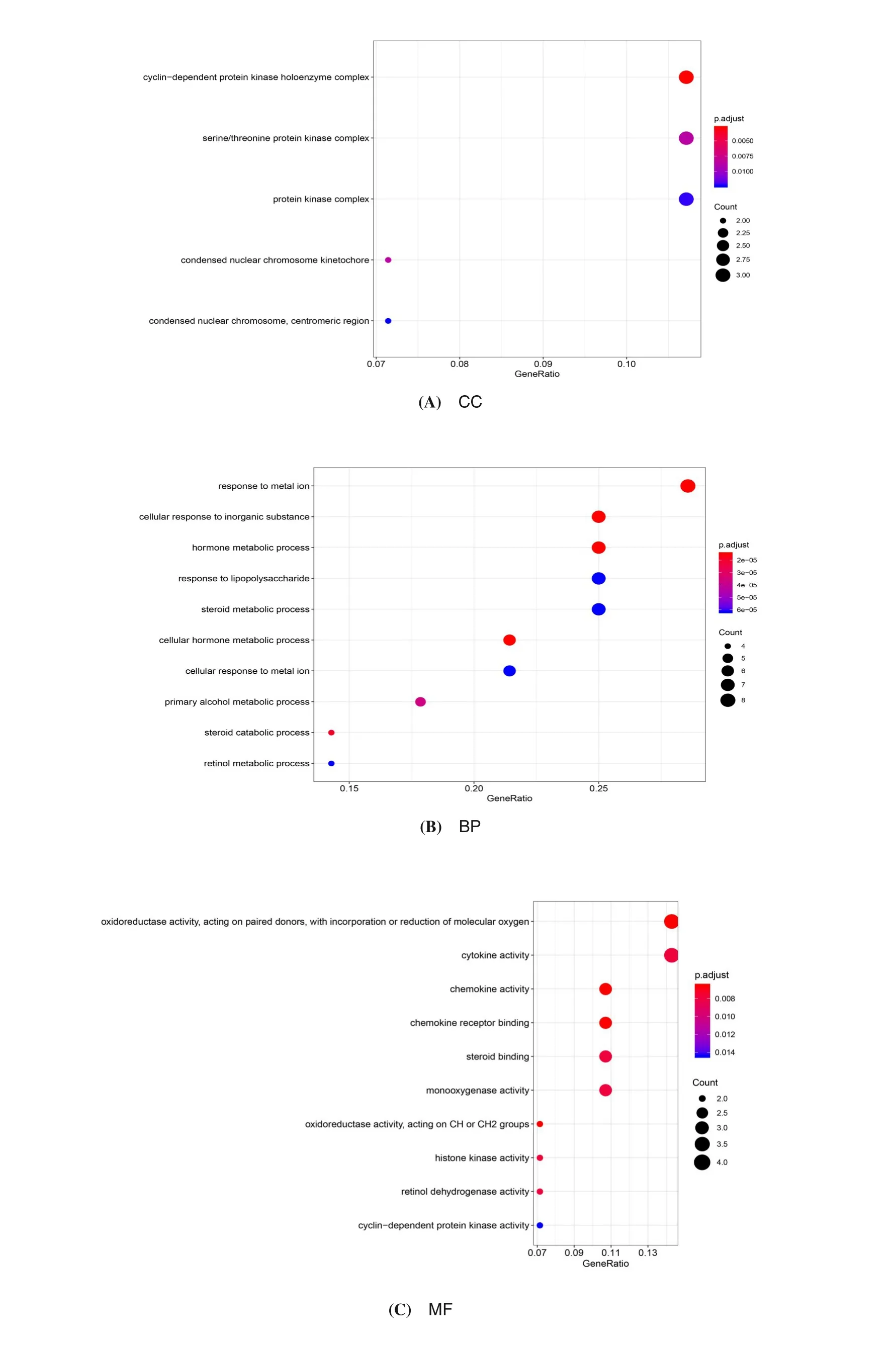
图5 GO富集结果Figure 5 GO enrichment results
2.7 KEGG富集分析
通过DAVID对交集靶点进行KEGG富集分析,得到13条富集结果,其中与肝细胞癌有关的通路主要有肿瘤坏死因子信号通路(TNF signaling pathway)、P53信号通路(p53 signaling pathway)、Toll 样受体信号通路(Toll-like receptor signaling pathway)、细胞周期信号通路(cell cycle)等(表2),说明双莲方可能通过以上通路治疗肝细胞癌。将获得的结果导入Cytoscape_v3.7.2绘制作用靶点-信号通路网络图(图6)。
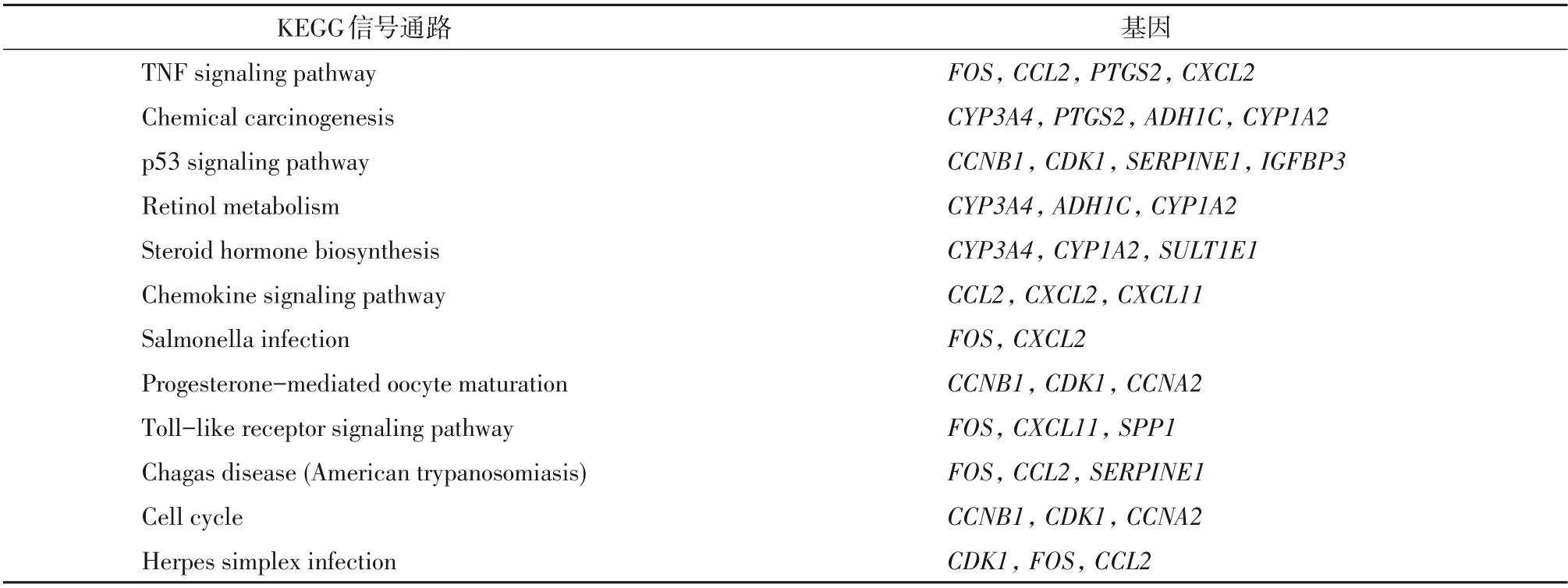
表2 KEGG富集结果Table 2 KEGG enrichment results

图6 靶点-信号通路网络图Figure 6 Target-signal pathway network
3 讨论
导致肝细胞癌的病因有很多,如生活习惯、遗传及理化因素等[9],这些因素可能会对肝细胞中某些特定靶点起作用,进而影响相关的信号传导通路,使基因表达异常[10,11]。因为有多种信号分子参与,涉及到多条复杂的信号通路,科研人员难以对肝细胞癌细胞中信号的输出情况作出准确的认识及判断,针对于单个分子靶点的研究策略有很大的局限性[12]。因此,本研究结合网络药理学及生物信息学的方法筛选双莲方治疗肝细胞癌的活性成分,得到其中的作用靶点后绘制药物-活性成分-靶点的网络图,分析GO、KEGG 富集结果,确定了双莲方在分子层面的靶点,预测出药物治疗肝细胞癌的有效成分及作用机制。
本研究根据显著性差异表达情况应用生物信息学的方法筛选出580个差异表达的基因,这些基因的表达改变与肝细胞癌的发生和发展有重要关系。从TCMSP中获取数据并筛选后得到双莲方的50个化学成分及1 385个作用靶点,其中双莲方中涉及靶点较多的化合物主要为槲皮素(quercetin)、木犀草素(luteolin)、山奈酚(kaempferol)等黄酮类化合物,说明这些化合物是双莲方中的主要活性物质。黄酮类化合物可通过调节增殖、分化、凋亡、炎症、血管生成、转移等途径中的各种酶和受体来减弱及抑制肿瘤的发生和发展[13]。槲皮素是一种明星抗癌化合物,可通过抑制Caspase/Cyto-c、AP-2β/hTERT、NF-κB/COX-2途径及阻断Akt/ERK1/2信号通路起到治疗肝细胞癌的作用,近年来相关研究较多[14-16]。木犀草素可作用于P53蛋白,使Bax表达增高,Bcl-2表达降低,促使Casepase3激活及PARP裂解,最终导致肝细胞癌细胞凋亡[17,18]。山奈酚对肿瘤的耐药性具有逆转作用,可通过影响Wnt/β-catenin通路使肝细胞癌细胞分化受阻[19]。
本研究通过活性成分-靶点及靶点-信号通路分析发现,在筛选出的28个潜在靶点中,PTGS2、CDK1、Cfos等能够影响细胞周期、机体代谢、机体免疫、信号传导、肿瘤的新生血管生成等,与肝细胞癌的发生及发展密切相关,可作为双莲方治疗肝细胞癌的关键潜在靶点。PTGS2为前列腺素合成反应的限速酶,又称为环氧合酶-2(COX-2),在心血管疾病、癌症等多种疾病中发挥重要作用[20,21]。COX-2参与肝细胞癌早期发生,COX-2低表达时与低分化的肝细胞癌组织相关,其过表达时与高分化的肝细胞癌组织相关,COX-2可促使VEGF表达增高、血管生成及PGE2的生成,激活抗凋亡通路Akt/PKB及诱导Bcl-2表达从而抑制凋亡,COX-2表达下调可能是治疗肝细胞癌的手段之一,阿司匹林、塞来昔布等多种COX-2抑制剂表现出优异的肝细胞癌治疗效果[22-24]。CDK 是一种对细胞周期及增殖有重要作用的激酶,多种肿瘤中均有过表达的CDK1/cyclinB,近几年成为抗肿瘤的重要靶点,抑制其表达对防治肿瘤有重要意义[25]。C-fos形成AP-1后可激活下游的通路,促进多种肿瘤细胞的增殖、迁移、侵袭等,其表达增高与肝细胞癌的发生与发展有重要关系[26]。
本研究通过建立蛋白互作网络和拓扑分析得到14个关键的蛋白节点和91条相互关系,提示双莲方是通过作用于这些关键蛋白从而影响相关通路以发挥作用。在进行GO和KEGG 的富集后发现半枝莲、半边莲、夏枯草中的活性分子与肝细胞癌细胞的多种代谢过程、刺激反应及生物调节有关,可通过调节P53信号通路、TNF信号通路、Toll样受体信号通路等影响肝细胞癌细胞的增殖、迁移及分化等过程。P53是机体内一种重要的抑癌基因,正常状态下不仅能维持细胞的正常生长还可抑制细胞的恶性增殖,当P53突变或失活时可启动肿瘤的发生。Li等研究发现高表达的SNHG1可通过与DNMT1结合靶向抑制P53的表达从而促进肝细胞癌细胞的增殖及侵袭,表明P53信号通路的激活可能对治疗肝细胞癌有重要意义[27]。Zanoaga等发现骆驼蓬碱可通过影响P53/P21信号通路抑制肝细胞癌细胞活力,增加其死亡[28]。TNF-α是参与多种肿瘤发生的重要因子,其生成与恶性肿瘤的低生存率有关,Chang等发现黄芪酸可通过抑制TNF信号通路使NF-κB活性减弱,从而抑制肿瘤细胞的过度增长及促其凋亡[29]。Toll样受体在多种肿瘤中表现为高表达,研究发现下调其表达可有效抑制肝细胞癌细胞的增殖与侵袭[30]。不同的信号通路在肝细胞癌发生的各个阶段发挥不同的作用,各个通路之间又相互交联,形成了复杂的调节网络。双莲方的多种活性组分可能通过对失衡的通路进行协同调控,从而发挥防治肝细胞癌的作用。

