特发性肠系膜静脉硬化性肠炎合并干燥综合征一例
胡小童,鲁厚胜,王东,贾丽萍,袁晓英
重庆市第九人民医院神经内科1、消化内科2,重庆 400700
特发性肠系膜静脉硬化性肠炎(idiopathic mesenteric phlebosclerotic colitis,IMP)是一种消化系统少见疾病,其临床症状以腹泻、腹痛为主,但缺乏明显特异性,临床上常因认识不足,出现诊断延误及漏诊[1]。目前针对IMP 病理生理研究主要集中在光镜病理检查,提示以结肠静脉病变为首要改变[2],但其详细机制上尚不明确。现报道1 例IMP 合并干燥综合征(Sjögren"s syndrome,SS)的罕见病例,希望能为今后研究IMP的发生发展机制提供一些新的思路。
1 病例简介
患者女性,71岁,因“右侧中上腹疼痛1年余,再发6 d”入我院消化内科。患者诉自1 年余前开始,无明显诱因出现右侧中上腹胀痛,伴纳差、乏力,曾外院行腹部CT 示升结肠病变(未提供原始资料,具体不详),自服中药治疗,疗效欠佳,反复发作。6 d前,患者腹痛再发,性质同前,大便一天一次,量少,色黄,自服“消炎利胆片、奥美拉唑、感冒片、中药”等药物后腹痛未见明显好转。遂至我院门诊就诊,行腹部平片示下腹线状高密度影及小液平(图1)。入院时诊断为腹痛:肠梗阻?入院后追问病史:既往有高血压病、乙肝病毒携带病史;曾行阑尾、舌下腺囊肿及胆囊切除术,具体手术方式不详;眼干、口干20+年,进食较干食物时需饮水辅助吞咽;因龋齿行全口腔义齿置换。患者父亲为中医,既往有长期服用中药调理史。否认食物、药物过敏史。查体:生命体征正常,心脏及肺部检查未见明显异常,腹部查体未见明显包块,右侧腹部压痛,轻微反跳痛,无肌紧张。

图1 可见线状高密度影(白色箭头)及小液平(黑色箭头)
实验室检查结果显示,血沉54 mm/H↑,超敏C反应蛋白44.20 mg/L↑,血红蛋白109 g/L,余未见异常。免疫球蛋白A 3.71 g/L,补体未见异常。抗核抗体(定量)>500 AU/mL、抗SSA抗体阳性(+)、抗Ro-52抗体阳性(+)。肝功能、肾功能、电解质、肿瘤标志物(CA199、CEA)、大便培养、血脂、二便常规、D-二聚体未见异常。
腹部增强CT 检查提示盲肠、升结肠及结肠肝曲肠壁增厚,周围脂肪间隙模糊。升结肠及肝曲见多发性线条状钙化灶,追踪其来源,考虑为肠系膜上静脉属支(图2)。肠镜示升结肠黏膜充血、水肿,散在分布大小0.5~1.0 cm 浅表溃疡,底白苔(图3)。施墨(Schirmer)试验:滤纸湿润长度3.8 mm/5 min。根据2016年欧洲抗风湿病联盟/美国风湿病协会(the European League Against Rheumatism/American College of Rheumatology,EULAR/ACR)分类标准,评分4分。
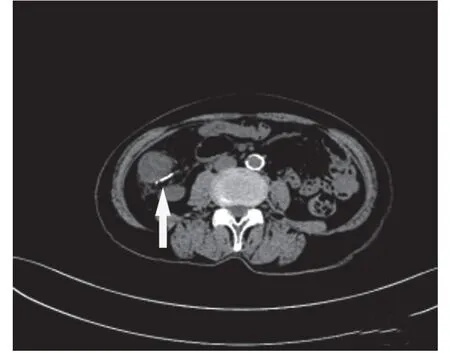
图2 入院时腹部增强CT示升结肠、结肠肝曲见线条状钙化灶(白色箭头)
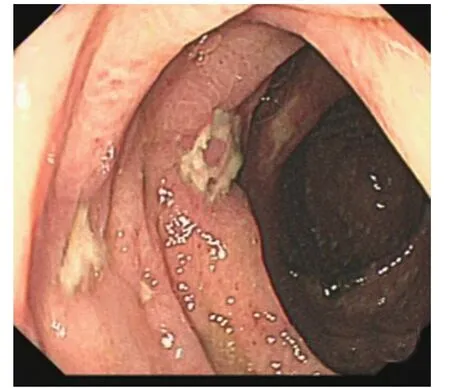
图3 入院后肠镜示升结肠黏膜充血、肿胀,散在溃疡
综合患者病史资料,考虑:1、IMP;2、干燥综合征。治疗上予停用中药,对症处理后患者腹痛缓解,肛门排气排便通畅,入风湿免疫科进一步处理干燥综合征。3个月后随访,患者腹痛未见复发,复查肠镜溃疡基本愈合(图4),复查CT 盲肠、升结肠、结肠肝曲肠壁稍增厚,右半结肠周围肠系膜上静脉分支多发钙化(图5)。
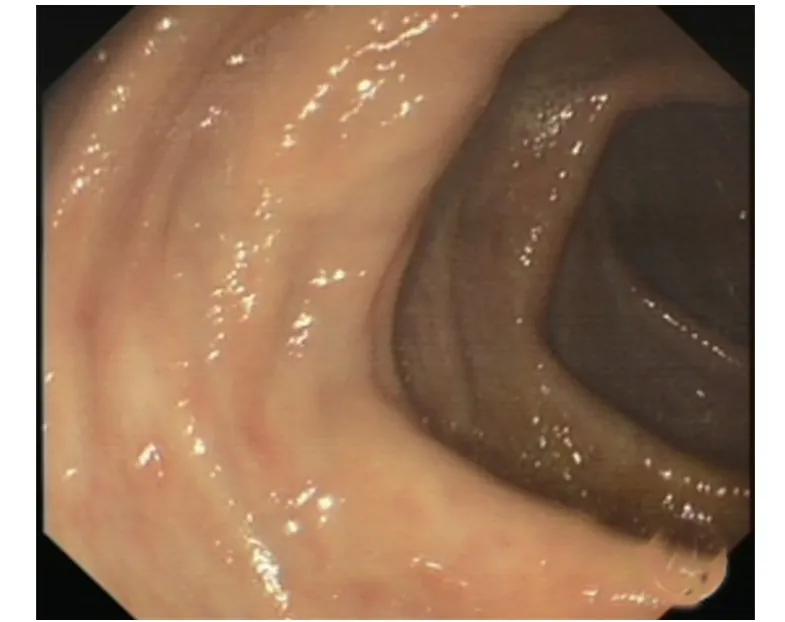
图4 3个月后复查肠镜溃疡基本愈合
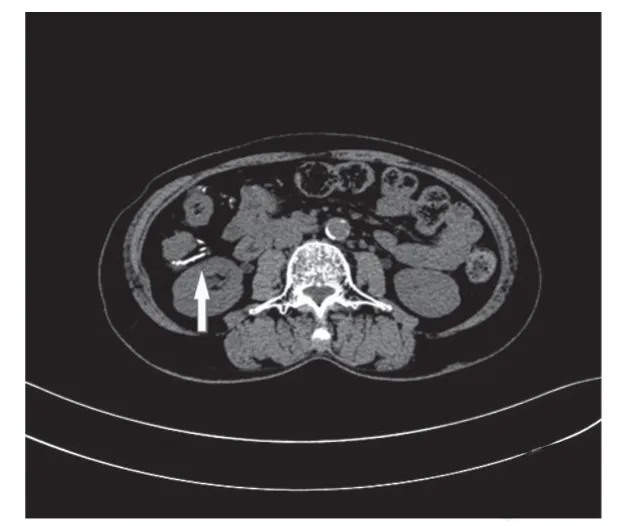
图5 3 个月后复查腹部增强CT 结肠肠壁稍增厚,右半结肠周围肠系膜多发钙化
2 讨论
2.1 疾病概述 IMP归属于缺血性结肠炎,发病率较低,KOYAMA等[1]于1991年首次进行了报道。IMP发病年龄30~86岁,女性明显多于男性,比例为3:10,亚洲裔且有中草药服用史是其一重要临床特点[2]。IMP 临床表现并无特征性,以腹痛、腹泻为主,可伴有恶心、呕吐,部分病例可出现不全性肠梗阻征象,少见穿孔[3]。
2.2 诊断标准 本病临床表现无特异性,且为罕见病,仅仅通过临床表现及体征进行诊断,极易漏诊及误诊。既往研究发现,肠系膜线状钙化为IMP特征性影像学改变,有重要临床提示意义[4]。IMP 影像学主要表现为:①腹部平片可见腹部存在线性钙化,以右侧腹部(升结肠区域)多见;②腹部增强CT扫描可见结肠肠壁增厚,部分病例可见分层样肠壁强化,结肠肠壁周围系膜增厚,肠壁周围见线状钙化灶,追踪其来源,显示以肠系膜静脉管壁钙化为主;结肠镜检查示病变主要累及盲肠、升结肠等右半结肠,黏膜充血水肿、呈暗紫色,伴或不伴溃疡[5-6]。
2.3 发病机制 IMP 发病机制尚不明确,现有研究主要集中在病理方面,主要体现为结肠静脉壁增厚、钙化,伴有纤维化;肠壁黏膜中血管周围胶原沉积,泡沫状巨噬细胞浸润于小血管壁浆膜下层;结肠静脉壁出现钙化灶,病变血管管腔狭窄,并可于病灶内发现黏膜下纤维化和血管周围纤维化,但血管固有层并未发现活动性炎症,血管内未见血栓[7]。结合大部分病例中药服用史及右半结肠静脉易受累特征,提示其病理生理机制可能是药物所含某些物质在结肠被细菌分解后在右侧结肠吸收,作用于结肠静脉及周围组织,最终导致病变的组织纤维化、硬化、钙化[8]。
2.4 病例启示 干燥综合征是一种较为常见的慢性自身免疫性疾病,其总体病程发展较缓慢,以外分泌腺受累为主,其特征性临床表现为眼干、口干等,此外尚可出现多系统损害的症状。既往研究显示干燥综合征肾脏及肺组织损害病理机制在于由免疫复合物介导,自身免疫炎症反应破坏上皮细胞,导致自身抗原暴露,持续过度活化的B细胞和浆细胞产生大量自身抗体,二者结合形成免疫复合物并进入外周循环,与毛细血管内皮细胞结合后激活补体经典途径,诱导炎症损伤和血管性损害,可累及中小血管,血管炎亚型的范围可从过敏性血管炎到坏死性血管炎,并最终导致肺间质及肾间质纤维化[9]。本例患者为IMP合并SS,结合既往研究,两者病理组织均可见血管性损伤,后期可见纤维化形成,两者病理机制存在一定共性,提示免疫学相关机制可能参与IMP的发生发展。
综上所述,既往病例报道及相关病理生理研究并未涉及免疫学相关机制,该病例一定程度上揭示了IMP 免疫学病理机制可能,今后研究可侧重电镜病理及免疫学方向,以进一步揭示IMP病理生理机制。

