静脉旁路移植疾病动物模型的建立及应用进展
杨仁从杨丰华李小辉李相念李文华廖胜杰张晓慎∗
(1.暨南大学附属第一医院心血管外科,广州 510630; 2.广东省实验动物监测所/ 广东省实验动物重点实验室,广州 510633)
心血管疾病是世界上发病率、致死率最高的疾病。 数据显示,我国心血管疾病的发病率和致死率仍处于上升阶段,其死亡占居民疾病死亡构成40%以上,居于首位,高于肿瘤及其他疾病,其中冠心病的死亡率占到心血管疾病的24.1%,且一直呈现上升态势[1]。 因此,冠心病的防治工作负担严重,面临着巨大挑战。 冠心病的最主要原因是心肌缺血,治疗缺血性心脏病的主要方式有药物治疗、经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)和冠状动脉旁路移植术(coronary artery bypass grafting,CABG)[2],虽然药物治疗像他汀类药物的应用大大降低了心脏的不良反应,PCI 手术可治疗大部分急性心肌梗死,但是CABG 仍然是治疗冠脉多支病变患者的优先选择,并且在长期生存率和缓解心绞痛方面具有显著优势[2-3]。 自从1964 年,Vasilii Kolesov 完成了第一例使用自体乳内动脉的冠脉旁路移植术[2],1967 年Favalovo 完成第一例使用自体大隐静脉的冠脉旁路移植术以来,冠状动脉旁路移植手术在临床上得以广泛应用,大隐静脉和乳内动脉也是至今为止最常用的桥血管[2]。 提高静脉桥血管的通畅率和医师微创手术技术培训是目前CABG 发展存在的问题,这需要建立稳定可重复的实验动物模型,为评估手术效果、防治冠脉静脉旁路移植病、外科医师培训提供一个可靠的工具。
1 静脉旁路移植疾病实验动物模型概况
1.1 建立静脉旁路移植疾病模型实验动物种类特征
国内外为研究旁路移植疾病建立了各种各样的实验动物模型,从动物种类的选择上来看,有小鼠、大鼠、家兔等小动物和犬、羊、猪等大动物,在小动物和大动物在建立模型上各有利弊。 小动物具有来源方便、价格便宜、容易饲养和获得大量样本数据的优点,但是小动物的心血管和人类心血管系统差异大,不能完全模拟人心血管疾病病变,具有明显的局限性,尽管大动物比小动物更加昂贵、需要较多的药物、外科手术成本以及饲养成本更高,也不容易获得大量的样本数据,但大动物心血管在生理解剖结构与生理指标上,较小动物更接近于人类的心血管系统。 目前,在小鼠、大鼠和家兔等小动物上建立的模型有颈静脉-颈总动脉移植血管病变模型,颈动脉-股动脉移植模型,下腔静脉-颈动脉移植血管病变模型等;使用犬、羊和猪等大动物上建立的模型主要有大隐静脉-冠状动脉移植血管病变模型,乳内动脉-冠状动脉移植血管病变模型,股静脉-股动脉桥血管模型等。
1.2 静脉旁路移植病动物模型建立方法
1.2.1 小动物模型建立方法
为与大动物静脉旁路移植病模型进行类比研究,我们总结了小动物模型建立的现状,在小动物上其他部位手术可以在一定程度模拟病变的发生与进展,造模方式按照缝合方式来划分,主要分为直接缝合和Cuff 套管技术辅助缝合。 小鼠、大鼠和家兔都常用直接缝合法,取下腔静脉、颈静脉或者腹壁静脉缝合至颈总动脉或股动脉上,通常用8/0或10/0 无损伤缝线进行缝合,缝合法操作直接,易于掌握,但增加了实验误差[4-7]。 Cuff 套管技术主要应用在小鼠模型的建立上,简单来讲就是采集移植静脉如下腔静脉缝合到左侧或右侧颈总动脉上,将静脉留置针剪成适宜长度的套管,在套管一端做一小柄,游离颈总动脉,在近心端阻断,在分叉处结扎、切断,然后从做好的套管内穿出,血管内膜外翻至套管上固定,再将取下的桥血管在翻折边缘处与动脉缝合,放开血管夹使下腔静脉充盈,血流恢复。因为小鼠血管很细,若直接缝合容易发生吻合口处狭窄,所得静脉旁路移植病模型不能排除手术技术带来的实验误差,Cuff 套管技术使得吻合口处不易狭窄,操作简便迅速,内膜光滑不易发生血栓,因此在小鼠模型的建立上具有显著优势[8-10]。
造模方式若按照搭桥方法来划分则分为端侧吻合、端端吻合以及血管壁补丁三种。 大小鼠体型较小,通常进行端侧吻合,颈静脉或下腔静脉可以游离一端缝合至动脉管壁上;家兔则进行端端吻合,将家兔颈内静脉或颈外静脉整段游离,并将颈总动脉阻断,两端进行吻合,桥血管全段灌注动脉血流,使内膜增生的病变更加明显[6,8];此外,小鼠可做另一种特殊的吻合方式即血管壁补丁,只取小面积颈总静脉血管壁缝合至颈总动脉上也能观察到内膜变化[11]。 小鼠、大鼠和家兔的静脉旁路移植疾病病理学改变呈现递进的变化,动物体型越大,则病变越呈现一定的层次,观察越清晰。 因此,家兔在术后2 d 即可发现炎症细胞粘附于内皮细胞,术后7~10 d 观察到静脉桥出现阻塞,术后2 周内膜、中膜增厚,胶原纤维和弹力纤维增生,术后4 周则显示内膜破裂, 中膜显著增厚, 弹力纤维断裂[12-13]。
1.2.2 小型猪模型建立方法
大动物的静脉旁路移植病模型相比小动物要少,但是大动物在建立模型上具有巨大的潜力。 上世纪七十年代,研究者们开始将猪用于心血管疾病的研究当中,发现猪的心血管系统比其他动物和人具有更高的相似性。 用于实验的小型猪(25 ~30 公斤)的心、体比率与人相同,在解剖上,猪的冠状动脉分布与人相似,都几乎完全缺乏先天性的侧枝和吻合,而且猪的心脏代谢和动脉粥样硬化的过程也和人类相似[14]。 有研究显示,通过给猪喂食高胆固醇饮食,猪发展了冠脉粥样硬化病变且能发生心肌梗死,这与人类冠心病发生发展类似,测定冠心病猪模型和人的血清蛋白组,发现二者在疾病相关的8 个功能组上存在相似性[15-16],猪在心血管疾病研究的应用价值得到人们重视。 在猪身上通常取乳内动脉与左前降支进行搭桥或是建立双侧、Y 型乳内动脉桥[17-18],但是静脉搭桥作为传统方法有静脉桥血管来源丰富,获取技术简单,实验人员也容易掌握的优势,具有建模的潜力。 有研究用长白猪作为实验动物,用no touch 技术剥取大隐静脉与颈总动脉进行端端吻合[19]。 猪不仅可用于静脉旁路移植病研究,还适用于麻醉技术、体外循环和外科手术培训的创新与改造。 然而目前对于猪静脉桥狭窄模型还没有统一的标准,这是猪作为实验动物疾病模型需要深入研究的一个方向,该模型将会是一个非常有用的工具。
1.2.3 其它大动物模型建立方法
犬的心脏很大,占其体重的0.72%~0.96%,血液循环系统发达,适于做心脏手术及慢性实验,比格犬是常用的实验犬类品种。 在犬身上通常建立的是动脉桥血管模型有颈总动脉-左旋支模型、股动脉-左旋支模型和乳内动脉-左前降支模型[20-21]。有文献报道在杂种犬上通过静脉移植物将停博液注入升主动脉来检测一种自动吻合装置,但并未观察静脉移植物狭窄病变[22];也有研究采集比格犬的双侧股静脉,吻合至股动脉,采用端端吻合方法建立了股静脉-股动脉移植模型来模拟CABG 手术吻合口病变[23]。 但还未见到静脉旁路移植病实验犬模型,这也有待建立。
用羊建立心脏疾病模型的研究很少,有研究者采取成年绵羊的大隐静脉,每只羊接受两次静脉移植,一段静脉吻合至左前降支,另一段吻合至钝缘支,成功建立了静脉旁路移植病模型[24]。
非人灵长类动物主要指猿猴类如恒河猴、红面断尾猴等,它们在种属上和人类最为接近,所建立的非人灵长类动物疾病模型具有更高的相似性和可类比性。 它们容易诱发动脉粥样硬化,是较理想的模型。 但它不能完全模拟人类粥样硬化的病变,猴的病变部位经常在小动脉,人则在大动脉,猴的病变即使出现在大动脉也与人类分布不同。 此外,非人灵长类动物价格昂贵,饲养成本高且不易获取大样本,这也是它们作为实验动物的局限性。 目前,尚未在灵长类动物上建立静脉旁路移植病模型。
通常来说,大动物模型在术后4 ~12 周都可观察到静脉桥内膜增生、中膜平滑肌增厚、管腔狭窄甚至闭塞,它们病变过程长,有利于做慢性实验。
1.3 常用取材桥血管
乳内动脉是临床上最常用的桥血管,术后患者的随访中也证明了乳内动脉桥具有良好的长期通畅性。 但是,当患者需要紧急血运重建时,乳内动脉的使用率占61.5%,在非紧急情况下,其使用率占92.5%,也即血流动力学不稳定时会有相当一部分患者取静脉作为桥血管,因为在这种情况下,只有静脉血管才能绕过所有重要的冠状动脉狭窄病变,利于快速取材[25]。 此外,近年来桡动脉也逐渐成为继乳内动脉后第二常规使用的动脉桥血管,它长度足够,血管壁宽厚,对吻合技术的要求较低,且早期效果很好,相对静脉桥也可以改善中远期预后;但是桡动脉的缺点也非常明显,由于它管壁中层有大量平滑肌细胞,对手术过程中的外界刺激非常敏感,容易发生痉挛,这可能是远期血管狭窄的原因。 另一项研究表明桡动脉远期死亡率为24.5%(平均随访6.6 年),因此,桡动脉的采集有赖于无接触技术,它与乳内动脉早中期效果相当,远期效果尚不确定[26-27]。 胃网膜动脉是另一种可用导管,虽然使用较少,但有研究证实它能够长期通畅,患者也有良好的术后生活质量[28]。 这是三种人类常用的动脉搭桥血管,通常在动物上使用的是乳内动脉桥和股动脉桥。
人类动脉血管桥存在长度不足的问题,而这正是静脉血管桥的优势所在。 CABG 手术最常用的静脉是大隐静脉,也是大动物模型常用的静脉桥。 但是大隐静脉较高的远期闭塞率,成为它使用的一个局限。 血管造影显示,大隐静脉在术后平均7.6 年的闭塞率是桡动脉的2 倍,接受大隐静脉移植的患者在平均7.6 年内的死亡风险比桡动脉移植患者高了44%[27]。 乳内静脉也逐渐开始作为动物模型的取材血管,尤其在猪的身上,由于其大隐静脉不像人的那样长,且管径小不易进行手术操作,而乳内静脉可以方便得与冠状动脉吻合并且距离足够。虽然乳内静脉在临床上并不常用,但是有患者由于右乳内动脉远端的内膜质量和口径不理想,不得不缩短乳内动脉的获取长度,这也导致到右冠脉的长度不够,于是医生用2 ~3 cm 的右乳内静脉与右乳内动脉吻合,延长了桥血管长度,且在六个月内通畅率良好。 除此之外就没有其它类似病历了,使用猪作乳内静脉搭桥的研究也只有一项,且成功建立了其内膜增生的模型[29-30]。 这两项研究为建立乳内静脉桥动物模型提供了可能性。 不同动物模型种类及桥血管取材总结如表1。
1.4 模型评价指标
在模型整体上超声检测是一种判断血管是否狭窄,血流是否通畅的比较直观的方法,超声血流检测仪可以测量不同狭窄程度时桥血管的即时血流,也可以观察到静脉桥内膜是否有斑块形成、增厚和管腔是否狭窄[17,21]。 血管造影也可以准确得反映桥血管的病变部位和程度[21,31]。 在组织水平上,病理学改变是模型建立是否成功的金标准,大多数研究都能够在术后4 周观察到典型静脉旁路移植病变,即内膜增生、中膜平滑肌细胞增殖与迁移、管壁增厚和管腔狭窄,长时间的病理观察则需要进一步验证。 在细胞水平上,通常培养大隐静脉细胞来观察不同扩张液等对细胞形态及活力的影响[32-33],也有用AngⅡ诱导人脐静脉细胞模拟建立静脉桥内皮细胞损伤模型,MTT 法检测细胞活力表明1 μmol/L 浓度诱导24 h 为最佳,此时细胞活力下降率最大,适宜进行各种基因或药物研究[34]。 在分子水平上,主要探索CABG 术后桥血管狭窄的体外诊断指标,如在非人灵长类动物术后测定血浆IL-6 水平、内皮素等[32,35]。
2 静脉旁路移植病动物模型存在的问题
静脉旁路移植病模型也存在各自的问题。 大小鼠的血管重建也只能诱导最小程度的炎症和血栓形成,大多数野生型小鼠仅发育有限的肌内膜,仅由几个细胞层组成,因此小鼠模型易出现Ⅱ型错误,很难进行早期评估,可用于后续分析的样本量也较少;家兔同样如此。 犬模型中未见明显的狭窄病变;羊和猪的麻醉成本太高,且样本量太少不足以证明有临床意义。 所有的动物模型都有药物疗效等测试时间的有限性,血管重构不能长期维持,也没有理想的模型可以完全概括人类血管损伤后的多变量反应,外推不能有最大意义[36]。
3 静脉旁路移植病动物模型的应用
3.1 基因治疗的应用
CABG 术后静脉桥血管狭窄或闭塞是需要解决的一个问题,大隐静脉取材方便,长度足够,且采集后对下肢供血影响不大,是临床上最常用的移植静脉,研究发现,大隐静脉作为桥血管术后10 年中有超过60%出现了再狭窄[36]。 静脉桥再狭窄由多种因素导致:早期(术后1 月内)的狭窄多与血栓形成有关,血栓的形成可与手术操作技术不当、血液的高凝性等有关;中期(术后1 个月~1 年)狭窄多与桥血管内膜增厚、中膜平滑肌细胞增殖有关;晚期(术后1 年以上)狭窄主要是由于动脉粥样硬化血管疾病所致[37-38]。 其中中晚期狭窄是需要预防治疗的阶段。
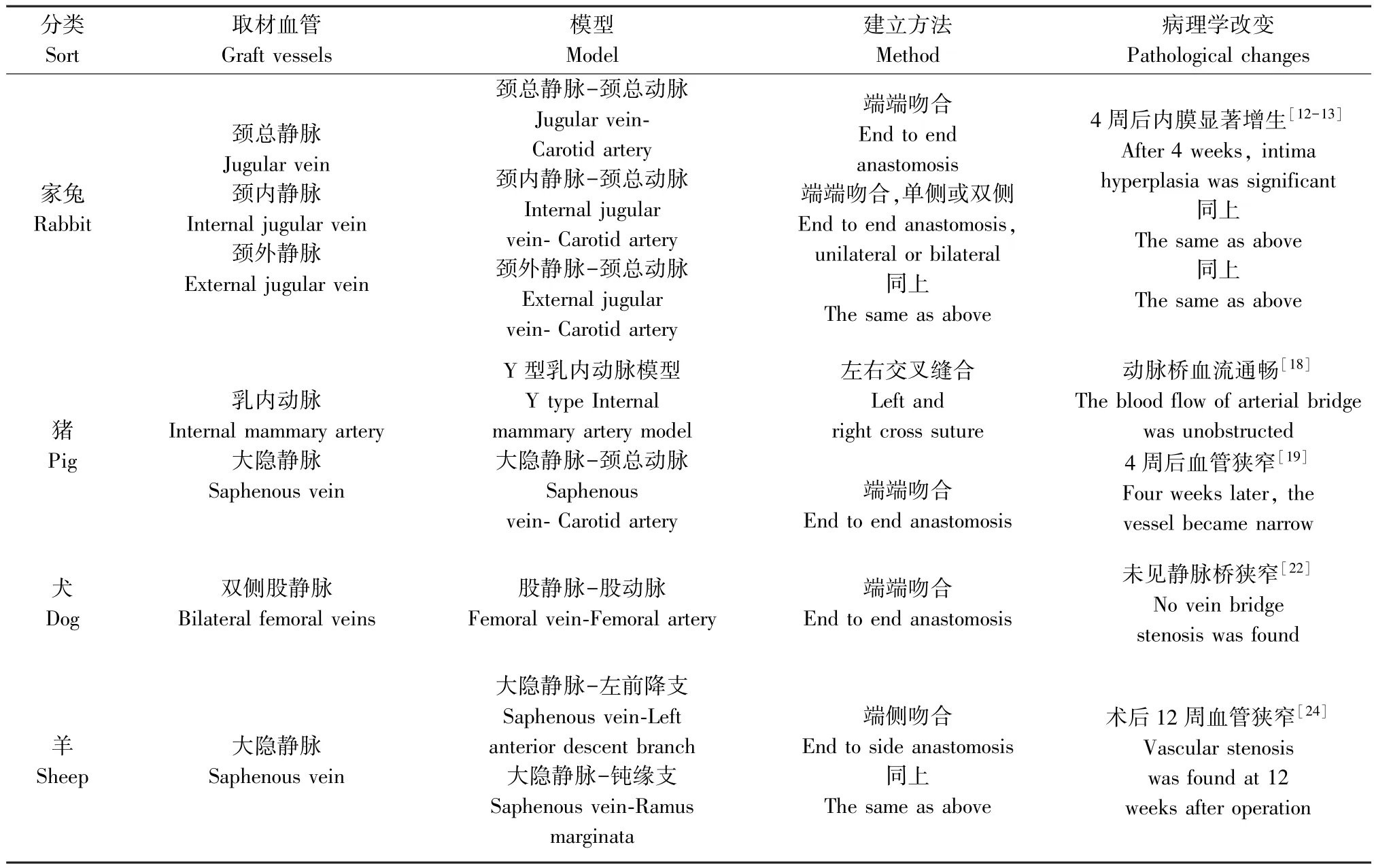
表1 实验动物种类、桥血管模型种类与人的比较Table 1 Comparison of experimental animal species, bridge vascular model and human
了解移植静脉桥血管狭窄的病理机制有助于我们寻找多种多样的预防方法,预防静脉桥血管狭窄的方法如药物治疗等虽然取得了一定的效果,但是都未从根本上改变静脉桥血管远期通畅率低的问题,研究者们希望从静脉移植病的病理生理机制上寻找新的基因靶点来进行干预。 用于治疗的基因靶点研究有eNOS 基因(一氧化氮合酶基因)转染防治静脉桥狭窄、CatS 基因(组织蛋白酶S 基因)敲除后观察内膜增生等等,它们可能通过释放NO 或者减少MMP-9 酶的含量来抑制狭窄[8,39];用于诊断靶点的有VEGFR-3(血管内皮生长因子受体)和CAV3(钙通道蛋白),它们的表达增高或是C-Myc蛋白增多可作为反映早期血管损伤后内膜扩张、预测早期狭窄的指标,这些指标有利于患者及时得到筛查与干预[12,40];在药效毒理及安全性评价方面,雪绒花中木酚素成分、白藜芦醇联合应用山楂总黄酮都可有效抑制血管平滑肌细胞的增殖,对内皮细胞具有保护作用,可以作为候选药物和疗法[7,41];模型还可用于器械仪器的创新及评价,如新型桥血管外支撑装置、新型血流分析仪器、新型自动吻合装置的研发等等[22,24,42]。 除了寻找相关基因进行治疗以外,基因治疗本身的技术难题也需要解决,比如在目的基因传递载体的表达持续性问题上有待研究,从而获得远期的临床反应。
3.2 微创外科技术的医师培训
开胸手术对患者手术创伤大,严重并发症多,恢复慢,增加了住院负担,微创手术很好地改善了这些不足。 20 世纪90 年代胸腔镜技术应用于心脏外科,微创心脏外科由此诞生并迅速发展,现今微创心血管外科技术主要包括小切口技术、胸腔镜技术、复合技术和机器人应用等[43-44]。 但是,这些微创技术手术难度增大,医生要适应窄小的术野与加长的手术器械,成员配合困难,外科医生需要通过反复模拟练习与实践才能掌握并精通。 外科医师技术成长不仅需要器械模型或数字虚拟模型的创新,更需要建立疾病动物模型来给医生提供更加真实的技术实践,这是我们研究静脉旁路移植疾病动物模型一个非常重要的应用目的。
分析外科医生学习CABG 手术的学习曲线显示,随着外科医生经验的增加,术中体外循环和动脉阻断的时间得到了改善,并且在术前可以提高这段时间的预测性与计划性,其他技能如主动脉瓣置换、二尖瓣置换等也得到了提高,但是CABG 手术的效率并没有随外科医生经验丰富而提高[45]。 CABG手术技术朝着微创的方向发展,技术难度增加,延长了医生学习周期。 此外CABG 大多用于有复杂病变的患者,手术风险大、状况复杂,这更加需要构建动物模型为外科医生提供实践操作的机会。 研究显示,一些外科手术的学习曲线会呈现典型的特征,即在刚开始接触一项新的手术时,不同医生的熟练程度表现出差异性,随后是一个快速提升的阶段,最后进入平稳期。 CABG 手术的熟练程度随着练习时间的增加呈线性上升,在大概完成30 例手术后,手术效率提升显著,足够数目的操作练习对医生熟练掌握这项手术十分重要[46-47]。 因此,动物模型模拟训练会对外科医生的成长有很大的帮助。
4 总结与展望
实验动物模型的建立是医学研究的重要方法,有助于我们在体外模拟疾病的发生发展过程,研究新的预防与治疗方法。 静脉旁路移植疾病动物模型有助于我们了解其病理生理机制,为预防治疗奠定基础,也为外科医生手术技术培训提供更多的机会。 考虑到小动物经济实用的因素,目前用小动物建立模型的研究居多,但大动物如犬、猪具有造模的良好前景,找到最合适的建模方法制定标准是研究者努力的方向。

