异氟醚麻醉前应用咪达唑仑与布托啡诺对小鼠麻醉效果影响评价
韦雪梅冯海妹徐志新
(海南医学院第二附属医院麻醉科,海口 570311)
目前临床手术麻醉已极少使用单一麻醉剂,而是倾向于采用平衡麻醉,不仅可以有效避免单一麻醉药物导致的一些不良反应,而且能有效确保较好的麻醉质量[1]。 异氟醚是常用吸入麻醉药之一,适合实验动物药理和代谢研究,然而会引起呼吸抑制、心血管动力学不稳定等不良反应[2-3]。 因此近年来临床研究者提出在异氟醚麻醉前可予以镇静镇痛药物,以此减少异氟醚的不良反应。 目前临床研究证实, 咪达唑仑(midazolam) 和布托啡诺(butorphanol)作为麻醉前组合具有较好的镇静和镇痛作用,对心肺影响较小,可以抑制全麻患者气管插管时的应激反应[4-6]。 但目前咪达唑仑和布托啡诺联合麻醉前使用对异氟醚浓度及麻醉效果的影响研究鲜见文献报道,因此本研究通过观察咪达唑仑和布托啡诺联合麻醉前用药对小鼠麻醉效果的影响,为临床应用提供实验数据支持。
1 材料和方法
1.1 实验动物
选取75 只清洁级BALB/c 小鼠,鼠龄49 d,雌雄不限,体重18 ~22 g,所有小鼠在动物房进行适应性饲养1 周,保持环境清洁,温度、湿度相对稳定,正常饮食饮水。 由长沙市天勤生物技术有限公司生产提供[SCXK(湘)2014-0011],饲养由长沙市天勤生物技术有限公司完成[SYXK(湘)2014-006]。 动物处理及实验过程得到海南医学院动物关怀及使用委员会的许可(IACUC0023)。 实验研究过程中严格遵守3R 原则。
1.2 主要仪器与试剂
ABS 小动物专用气体麻醉机(武汉医用仪表有限公司); HN13-GY - 6620 呼吸监护仪(Datex Engstorm 仪器公司,芬兰);NW-TP01 商用体温传感器(Philips 公司,德国);MouseOx 啮齿动物脉搏血氧计和心率监测仪(Philips 公司,德国);迈瑞PM7000 循环监护仪(Philips 公司,德国);重症监护仪G80(Datex Engstorm 仪器公司,芬兰);罗康全活力II 型血糖检测仪(罗氏公司,瑞士);YLS-13 A 大小鼠抓力测定仪(济南益延科技发展有限公司);异氟醚(批号:090822,河北九派制药有限公司);布托啡诺(批号:090056,江苏恒瑞医药股份有限公司);咪达唑仑注射液(批号: 20110412, 国药准字H19990027,江苏恩华药业股份有限公司);皮质醇(Cor)检测试剂盒(批号:081005,江苏恒瑞医药股份有限公司)。
1.3 实验方法
1.3.1 实验分组
本研究预实验应用probit 法测算量效关系,以小鼠捏尾反射消失为达到麻醉深度标准,咪达唑仑ED50 值(95%可信限)为 2.5(2.2 ~2.9)mg/kg,布托啡诺 ED50 值(95%可信限)为 2.0(1.6 ~2.3)mg/kg。 应用随机数字表将75 只小鼠随机分成3组:对照组,仅予以吸入3%异氟醚全麻,麻醉前腹腔注射生理盐水1 mL;对照组,在吸入异氟醚前15 min 腹腔注射咪达唑仑(2.5 mg/kg)及布托啡诺(2 mg/kg),上述药物溶于1 mL 生理盐水中进行腹腔注射;空白组,不予以小鼠任何麻醉处理。 每组各25 只小鼠。 对照组及观察组小鼠注射药物统一进行,事先将药物配伍溶解完全后,进行随机编号,由另一工作人员进行腹腔注射操作,注射前抽签数字,注射标注相应数字药物,并对小鼠编相应数字。实验结束后揭盲,确定小鼠具体分组情况。
1.3.2 麻醉处理
空白组小鼠仅固定于小鼠固定板上,不予以麻醉处理,接MouseOx 啮齿动物脉搏血氧计和心率监测仪检测心率及氧饱和度(SpO2)。
将小鼠放入麻醉箱,置于35℃环境中连接麻醉机,以混有30%氧气的空氧混合气体作为载体气体,通气流速(mL/min)= 0.65×体重(g)。
当小鼠达到麻醉深度捏尾反射消失,即可开始气管插管。 立起小鼠插管台,将小鼠门齿悬挂与放入自制小鼠插管台上端的细绳,镊子拉出小鼠舌头后,用左手将小鼠舌头往腹侧拉出,直视下将光纤置入气管,然后在光纤引导下,将16 号套管针粗的金属插管插入气管约5 mm,并用胶带将连接金属插管的塑料管固定。 接上呼吸机观察小鼠胸廓起伏,判断插管是否成功。 见图1。 启动呼吸机,调节每次通气量为200 μL,通气频率为每分钟120 次。 行间歇正压通气(IPPV),呼吸比为1 ∶2潮气量设定15~20 mL/kg,呼吸次数每分钟 15 ~20 次,维持PetCO2在 35 ~ 40 mmHg。 麻醉过程中对照组及观察组小鼠均存活。
1.3.3 观察指标
(1)诱导和恢复时间
记录每只小鼠的诱导及恢复时间。 其中诱导时间定义为吸入3%异氟醚或腹腔注射咪达唑仑+布托啡诺后翻正反射消失的时间。 恢复时间为诱导60 min 后停止吸入异氟醚,翻正反射恢复正常时间。
(2)镇静和镇痛时间
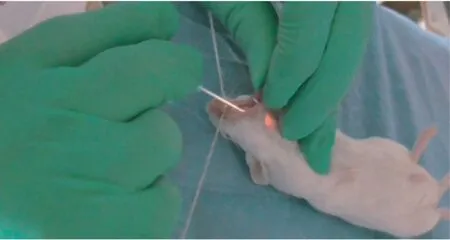
注:小鼠悬挂在立起的插管台上,牵出舌体,显露咽腔。图1 小鼠固定及咽腔显露Note.Mice hanged in the standing intubation table, pull out the tongue, then the pharynxwill be revealed.Figure 1 Mice fixed and exposed pharynx
记录每只小鼠的镇静时间和镇痛时间。 其中镇静时间为以翻正反射消失为指标,将动物背朝下轻轻放在马口铁皮上铁皮保持30℃,并轻轻振动,若动物背向下的姿式保持30 s 以上,则翻正反射消失。 镇痛时间为疼痛消失时间,即小鼠扭体反应消失时间,扭体反应具体表现为腹部收缩内陷,躯体扭曲,后肢伸展、蠕动。
(3)生命体征指标
每只小鼠插管即刻、插管后每5 min 记录心率和氧饱和度(SpO2)等生命体征指标,观察1 h,共测定13 次。 麻醉开始后,小鼠被放置在恒温毯上以保持参数的稳定。 使用啮齿动物脉搏血氧计和心率监测仪记录心率(Beats/min)和SpO2(%),并计算各自指标的变异系数(CV)=标准偏差/平均值。
(4)血糖及皮质醇水平
分别于麻醉前30 min 及麻醉后30 min 抽取每只小鼠尾静脉血50 μL,采用放射免疫法检测血清皮质醇(Cor), 微量血糖仪测定法检测血糖(glucose,Glu)水平。
1.3.4 不良反应
根据以前关于啮齿类动物的麻醉不良反应的报告[7],记录各组小鼠不良反应发生率,包括头部摇晃、排尿、排便和呼吸暂停。 同时评估麻醉后1 周异常反应。
1.4 统计学方法
本研究采用SPSS 23.0 软件进行统计分析,计量资料采用平均数±标准差(±s)表示,符合正态分布资料2 组间比较采用t检验;同组小鼠不同时间点心率及SpO2数值比较采用重复测量的方差分析。 计量资料使用%表示,组与组之间比较采用χ2检验。 并发症发生率应用 Fisher’st检验。P<0.05认为差异有统计学意义。
2 结果
2.1 麻醉效果指标比较
空白组小鼠未予以麻醉处理。 观察组和对照组小鼠均能快速诱导,观察组与对照组诱导时间差异具有统计学意义(P<0.05),恢复时间差异无统计学意义(P>0.05)。 全部小鼠吸入异氟醚6 min 后,肌肉紧张状态消失。 停药后(7.03±1.06)min,肌力恢复正常。 观察组小鼠镇静起效时间(3.35±0.11)min、疼痛消失时间(4.06±0.14)min 短于对照组小鼠(6.48±0.23)min、(8.11±0.21)min,差异具有显著统计学意义(P<0.001)。 见表1。
2.2 生命体征比较
三组小鼠插管后各时间点的心率、SPO2比较,采用重复测量数据的方差分析,结果:①空白组心率高于对照组和观察组(P<0.05);诱导后5~35 min 时刻,对照组心率高于观察组(P<0.05);诱导后35 ~60 min 时刻,对照组心率低于观察组(P<0.05)。 诱导后1 h 对照组SpO2低于观察组及空白组(P<0.05);观察组及空白组SpO2无显著差异(P>0.05)。 ②三组心率的变化趋势有差别(F= 15.215,P= 0.000)。 三组SpO2的变化趋势无差别(F=1.015,P=0.180)。见图2。
2.3 血清 Cor、Glu 水平比较
麻醉前三组Cor、Glu 水平比较差异无统计学意义(P>0.05);麻醉中对照组Cor、Glu 水平高于空白组和观察组(P<0.05),而空白组和观察组Cor、Glu水平差异无统计学意义(P>0.05)。 对照组术中Cor、Glu 较术前升高,差异具有统计学意义(P<0.05),而空白组和观察组Cor、Glu 水平差异无统计学意义(P>0.05)。 见表2。
2.5 不良反应发生的比较
空白组小鼠无死亡,无不良反应发生。 麻醉后1 周对照组死亡1 只,生存率96%,观察组死亡2只,生存率92.6%,两组无显著差异(P=0.552)。两组小鼠不良反应主要为摇头、排尿、排便、呼吸抑制,两组总不良反应发生率无显著差异(P=0.626)。 见表3。

表1 麻醉效果指标比较Table 1 Comparison of indexes of anesthetic effects between two group
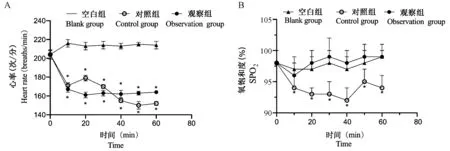
注:A:麻醉各时间点心率比较;B:麻醉各时间点SPO2 比较。 与空白组比较,∗P<0.05。图2 三组麻醉期间心率及SPO2 比较Note.A, Heart rate over time in each group.B, SpO2 over time in each group.Compared with blank group, ∗P<0.05.Figure 2 Measured heart rate and SPO2 in each anesthetic group

表2 三组血清Cor 及Glu 水平的比较Table 2 Comparison of serum levels of Cor and Glu among three groups

表3 两组不良反应比较(%)Table 3 Comparison of incidences of clinical adverse reactions during induction
3 讨论
由于吸入麻醉剂存在着镇痛不足缺点,在某些精准手术麻醉效果欠佳,影响手术操作及手术效果,因此常需加用镇静药或镇痛药配合[8]。 咪达唑仑为苯二氮卓类药物,由于其迅速起效而适合用作麻醉前药物,常用于实验动物镇静药,既往被认为不具有镇痛作用[9]。 布托啡诺是合成阿片类镇痛药,属于激动κ 受体,也是常用的实验动物止痛剂,研究显示其易导致呼吸抑制,影响术后复苏[10]。 既往研究报道[11],阿片类镇痛药曲马多能降低异氟烷MAC 至15%。 而有学者提出,苯二氮卓类药物咪达唑仑除了辅助镇痛,它还可以起到镇痛功能。 Kim等[12]、Tamura 等[13]将咪达唑仑与芬太尼复合,显著降低异氟醚的夹尾疼痛反射,从而明显降低异氟醚的MAC 值。 然而目前尚无关于镇静药和止痛药麻醉前联用对实验动物异氟醚麻醉效果的影响报道,因此本研究采用布托啡诺与咪达唑仑麻醉前联用评估对小鼠异氟醚麻醉效果影响。
本研究结果表明,布托啡诺、咪达唑仑复合可以降低诱导时间,其原因推测可能是布托啡诺与咪达唑仑的协同作用从而降低了异氟醚的 MAC 值。研究结果观察组小鼠镇痛、镇静及肌松效果良好,且麻醉效果及麻醉深度达到外科手术要求。 同时也发现布托啡诺、咪达唑仑复合用药小鼠恢复时间延长,具体机制尚需进一步研究。
异氟醚主要通过其刺激性、降低局部或全身循环阻力及对交感神经、副交感神经的抑制等方面对循环系统产生一定的抑制作用,具体表现为心率增快、血压下降、血管扩张等,但异氟醚对心功能的抑制小于恩氟烷及氟烷。 以往研究表明[14-15],异氟醚单次麻醉比联合注射麻醉如戊巴比妥和氯胺酮导致心脏的影响更低。 异氟醚又具有较强的呼吸抑制,因此麻醉前给药主要目的是通过降低异氟醚的浓度来减轻呼吸抑制。 本研究观察了咪达唑仑和布托啡诺对心肺的影响。 结果表明,观察组小鼠麻醉期间心率均略有变化,而对照组小鼠心率变化波动较大,两组小鼠的心率变异系数也存在显著差异,也即观察组小鼠麻醉期间循环系统指标更稳定,因此咪达唑仑和布托啡诺联合麻醉方案对心血管影响更小。 与观察组应用的平衡麻醉相比,单纯异氟醚麻醉组小鼠麻醉期间呼吸速率的不稳定性更明显。 此外,在整个麻醉期间,观察组小鼠SpO2没有明显减少,而异氟醚单独麻醉SpO2持续降低,并且观察组显著高于对照组。 SpO2在观察组的平衡麻醉中的稳定可能与异氟醚浓度的降低有关,从而导致麻醉期间潮气量增加。
麻醉会引起机体应激反应,引起心率增加、血压升高和激素、血糖含量升高等。 本研究结果中观察组小鼠Cor、Glu 水平低于对照组,表明咪达唑仑+布托啡诺能降低小鼠麻醉中应激反应。 本次研究结果也提示与异氟醚单麻相比,观察组小鼠麻醉减少了低血压、尿失禁等不良事件的发生[16-18],缩短诱导时间,这可能与咪唑安定在诱导期间的镇静性能有关。
综上所述,咪达唑仑和布托啡诺联合麻醉前用药对可减少异氟醚用药,有效抑制异氟醚诱导的小鼠呼吸抑制,且诱导平稳,不良反应发生率低。

