锂离子电池浓差极化及放电特性分析
刘 良, 戴 玮, 王丽梅, 王亢亢
(1. 江苏大学 汽车与交通工程学院, 江苏 镇江 212013; 2. 江苏大学 汽车工程研究院, 江苏 镇江 212013)
近年来,锂离子电池以其比能量高和循环寿命长等优点在新能源汽车领域得到了广泛应用.锂离子电池的放电电压-容量特性是电池电化学特性的关键指标,而影响电池电压-容量的主要因素是电池极化.电池极化是电池端电压在电流作用下偏离其平衡电极电势的现象[1].由于电池的极化特性通过试验测试比较困难,许多学者基于电极动力学理论和电池模型对电池放电过程中产生的各种极化现象进行仿真研究.杨帆等[2]针对LiMn2O4/C锂离子电池建立仿真模型,研究了不同充电模式下的极化特性,结果表明极化电压与充电电流和SOC(state of charge)相关.J. H. KIM等[3]根据电池的阻抗特性建立等效电路模型,系统分析了不同充放电方式和荷电量对极化电压的影响规律.这些研究主要从外部条件出发对电池极化进行研究,但没有涉及电池内部因素对极化的影响.
李书国等[4]基于电化学-热耦合模型,分析了在不同放电倍率下LiFePO4/C电池的浓差极化和活化极化,结果表明:初始放电时正极的固相浓差极化变化明显,粒径是影响活化极化的一个主要因素.张凯等[5]建立锂离子电池的准二维模型探讨了同时改变LiMn2O4/C电池的电极厚度、固相粒径对浓差极化的影响,结果表明:同时增加正负极粒径或正负极厚度会增加固、液相极化.CHEN Y.等[6]研究了活性物质粒径、电解质盐浓度及环境温度对极化的影响,结果表明电池电压与电池的物理化学参数密切相关.上述研究对电池极化研究具有指导意义,但尚未深入定量化分析正、负极粒径或电极厚度对固相或液相浓差极化的影响过程和作用机制,也未能进一步阐释其主要因素对电池放电性能的外在表现.
笔者以三元锂离子电池为研究对象,基于COMSOL仿真平台,依据试验获取电池参数,建立电化学模型并验证其准确性,基于模型开展电池放电过程中固、液相浓差极化特性及其主要影响因素对电池放电性能影响的仿真研究,获得影响浓差极化和放电性能的关键因素.
1 电池试验
1.1 电池及试验设备
选取天津某公司生产的圆柱形锂离子进行相关试验,电池的相关参数如下:电池类型为三元能量型(NCA/石墨),电池型号为26800,标称电压为3.6 V,标称容量为6.6 A·h,充放电电压范围为3.0~4.2 V.试验主要包括参考电位试验和充放电试验,电池测试系统可实现电池电压、电流及温度的监测,测试设备如图1所示.

图1 电池测试系统
1.2 电化学特性试验
正负电极参考电位是电池模型的重要参数之一,分别以正、负极粉末为原料制作极片,并组装成多组半电池,以0.02 C倍率电流进行充放电测试,将其工作电压近似于参考电位[7],经测试和数据对比筛选,获得正负极材料的参考电位如图2所示.
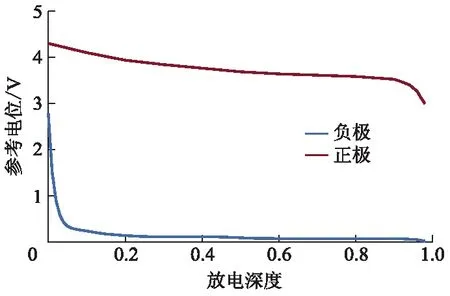
图2 正负极参考电位曲线
为了获得电池的放电特性,对电池进行不同倍率的恒流放电试验,测试结果如图3所示,随着放电倍率增加,大电流导致电池内部欧姆阻抗产生的电压降增大,使得电池初始工作电压及放电平台明显下降.
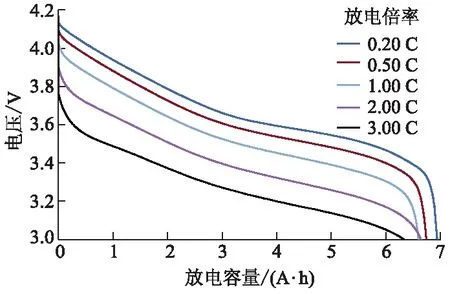
图3 不同放电倍率下的放电曲线
2 电化学建模与验证
2.1 电化学建模
锂离子电池内部的电化学动态过程包括锂离子的扩散与迁移、固-液相交界面的电化学反应,基于多孔电极理论的锂离子电池电化学模型将根据本过程建立,同时遵循物质守恒、能量守恒及电荷守恒定律等基本定律.电化学模型的控制方程及边界条件如下.
固液相交界处的反应(Bulter-Volmer动力学)方程为
(1)
边界条件为
(2)
式中:jLi为电极表面局部电流密度;av为活性比表面积;j0为交换电流密度;αa、αc为电荷传递系数;F为法拉第常数;R为摩尔气体常数;T为温度;η为电极过电位;φs为固相电势;φe为液相电势;U为平衡电位;Rsei为SEI膜内阻;k为反应速率系数;ce为液相锂离子浓度;csmax为嵌入固相最大锂离子浓度;cse为固-液相交界处锂离子浓度;Uref为常温下的参考电位;Tref为参考温度;φs为固相体积分数;rs为球型颗粒半径.
固相物质守恒方程为
(3)
边界条件为
(4)
式中:cs为固相锂离子浓度;Ds为固相锂离子扩散系数;r为球形颗粒径向;t为时间.
液相物质守恒方程为
(5)
边界条件为
(6)
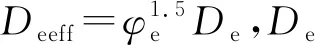
固相电荷守恒方程为
(7)
边界条件为
(8)
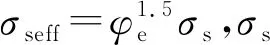
液相电荷守恒方程为
(9)
边界条件为
(10)
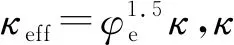
电池的部分特性参数参考文献[8-9],具体参数及取值如表1所示,δ为厚度,cs0、ce0分别为固相和液相的初始浓度.
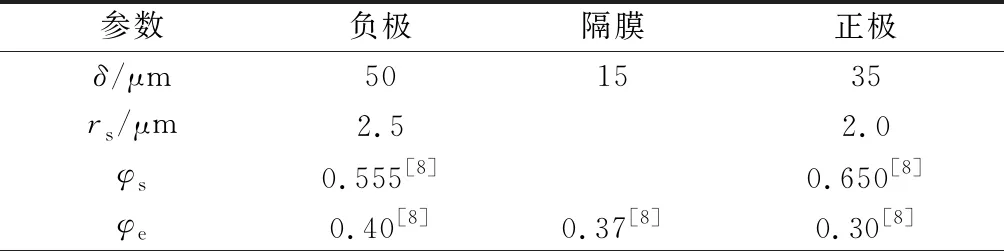
表1 电化学模型参数表
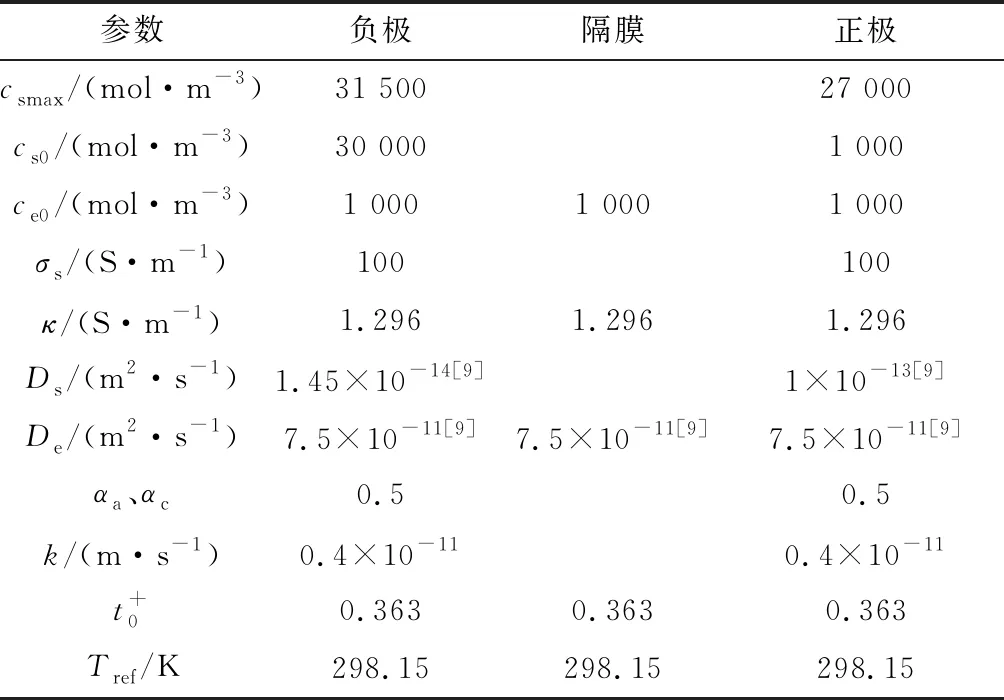
续表
2.2 恒流工况模型验证
常用充放电方式包括恒流和脉冲,不同充放电方式对电池极化特性影响不同.极化电压随恒流放电倍率的增大而快速增大,极化效应更明显[3].因此,将恒流工况下的试验放电曲线与仿真放电曲线进行对比,计算两者的相对误差,对构建模型的精确性和可靠性进行量化分析.电池在25 ℃时不同放电倍率下容量-电压试验和仿真曲线如图4所示.
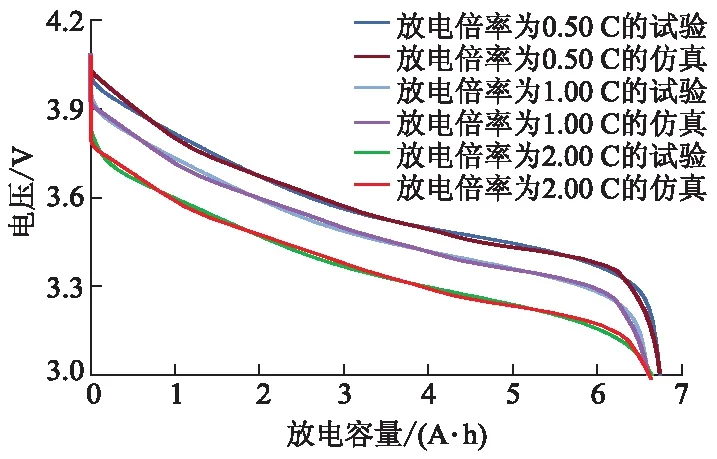
图4 25 ℃时不同放电倍率下容量-电压试验和仿真曲线
从图4可以看出:当电池放电倍率分别为0.50、1.00及2.00 C时,试验与仿真放电曲线最大相对误差分别为0.85%、1.12%和1.37%,在不同倍率下放电试验曲线与仿真曲线重合度均较好,构建的电化学模型精度较高.
3 结果与讨论
3.1 固-液相锂离子浓度分布特性
3.1.1锂离子在固相中的分布特性
为了研究锂离子在固相中的传输特性,以单层电池为研究对象,对锂离子在固相球形颗粒中心和表面的浓度分布趋势进行仿真.在放电时间分别为0、600、1 200、1 800 s,放电倍率为2.00 C时固相锂离子浓度变化曲线如图5所示.
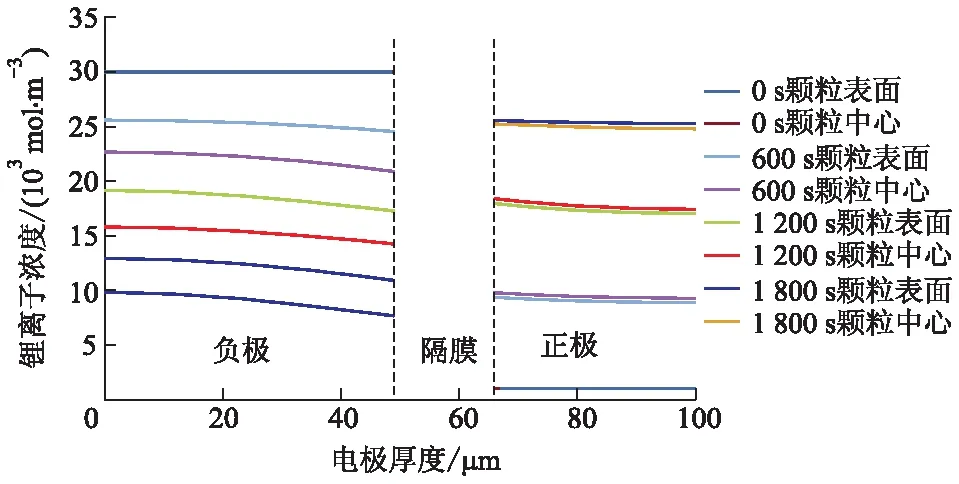
图5 放电倍率为2.00 C的固相锂离子浓度变化曲线
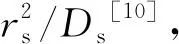
由固相方程式(3)可知,当固相扩散系数Ds不变时,粒子半径是引起固相锂离子浓度分布差异的重要因素.不同正、负极球形粒径下电池经2.00 C倍率放电结束时正负极固相颗粒中心和表面锂离子浓度变化分别如图6a、b所示.由不同电极颗粒半径引起的正、负极固相锂离子浓度差及平均浓度水平如表2所示,其中:Rpos为正极球形颗粒粒径;Rneg负极球形颗粒粒径.
从图6a和表2可以看出:当增大正极颗粒半径时,正极固相颗粒表面与中心锂离子浓度差逐渐增大,负极固相颗粒表面和中心锂离子浓差变化不大.经计算,正极粒径分别变化为初始模型的1/2和2倍时,正极固相颗粒锂离子浓差分别变为初始模型的26.85%和189.75%,说明减小正极粒径能够显著降低正极固相浓差极化.其原因是固相粒径变小会增大颗粒的比表面积,使得锂离子嵌入的入口增多.当放电电流密度不变时,单位面积需要通过的锂离子数目减小,从而降低了固相浓差极化.此外发现,负极固相平均锂离子浓度水平在上升,而正极固相平均锂离子浓度分布区间降低.这是由于正极粒径增大时,正极固相活性粒子数目减少,从而能够储存锂离子数目降低,所以残留在负极固相中的平均锂离子浓度较高.
从图6b和表2可以看出:当负极颗粒半径增大时,负极固相颗粒中心和表面的锂离子浓度差异明显变大,而正极颗粒中心和表面锂离子浓度差异几乎保持不变.经计算,当负极颗粒粒径减小1/2时,负极颗粒中心与表面锂离子浓差减小为原来的22.21%;当负极颗粒粒径增大到2倍时,平均锂离子浓差增加为原来的243.75%,表明增大负极颗粒半径会增加负极的固相浓差极化.此外发现,负极固相平均锂离子浓度水平在下降,而正极固相平均锂离子浓度水平在上升.这是由于负极粒径在一定范围内增大有利于锂离子脱出,到达终止电压时残留在负极颗粒内部的锂离子很少,相应嵌入正极的锂离子数目上升[11].相比于正极粒径对正极固相浓差极化的影响,在相同比例范围内变化,负极固相浓差极化的变化幅度是正极的136.05%,表明改变负极粒径使固相浓差极化更加严重.
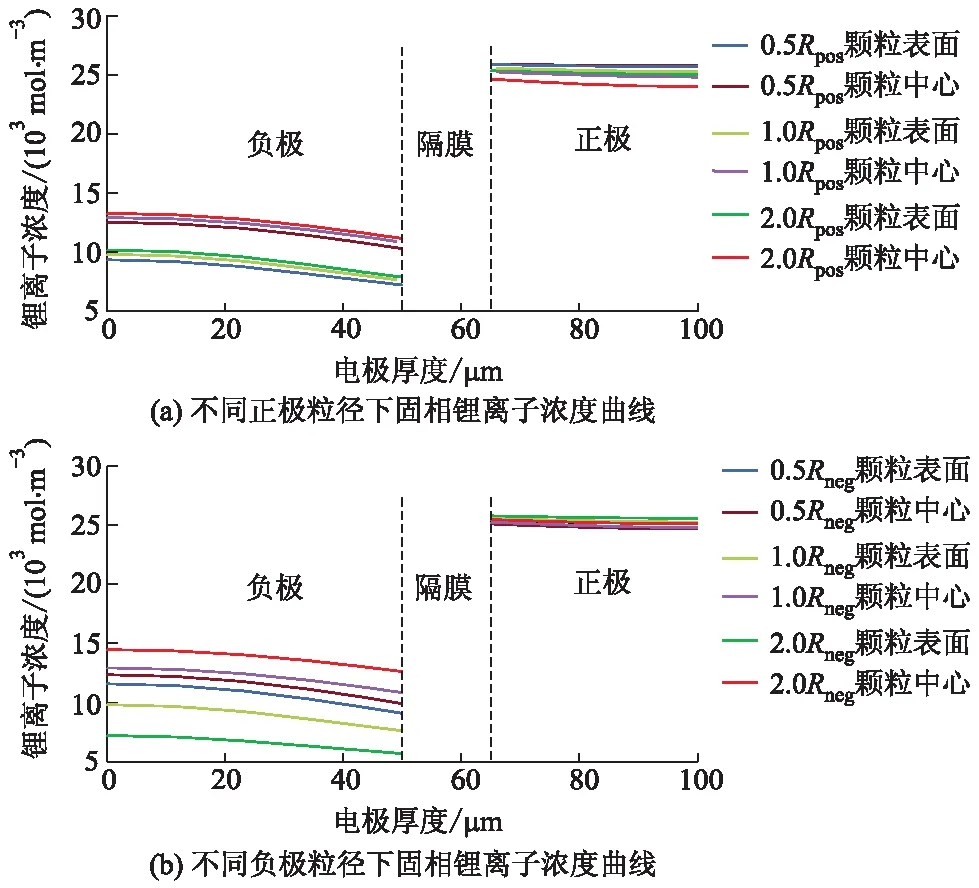
图6 不同正、负极球形粒径下2.00 C倍率 放电结束时固相锂离子浓度曲线
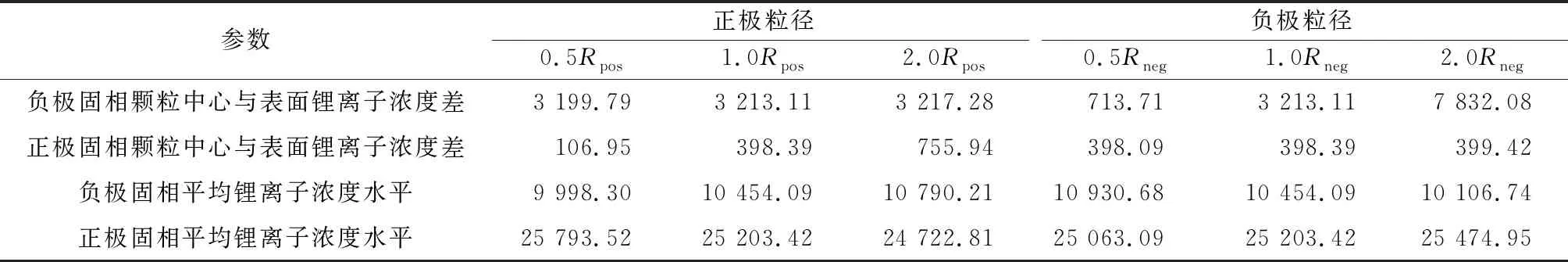
表2 不同颗粒半径引起的正、负极固相锂离子浓度差及平均浓度水平 mol·m-3
3.1.2锂离子在液相中的分布特性
电解液是锂离子在电池中传输的另一重要载体.因此,有必要研究锂离子在液相中的传输规律.电池以2.00 C倍率进行放电时,不同放电时刻电池内部的锂离子浓度变化曲线如图7所示.
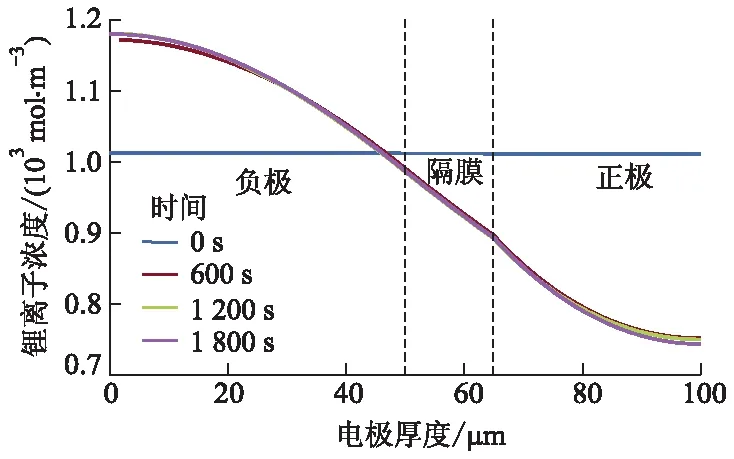
图7 不同放电时刻下2.00 C倍率放电时的 液相锂离子浓度的变化曲线
结合图5,从图7可以看出:随着电池放电的进行,液相锂离子浓度从负极区域到正极区域均呈下降趋势,这是由于在电池放电过程中负极区域发生脱锂反应,脱出的锂离子进入液相,导致负极液相锂离子浓度升高;相反,在正极区域锂离子发生嵌入活性颗粒反应,导致正极区域液相锂离子浓度降低.
由式(5)可知,电极厚度对液相锂离子浓度分布产生重要影响,因此有必要基于模型进行研究.由于电极活性物质含量与电极厚度密切相关,在研究不同电极厚度时,为了保证电池以相同的倍率放电,对放电电流密度进行相应调整.
不同正、负极厚度下电池经2.00 C倍率放电结束时液相锂离子浓度变化分别如图8a、b所,增加正、负极厚度都会增加正负极液相锂离子浓度差.
由不同电极厚度引起的正、负极液相锂离子浓度差如表3所示,当初始正极厚度上下变化20 μm时,正负极最大液相锂离子浓差分别变为初始的34.40%和164.51%;当初始负极厚度上下变化20 μm时,正、负极最大液相锂离子浓差分别变为初始的54.94%和120.32%.由此可以发现,当正、负极厚度分别减小或增加同一大小时,负极厚度引起的液相锂离子浓差幅度不及正极厚度引起的,仅占50.25%.说明相比于改变负极厚度,改变正极厚度更易加剧正负极液相浓差极化.
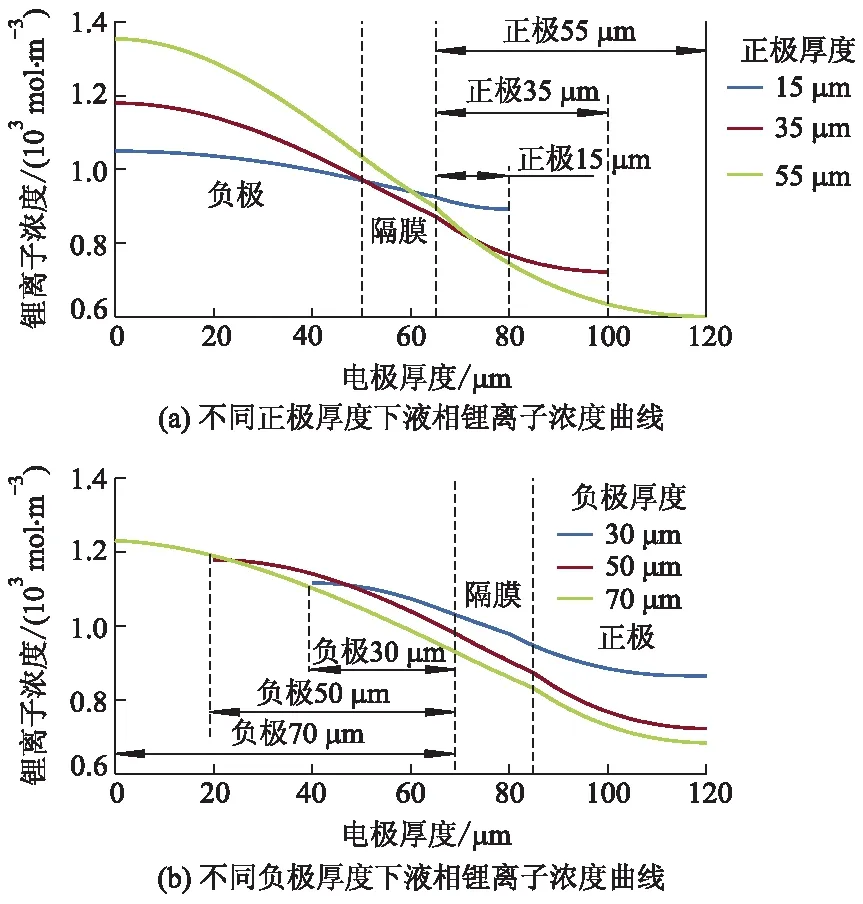
图8 不同正、负极厚度下2.00 C倍率放电 结束时液相锂离子浓度的变化曲线

表3 不同电极厚度引起的正、负极液相锂离子浓度差 mol·m-3
3.2 电池放电特性
负极粒径与正极厚度作为主要因素,分别对电池固、液相浓差极化产生重要影响,进一步研究这2个主要因素对电池外部放电性能的影响以指导电池的工业设计.不同负极粒径和不同正极厚度下2.00 C倍率放电曲线如图9所示.
从图9a可以看出:当负极颗粒半径从1.25 μm逐渐增加到5.00 μm时,电池的电压平台稍有下降而容量并没有发生改变.这主要是由于当负极粒径增大,比表面积变小,从而锂离子的扩散速率降低导致电池内阻增大,故电压减小.然而,改变负极粒径却并不影响参与反应的锂离子总数目,所以电池的容量几乎不发生变化.
从图9b可以看出:正极厚度增加时,电池的电压平台显著升高,且放电容量更大;正极材料厚度以20 μm的增量增加时,放电截止容量增量分别为3.81、2.18、0.11 A·h.这表明电池放电容量受正极厚度影响较大,正极厚度增大,电池容量增加,但增加幅度不断降低,其影响程度在逐渐减小.分析认为当正极厚度较小时,正极材料容量不足,不能完全储存大量锂离子,电池容量由正极材料决定.随着正极厚度增加,电池容量逐渐增加并趋于饱和,此时电池的容量由负极材料决定.综上可知,电池正极厚度对电池电化学性能影响较为显著.
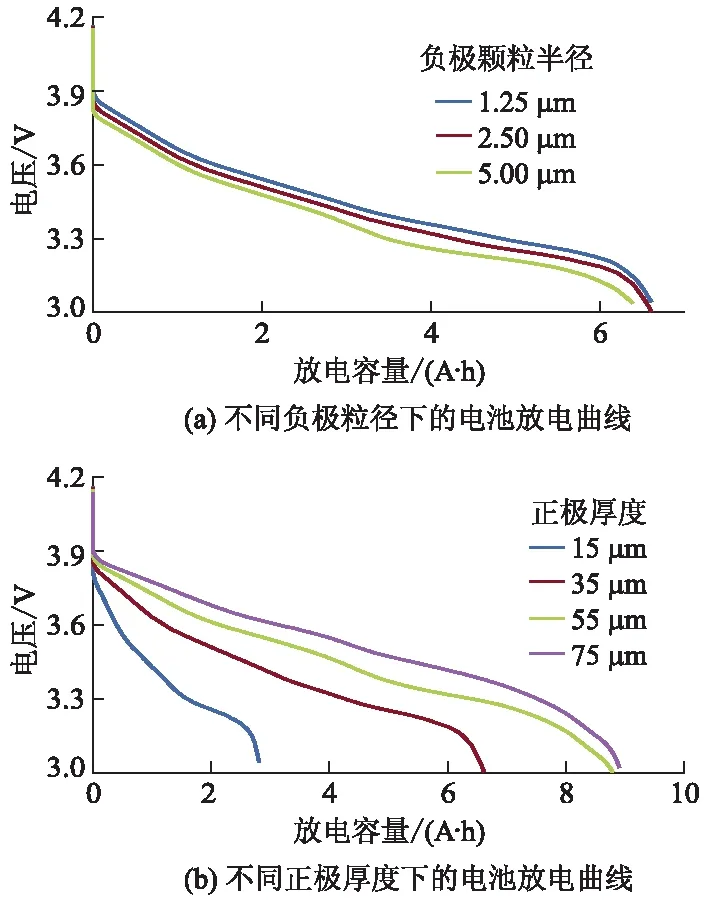
图9 不同负极粒径和不同正极厚度下 2.00 C倍率电池放电曲线
4 结 论
1) 单独增大正、负极粒径会分别加重正、负极固相锂离子浓差极化;相比于正极粒径对正极固相浓差极化的影响,负极粒径的变化对负极固相浓差极化的影响更加显著,约是前者变化幅度的136.05%.增加正、负极厚度均会加重液相浓差极化,其中相对于负极,改变正极厚度更容易加剧液相浓差极化,等量变化范围内正极引起的液相浓差变化幅度约为负极的199.01%.
2) 正极厚度和负极粒径是影响电池浓差极化的2个主要因素,增加正极厚度会显著提高电压平台并增大电池容量;增大负极粒径会稍微降低电池的电压平台而对容量几乎无影响.两者相比,正极厚度是同时影响电池极化和放电性能的关键因素,需要进行合理设计.

