miRNA-自噬轴在运动性心肌肥大中的作用机制
张 钧
心肌组织包括心肌细胞和间质两部分,心肌细胞是高度分化的终末细胞,其收缩蛋白以α- 肌球蛋白为主,一般不能增殖,只有细胞体积的肥大。心肌细胞能够对外界刺激做出适应性反应,如不同程度或形式的损伤、应激,或由长期运动训练、怀孕、机体自然生长等引起的生理性血流超负荷刺激,都会使心脏产生肥厚性的增长,此时其表型改变,体积增大[1-2]。一直以来,运动性心肌肥大被认为是一种生理性结构肥大,是长期的运动训练导致机体在代谢方面发生的变化,表现为促进心肌细胞增殖与肥大、抑制心肌间质纤维化、心肌血管再生等一系列的变化,心脏产生适应性增大。其不仅能促进心脏功能的提高,而且有利于心脏健康。但由于运动性心肌肥大发生、发展过程具有复杂性,因此迄今为止,其具体的机制尚未被完全阐明。随着分子生物学技术的发展,学者们在该领域的相关研究不断深入,研究认为:运动性心肌肥大的发生已不仅仅是血流动力学作用下所引起的心肌细胞结构与大小的改变,神经体液因素也能够通过各种信号转导,调节应答基因转录,促进心肌细胞的翻译、合成,而形成心肌肥厚。当前,关于运动性心肌肥大的研究,在基因层面和信号传导通路方面已取得了许多重要进展。已有研究表明,细胞自噬是基于溶酶体的一种胞内降解途径,对维持细胞和生物体的稳态平衡有重要作用,参与了运动性心肌肥大的调控过程。微小RNA(miRNA)作为一种非编码的单链RNA 分子,通过影响mRNA 和蛋白质来调控基因的表达,miRNA 与运动性心肌肥大之间存在着联系,目前miRNA 在调控运动性心肌肥大的心肌细胞基因转录后的表达有了一些研究进展。本文从细胞自噬和miRNA 入手,阐述细胞自噬和miRNA 在运动性心肌肥大形成中的作用及可能分子机制。
1 细胞自噬参与调控运动心肌肥大
细胞自噬(autophagy),是机体普遍存在的一种重要的代谢途径,可降解衰老心肌细胞中折叠异常的蛋白质和受损的细胞器[3]。根据哺乳动物中细胞内容物转移至溶酶体内的不同途径,细胞自噬可分为3 种类型:(1)巨自噬(macroautophagy),即细胞胞浆中的可溶性蛋白质和变性坏死的细胞器被非溶酶体来源的双层膜(多数人认为是内质网膜)结构所包裹,即形成自噬体,自噬体再将其携带到溶酶体中进行降解加工;(2) 微自噬(microautophagy),即细胞溶酶体膜直接包裹长寿命蛋白质并在溶酶体内降解;(3)分子伴侣介导的自噬(Chaperone-Mediated Autophagy,CMA),此 途 径 形成的自噬仅存在于哺乳动物细胞中,细胞胞浆中的分子伴侣,如热休克蛋白70(Heat Shock Cognate Protein of 70kd,HSC70) 在识别底物蛋白质分子的特定氨基酸序列(如KFERQ 样模体)后与之结合,而后分子伴侣-底物复合物再与溶酶体膜上受体(Lysosome Associated Membrane Protein Type2,LAMP2)结合,底物去折叠,溶酶体腔中的另外一种分子伴侣介导底物在溶酶体膜转位,进入溶酶体腔的底物被水解酶分解为其组成成分后被细胞再利用。由于分子伴侣介导的自噬,其底物是可溶的蛋白质分子,因此这种类型的自噬在清除受损或异常折叠的蛋白质时具有选择性。在哺乳动物心肌细胞中最常见的是巨自噬,心肌细胞自噬的整个过程一般可分为自噬诱导、自噬体形成、自噬溶酶体形成、内容物降解4 个阶段(图1)[3]。即细胞质中的线粒体等细胞器首先被称为“隔离膜”的囊泡所包被,囊泡最终形成双层膜结构,即自吞噬体(autophagosome);自吞噬体与胞内体融合形成中间 自 体 吞 噬 泡 (Intermediate Autophagic Vacuoles,AVi/d);最终自体吞噬泡的外膜与溶酶体融合形成降解自体吞噬泡 (Degrading Autophagic Vacuoles,AVd),由溶酶体内的酶降解自体吞噬泡中的内容物和内膜。

图1 自噬发生过程的不同阶段示意图[3]Figure1 Schematic Diagram of Autophagy at Different Stages[3]
在正常状态下,由于要保持细胞内环境稳定性,细胞会处于低水平的自噬状态,即基础自噬,但当细胞受到外界的刺激时,自噬水平会发生改变,如饥饿、长期有氧运动、胰高血糖素等因素均可提高细胞自噬水平。近来研究表明,自噬水平的变化参与调控心肌细胞能量代谢、 心肌蛋白质合成及心肌细胞增殖等生理过程[4]。Nakai 等[5]在Atg5-/-基因敲除及沉默Atg7 基因后发现,小鼠心肌泛素化蛋白聚积,心肌细胞凋亡现象增加,自噬活性均明显降低,心肌肥大产生。由此可见,自噬异常所导致的心肌蛋白质过度聚积,可能是引起心肌肥大的重要原因。
运动作为一种机械性刺激,能够增强心肌细胞的自噬水平。动物实验研究表明,多种模式(自由转轮、跑台、游泳等)的运动均能上调心肌细胞的自噬活性[6],这对维持运动过程中心脏在能量方面的需求,以及维持心脏正常的生理功能具有积极意义。由此可见,自噬在运动诱导的生理性心肌肥大中也具有重要作用。已有研究证实,自噬一方面能通过自噬-溶酶体(ALP)途径清除长期运动刺激下心肌受损的细胞器及代谢产物(如自由基)[7],将其转换成能源物质,维持心肌细胞能量代谢平衡,保证心肌蛋白的质量;另一方面,可特异性地降解心肌合成过多的蛋白,有效控制心肌发生过度肥厚[8],这在预防心肌生理性肥大向病理性肥大的转变中具有重要意义。Willis 等[8]通过5 周运动干预后,发现CHIP-/-小鼠由于自噬通路的代偿激活,及时清除了心肌细胞中异常折叠、 衰老的蛋白质,以及受损的心肌细胞器,保证了心肌的蛋白质量,从而在抑制小鼠心肌纤维化的进程中起到重要作用,提示心肌细胞自噬在调控心肌蛋白质质量控制,以及在保持心肌细胞正常的生理功能方面作用显著。目前已有研究证明,通过10 周游泳运动使大鼠形成运动性心肌肥大,并观察到运动性心肌肥大模型组大鼠心肌自噬小体显著增加,自噬标记蛋白LC3B、Beclin1 表达水平和自噬相 关 基 因 (Autophagy-Related Gene,Atg)Atg4B、Atg5、Atg7、Atg12、ULK1 在基因和蛋白方面的表达水平均显著增加,而自噬受损蛋白SQSTM1 的表达明显下调[9]。还有研究表明,大鼠在长期耐力训练后,心肌细胞微管相关蛋白轻链3B(Microtubule-Associated Protein Light Chain 3,LC3B)和Beclin1 均显著上调[10];此外,有研究发现,运动引起自噬活性的增加主要与运动显著上调腺苷酸活化蛋白激酶(Adenosine Monophosphate Activated Protein Kinase,AMPK)的表达水平有关,运动可引起心肌细胞内单磷酸腺苷/ 腺嘌呤核苷三磷酸(Adenosine Monophosphate/5'-Adenylate Triphosphate,AMP/ATP) 上调,从而提高AMPK 活性。研究发现,AMPK 可通过直接影响雷帕霉素靶向蛋白 (Mammalian Target Of Rapamyoin,mTOR)的活化水平[11],引起心肌自噬水平的上调;AMPK 还可通过提高p27 蛋白的活性、活化真核细胞延伸因子-2(Eukaryotic Elongation Factor 2,eEF2)促进自噬形成[12-13]。以上研究结果说明,心肌细胞自噬水平的上调参与了运动性心肌肥大的形成,但其具体是通过何种作用机制实现对运动性心肌肥大的调控,还有待通过实验进一步系统地进行验证。
2 miRNA 介导运动性心肌肥大形成

图2 MicroRNA 的生物发生及其作用方式[14]Figure2 Biogenesis of MicroRNA and Its Mode of Action[14]
miRNA 是一类大小约为22 nt 的单链小分子RNA,是由具有发夹结构的约70~90 个碱基大小的单链RNA 前体经过Dicer 酶加工后生成,它们通过与靶基因3'- 端UTR 碱基完全或不完全互补的方式,影响mRNA 的存在时间或翻译过程,从而发挥对基因表达的调控作用(图2)[14]。miRNAs 在心肌细胞肥大、心脏发育、心肌间质重塑和心肌功能变化等方面具有重要的调节作用[10,15],其涉及的信号通路参与了心肌肥厚的发生,如MAPK、PI3K-AKT、JAK 等信号通路。miRNAs 一直以来被作为参与调节复杂的病理性心肌肥大的重要因素,而受到广泛研究。关于miRNAs 在运动诱导的生理性心肌肥大中扮演的角色及作用,相关文献报道尚不多见。近年来的研究发现,miRNAs 也参与调节运动性心肌肥大。运动能够调节心肌多个miRNAs 的表达,这为运动性心肌肥大相关机制的研究提供了新的视野。
miRNAs 与运动的关系已成为当前运动科学相关研究领域的关注点。此前,多名学者已通过在体实验证实心脏、 骨骼肌以及循环中的miRNAs 变化参与了运动诱导的机体适应性[15-16]。近年来国内外的研究表明,miRNAs 在运动性心肌肥大形成中也扮演了重要的角色,并通过调控其靶基因及相关信号通路对心肌肥大产生显著的影响。有研究发现,在不同的游泳训练所诱导的左心室肥大 (Left Ventricular Hypertrophy,LVH) 动物模型中,大鼠左心室miR-27a、miR-27b 均发生显著上调,miR-143 呈现显著下调[17]。该实验通过基因芯片技术对比了大鼠运动性心肌肥大模型和正常大鼠心肌细胞的miRNAs 后发现,运动性心肌肥大的心肌中miRNAs 存在显著差异,研究表明,运动性心肌肥大模型组大鼠心肌miR-124 显著 下 调,miR-21、miR-144 和miR-145 表 达 水 平 呈 显著上调。进一步的研究证实,上述差异表达的miRNAs(miR-124、miR-21、miR-144 和miR-145)可 能 分别通过靶向其下游靶基因PIK3α(miR-21)、PTEN(miR-144 和miR-21)和TSC2(miR-145)激 活PI3K/AKT/mTOR 信号,从而介导运动性心肌肥大的形成[18];Palabiyik 等[19]也发现运动训练后心肌中miR-21 和miR-133 的表达改变是通过激活PI3K/AKT/mTOR 而发挥作用的。Qi 等[20]在运动诱导的左心室肥厚大鼠模型中使用高通量miRNA 芯片技术筛选了具有表达差异的miRNAs。结果显示,在运动性诱导的生理性肥大心肌中,有216 个miRNAs 发生显著变化(其中77个miRNAs 显著上调,139 个miRNAs 显著下调),并通过信号通路富集,发现MAPK、自噬等信号通路在运动性心肌肥大的形成和发展中发挥了重要的作用。目前也有一些学者通过动物实验,先后验证了miRNAs 在运动性心肌肥大中的作用[21-25]。此外,有研究发现,循环血中的miRNA 表达水平与运动性心肌肥大密切相关,从事耐力项目的运动员在长期运动训练后血液循环中miR-21 的表达显著增加[26-28]。Mooren等[29]通过研究发现,马拉松运动员在运动后即刻所测得的血液中,多个miRNAs(miR-1、miR-133、miR-206、miR-208b 和miR-499)表达水平均出现显著上调。进一步的研究发现,miR-1 与左心室射血分数(EF%)呈现显著负相关,miR-133a 与室间隔的厚度呈现显著的正相关关系。以上结果提示,miR-1 和miR-133a 可能是运动性心肌肥大(即运动员心脏)发生的潜在生物学标记。血液中miR-126 对维持血管完整度、促进血管再生和增进心脏健康等方面作用显著。Schmitz 等[30]以30 名男运动员和31 名女运动员为研究对象,进行4 周低强度运动和高强度运动训练,检测了运动员血液中miR-126 的表达水平,研究发现,这两种运动方式对miRNA 的影响存在差异,参与低强度运动训练的队员血液中miR-126 的表达增加,而高强度运动训练未显著影响运动员血液中的miR-126 表达水平。说明miRNA 的表达对运动强度具有一定的敏感性。因此,循环miRNA 在运动性心肌肥大及增强心脏功能等方面具有潜在的应用价值。以上研究结果提示,在运动性心肌肥大发生、发展的过程中miRNAs 的表达水平变化具有重要的调控作用; 此外,miRNAs 还可作为运动性心肌肥大形成的生物学标志物。但明晰miRNAs 在运动性心肌肥大形成中的具体作用及机制,仍需对其功能进行研究验证。
3 miRNA-自噬轴在运动性心肌肥大发生中的作用
细胞自噬对细胞内能量变化、 氧化应激等信号较为敏感,对于维持内环境平衡是不可或缺的。研究表明,自噬过程需要非常精准的调控,miRNAs 在多个组织中对细胞自噬的调控起着关键作用[31-35]。miRNA 通过与目标mRNA 的3'- 端UTR 互补匹配,使目标mRNA 降解,继而抑制蛋白翻译[36-38]。研究发现,在自噬的诱导阶段,哺乳动物细胞内由ULK1 同系物Atg13 和ULK2 同系物Atg1 和Atg17 组成的ULK 复合体介导了自噬的诱导过程,而mTOR 激酶作为自噬的“门控开关”[39],被认为是调控自噬诱导发生阶段的重要激酶。据已有文献报道,miRNAs 实现对自噬的调控是通过作用于不同的自噬相关基因:如Beclin1 是miR-30a 的靶基因[40],Atg5 是miR-181a 的 靶基因[41],miR-204 可直接下调LC3B 的表达,抑制自噬的发生[42]。此外,还存在一些潜在的与自噬-溶酶体通路有关的功能性调节miRNAs,包括miR-130、miR-124、miR-204 和miR-142,LAMP1/2、v-SNARE 蛋白和囊泡相关膜蛋白7(Vesicle-Associated Membrane Protein 7,VSMP7) 等可能是这些miRNAs 的靶标基因[43]。目前,在运动性心肌肥大中,已有学者通过在体实验证明了自噬信号途径在运动性心肌肥大形成中的作用,并且在体外细胞实验中阐明了miR-204-5p、miR-497-3p 和miR-26b 分别通过靶向LC3B、Beclin1和ULK1 在运动性心肌肥大中发挥的作用[20]。由此可见,心肌细胞自噬参与了运动性心肌肥大的形成过程,其作用机制之一是通过miRNAs 对自噬相关基因的靶向调控作用实现。然而,关于miRNAs 之间是否还可能存在交互影响,通过协同作用进一步在运动性心肌肥大中调控自噬水平,目前鲜有报道。
由此可见,在运动性心肌肥大中,细胞自噬和miRNAs 在不同的层面发挥重要的调控作用,且二者在调控运动性心肌肥大形成的过程中存在着内在的联系。长期以来,关于运动增强心肌保护效应、促进心脏健康的生物学机制已开展了深入的研究。值得注意的是,在运动对心血管健康促进效应的众多研究中,运动强度一直是备受关注的问题[44]。有学者提出运动对心脏的健康是把“双刃剑”[45-46]。长期规律的有氧运动能够有效降低心血管疾病的发病率,减轻其症状,对其具有良好的预防和治疗作用。在运动对心血管健康的相关研究中,已有新的研究数据表明,运动强度和不良心血管事件之间呈U 型关系,适度运动要显著优于不运动,但剧烈运动对一些人群反而可能起到副作用(图3)[47-48]。英国体育运动科学协会(British Association of Sports and Exercise Science,BASES) 和美国卫生与公众服务部 (Department of Health and Human Services,DHHS)建议,健康成年人每周应进行150 min 的中等强度(相当于3~6 METS)或75 min的大强度有氧运动锻炼,而竞技运动员每周要进行超过20 h 的高强度运动(超过15 METS)。如此高强度的运动需要在长时间内,心输出量持续增加5~7 倍。长期从事大强度运动训练,运动员迷走神经紧张度显著增高,心脏冲动的起源与传导随之发生一系列的生理改变[47]。但当这些改变超出一定的范围时,会导致心律失常(以阵发性心动过速、房室传导阻滞、束支传导阻滞、干扰性房室脱节、期前收缩、游走性心律等为特征)、心肌纤维化及一些未能被及时发现的潜在心血管风险因素的出现[49-52]。已有相关研究表明,当心律失常、心力衰竭等病理性现象出现时,心肌细胞自噬水平呈显著增强的趋势。这是因为自噬是通过适应性和非适应性的调节在心血管的健康适应中扮演着双重角色。一方面,细胞自噬既是一种广泛存在的正常生理过程,正常水平的自噬可以保护细胞免受环境刺激的影响,在保持正常心血管功能方面具有保护性机制作用;另一方面,其又是细胞对不良环境的一种防御机制,参与多种心脏疾病的病理发生、发展过程,自噬过度与自噬不足均会参与心脏相关疾病的形成,甚至推动疾病的发展。Garcia等[53]和Chen 等[54]在术后房颤患者的右心房取样发现自噬空泡的聚集和自噬标志物LC3 的表达减少,提示在术后房颤发生中心脏自噬水平下降,学者们认为术前自噬的增强很可能是在为心律失常的心脏提供能量的适应性保护,提示长期高强度的运动所导致的运动员心律失常、自噬水平提高,正是心肌适应性保护机制的体现。然而还有研究发现,适度的运动在缓解心律失常、 心力衰竭等病理性心脏疾病中能够通过调控自噬水平而实现对病理性心脏的有效干预治疗[8,55-56]。
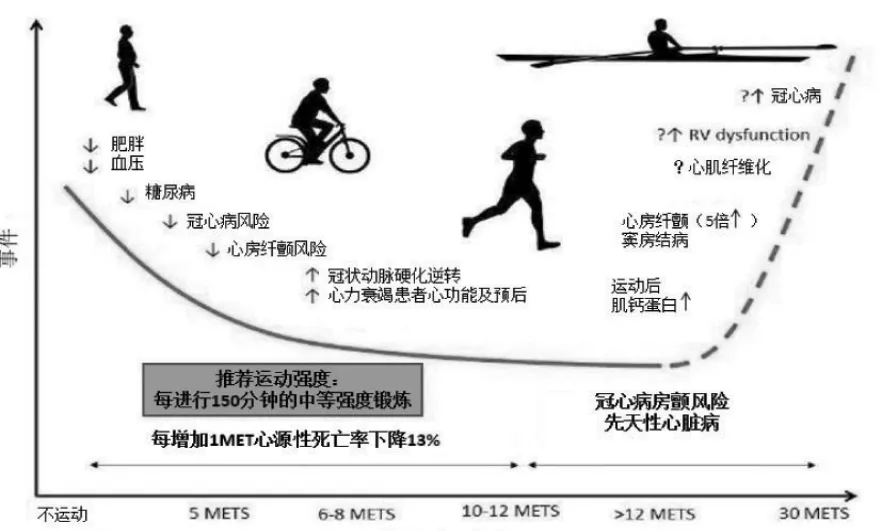
图3 运动促进心脏健康的效应[47]Figure3 Effect of Exercise on Heart Health[47]
综上所述,运动作为一种外源性刺激,心肌自噬水平的持续增强,可在预防运动诱导的生理性肥大向病理性肥大的转变中起到警示作用。此外,运动通过调节心肌miRNAs 的表达,激活与心肌蛋白合成相关的信号转导通路,使心肌产生适应性肥大,增强心功能。同时,miRNAs 还能够通过靶向作用于自噬相关基因而调控运动性心肌肥大。但目前在运动心肌肥大模型中尚未有关于miRNAs 的协同作用对心肌细胞自噬的影响,以及更为系统的关于心肌细胞自噬和miRNAs 的相互调节作用的报道,还有待进一步探究。总之,阐明心肌细胞自噬和miRNAs 的相互关系,及其在运动性心肌肥大中所具有的独特作用,可为进一步补充和完善运动性心肌肥大中自噬基因表达调控网络,以及完善运动诱导心肌肥大的分子调控理论提供依据。
4 研究展望
心肌细胞在受到工作负荷刺激后,其信号会翻译为促进细胞生长的电信号和(或)生化信号。关于运动性心肌肥大发生分子机制的研究,还有待进一步深入探讨,为更加完善运动性心肌肥大的理论基础提供依据。近年来的研究发现,效应器Yes 相关蛋白 (Yes Associated Protein,YAP)/ 具有PDZ 结合域的转录共刺激因子(Transcriptional Co-Activator with PDZ-Binding Motif,TAZ) 在促进心肌细胞增殖中发挥重要的作用[57],并且其对心肌具有一定的保护效应[58]。动物研究已经证明了YAP 活性的平衡在正常心脏形成中的意义,并且YAP 除了参与正常的心脏发育外,还能够调控成年心肌细胞的增殖[59]。因此在运动性心肌肥大中YAP/TAZ 的作用与机制值得探究。

