先天性膈疝产前程序化管理的临床结局
邹鹏建, 何秋明, 钟微, 吕俊健, 王哲, 林土连, 谢杰忠, 余家康, 夏慧敏
广州市妇女儿童医疗中心小儿外科(广东广州 510623)
先天性膈疝(congenital diaphragmatic hernia, CDH)是由于膈肌在胚胎早期发育缺陷而引起的腹腔内脏器疝入胸腔的一种先天性疾病,发病率为1∶2 000~1∶5 000[1]。40%~50%的CDH患儿合并了其他先天性异常[2-3]。肺发育不良和持续的肺动脉高压是引起死亡和残疾的最主要原因[4]。近年来,随着多学科管理,产前诊断和评估,围产期和生后处理等程序化治疗的不断进步,CDH的临床整体预后有所改善[5-6]。然而CDH仍有着较高病死率和致残率疾病,特别是在中重度患儿[7]。2016年3月至2018年5月在广州市妇女儿童医疗中心产前程序化管理下的CDH共计39例,效果满意,现报告如下。
1 资料与方法
1.1 一般资料 收集广州市妇女儿童医疗中心自2016年3月至2018年5月通过产前诊断为左侧膈疝患儿,回顾分析产前程序化管理下CDH的新生儿期临床结局。主要临床结局事件为新生儿期死亡和体外膜肺氧合(ECMO)使用情况。
1.2 产前程序化管理
1.2.1 多学科团队合作 多学科团队主要包括了影像科,新生儿外科,遗传学家,产科和新生儿科、麻醉科、心脏外科专家。为更好的进行胎儿膈疝管理,我科联合多学科团队制定了产前胎儿膈疝的程序化管理流程(图1)。管理流程图内容大体包含了产前诊断、产前评估和围产期处理三部分。
1.2.2 产前诊断 产前诊断主要依赖于超声,典型的超声诊断征象为腹腔内脏器,如肝脏、胃泡、肠管等出现在胸腔内。诊断为胎儿膈疝后,多学科程序化的管理首要进行严重的畸形及染色体/基因排查。超声主要用于检查心血管、泌尿系统等相关畸形,磁共振作为一种补充手段,用于对超声难以明确的畸形进行诊断和鉴别。染色体/基因异常借助妊娠中期羊水穿刺或基因芯片检测。严重畸形及染色体/基因的异常的膈疝胎儿,多学科团队将根据现有的研究数据对家长进行告知,并建议终止妊娠(termination of pregnancy,TOP)或根据家长意愿加强进一步监测。未合并严重畸形和染色体/基因异常的膈疝胎儿将进一步进行轻中重分级。
1.2.3 产前评估 产前肺发育不全的严重程度评估分为超声和MRI两个方面。重度胎儿膈疝为[8-11]:(1)超声评估:<29+5周且实测/预测肺面积-头围比值(o/eLHR)<25%。(2)MRI评估:>31+5周且实测/预测胎儿总肺容积(o/eTFLV)<25%。中度胎儿膈疝为:(1)超声评估:≤31+5周,o/eLHR为25%~34.9%。(2)超声评估:≤31+5周,o/eLHR为35%~44.9%且肝脏疝入。(3)磁共振评估:>31+5周且o/eTFLV为25%~35%。评估时间的设立与中重度胎儿国际随机试验“气管栓塞加速肺生长”试验(www.totaltrial.eu)是一致的。
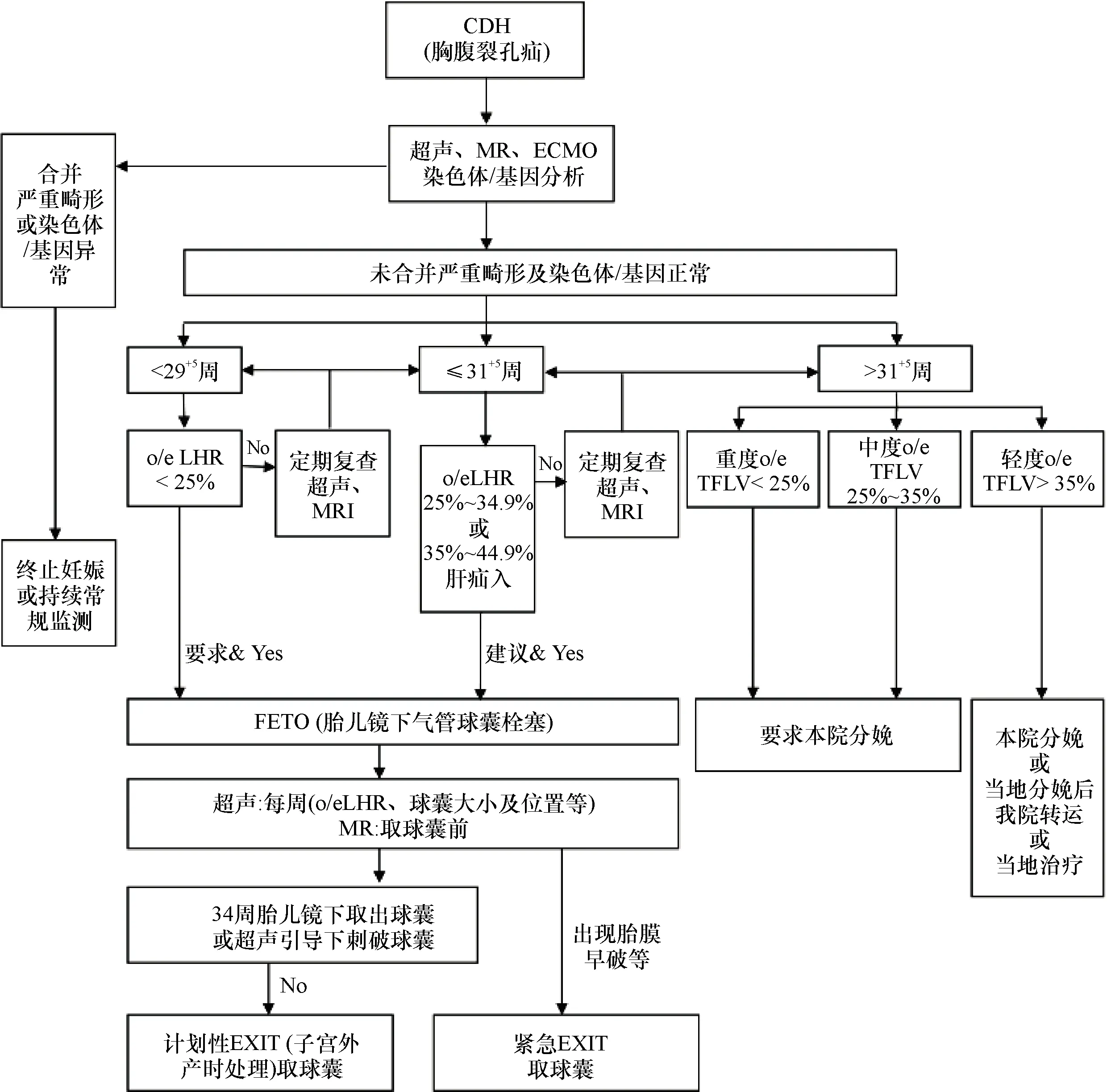
图1 产前诊断先天性膈疝的管理流程图
1.2.4 围产期处理 胎儿镜下气管球囊栓塞(fetal endoscopic tracheal occlusion, FETO)是促进胎儿肺发育的一种手段,FETO手术指证制定结合已发表的文献和我院相关经验[11]:(1)左侧胎儿膈疝未合并相关畸形;(2)产前超声评估时间不超过31+5周;(3)中重度胎儿膈疝。放置球囊的膈疝胎儿,每周需要超声复查o/eLHR、球囊位置及大小以了解胎儿整体情况。MRI可为取球囊提供更全面可靠的信息。胎儿镜取出或超声引导下刺破球囊为34周。子宫外产时处理(EXIT)是在维持脐带血运的情况下保证患儿血氧已经行短暂的手术性操作。球囊未能按时取出或34周前出现胎膜早破时,需要进行EXIT手术。除了外科性干预促进膈疝胎儿肺部发育方式外,中重度膈疝胎儿应在产科医师指导下使用地塞米松促进胎肺成熟。31+5周后中重度膈疝胎儿要求在我院-三级甲等医院分娩,轻度患儿推荐在我院分娩,若在外院分娩后也转运返院。
1.3 出生后管理 ECMO是一种体外呼吸与循环技术,用于呼吸功能衰竭的CDH患儿。我院采用的新生儿ECMO指征与2016年欧洲协会共识一致[12],所有患儿的ECMO置管操作由熟练的外科专科医师执行。膈疝修补的手术时机及手术方式的选择已有既定的标准[13-14]。

2 结果
2.1 产前 产前胎儿膈疝基本信息见表1。2016年3月至2018年5月产前诊断的左侧胎儿膈疝共计39例,诊断胎龄为(28.4±6.4)周。4例患儿家属选择流产,其中1名产前超声或MR评估为中重度并染色体异常。3名未做产前严重程度分级TOP患儿中,2名检查出合并严重畸形,另1名家属拒绝做畸形筛查并选择TOP。产前超声或MR评估为中重度胎儿膈疝17例,轻度胎儿膈疝19例。未合并严重畸形的胎儿膈疝37例,合并严重畸形胎儿膈疝2例。肝脏疝入胸腔9例,肝脏未疝入胸腔30例。染色体异常胎儿膈疝5例,染色体未发现异常胎儿膈疝31例。8例膈疝胎儿未在我院进行分娩和治疗,随访其死亡和ECMO使用情况。最终在我院分娩的胎儿为27例,15例中重度患儿和12例轻度患儿。
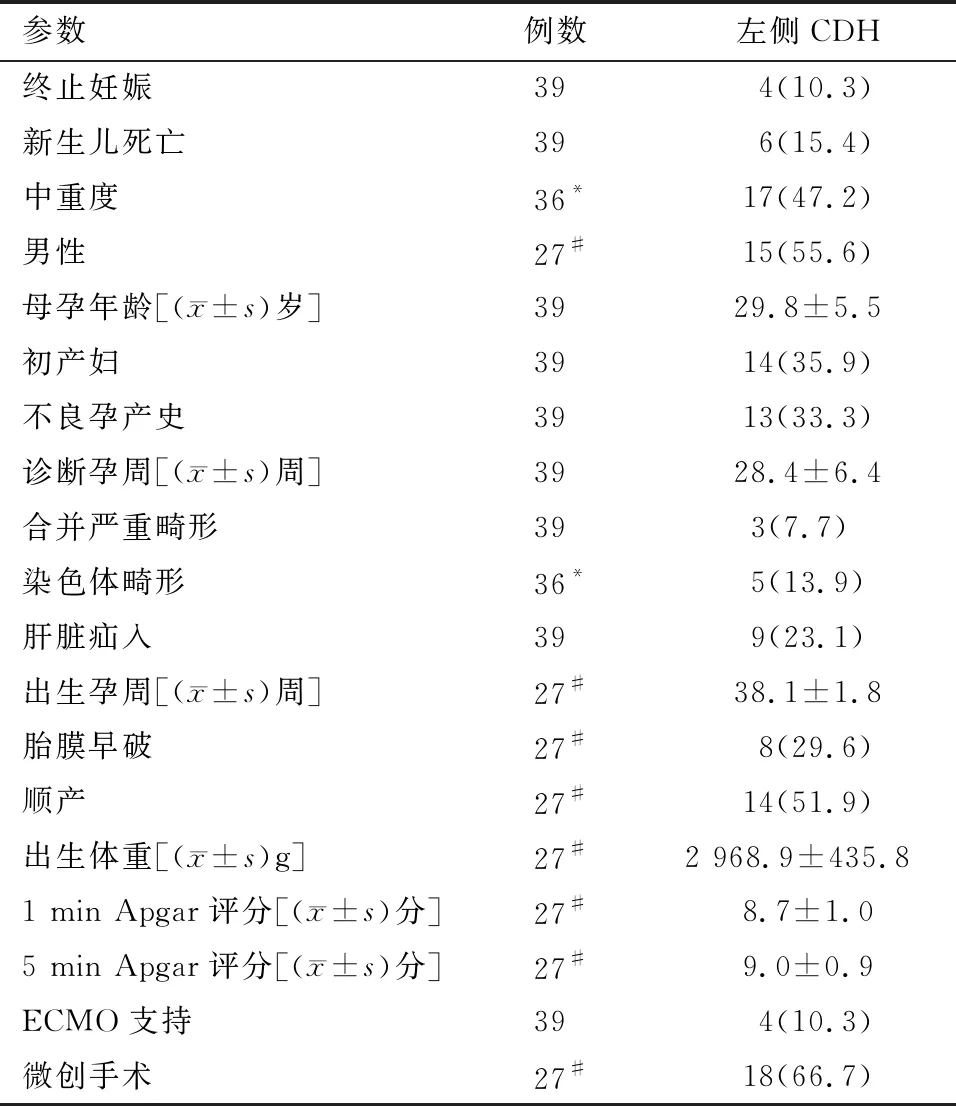
表1 左侧CDH患儿基本信息 例(%)
2.2 围产期和生后 我院出生并治疗的膈疝患儿信息见表2。10.3%(4/39)的胎儿膈疝TOP。胎儿膈疝新生儿期病死率为15.4%(6/39)且均为产前评估为中重度的胎儿膈疝。在我院分娩的中重度膈疝患儿中,新生儿期病死率为26.7%(4/15),ECMO使用率为26.7%(4/15)。50%(2/4)的ECMO患儿在新生儿期存活。53.3%(8/15)的中重度患儿接受了剖宫产治疗,平均孕龄为(37.9±2.0)周。1例中重度膈疝患儿产前29周进行FETO手术,34周出现胎膜早破紧急进行EXIT手术。该患儿在新生儿期存活。中重度膈疝患儿微创手术率53.5%(8/15),术中补片使用率为60%(9/15)。气胸在中重度患儿发生率为46.7%(7/15)。中重度膈疝患儿与轻度膈疝儿相比,补片使用率、住院时间、术后机械通气时间上有统计学上的差异。中重度膈疝患儿较轻度膈疝的补片使用率更高(60.0%vs.25.0%,P<0.05),住院的中位时间[34.0(15.9,63.7) dvs. 16.0(12.5,21.3) d,P<0.05]及机械通气的中位时间更长[14.0(7.6,22.2) dvs. 3.5(2.7,7.3) d,P<0.05]。见表2。

表2 中重度胎儿膈疝和轻度胎儿膈疝的临床结局 例(%)
3 讨论
产前诊断水平的不断提高,一方面使得CDH患儿越来越多地被产前诊断,另一方面,产前诊断水平的提高为产前评估和产前咨询提供了可能。有文献报道部分中心产前诊断高达68%[15]以上并有少部分患儿于孕早期诊断[16]。我们认为,总结产前评估和咨询重要性在于:(1)指导继续妊娠或TOP;(2)有指征地对膈疝胎儿进行宫内干预;(3)选择性加强围产期管理;(4)提前预估新生儿期结局。而所有产前咨询和评估都依赖准确和可靠的膈疝严重程度分级,尤其是重度膈疝患儿的识别。LHR、TFLV、预测肺容积比(PPLV)、肝疝入体积比(%LH)等指标均有文献报道用于膈疝严重程度的分级[17-18]。在本研究中选用的是o/eLHR、肝脏疝入和o/eTFLV。值得注意的是,在本组报道的所有新生儿死亡病例均为产前评估为中重度CDH胎儿,这说明了产前评估标准是可靠的,合适的。
在产前程序化管理的过程中,多学科团队合作贯穿其中。产前诊断为膈疝胎儿将在多学科主导的周会上进评估并对膈疝胎儿现状、后续管理和治疗达成共识。这是很重要的一个环节,轻度畸形患儿得以继续分娩,未合并严重畸形和染色体/基因异常的患儿也避免了盲目引产。许多研究显示[19-21],产前筛查发现合并严重畸形和染色体/基因异常膈疝胎儿的临床预后非常差。因而,我科建议此类膈疝胎儿终止妊娠或加强产前监测。Deprest等[11]研究显示,o/eLHR及o/eTFLV可较好地预测左侧单纯性CDH的存活率效果满意。Alfaraj等[9]和Victoria等[8]的研究也支持Deprest的划分标准对左侧单纯性CDH的存活率预测。此外,FETO可能为o/eTFLV<25%膈疝胎儿存活的唯一希望。我科一例重度膈疝胎儿成功进行FETO手术干预并在新生儿期存活。2015年欧洲CDH协作组共识对胎儿镜下气管封堵作为促进肺发育的一种方式予以了肯定,中重度膈疝胎儿应用FETO平均存活率约为50%。然而,持续的胎儿气管封堵可造成早产以及Ⅱ型肺泡细胞减少引起的肺表面活性物质减少[22-24]。目前,球囊取出时间多推荐为34周。Deprest等[11]的研究显示放置球囊后早产发生的中位发生时间为35.3周。而随着围产期管理水平的提高,这一时间或进一步推迟。目前,国际上进行着一项研究产前气管栓塞对中重度膈疝影响的研究(TOTAL trial),我院制定的FETO干预指征与该研究是相一致的。最近的一项研究显示,FETO或 ECMO的使用可以独立预测1岁内重度膈疝患儿肺动脉高压的缓解[25]。
ECMO作为一种挽救中重度膈疝患儿的急救模式,应该在产前咨询和产前多学科团队管理中进行讨论。国外文献不少已显示了ECMO改善膈疝存活率,中心转运,预后评估等方面作用[26-28]。而国内对ECMO治疗膈疝的病例报道非常有限[29-30]。这可能与ECMO需要较高的技术支持,专业培训、较高昂的价格、潜在出血、脱管等并发症有关。考虑到这些因素,在我们中心,ECMO的置管由多学科团队中心脏专科医师进行并由经验丰富的ECMO团队管理。我们的研究数据显示,ECMO使用率为26.7%(4/15),均为中重度患儿。50%(2/4)的ECMO患儿在新生儿期存活,这与Delaplain等[31]报道相一致。目前,基于ECMO与手术时机的关系主要有以下3种:(1)ECMO置管后早期(72 h内)手术修复;(2)ECMO置管后晚期(72 h后)手术修复;(3)手术修复后ECMO置管。文献表明,ECMO置管后早期手术修复和手术修复后ECMO置管预后均优于置管后晚期手术修复[32]。然而将早期(72 h内)手术修补进一步分为超早期(24 h内)手术修补和非超早期(24~72 h)手术修补时,两者手术的获益无明显的差异[33]。
微创手术治疗先天性膈疝是一个重大的手术技术进步,已经显示出了创口小,住院时间短,出血量少等优势[34-35]。而随着技术的进步,与开放手术在手术时间、复发率、并发症等的差异也在减少[35-36]。与此同时,微创手术的应用领域也在逐渐增加[37-38]。而在我们团队近年来已发表的文章中显示,在标准化指征和改进的手术技术下,微创手术是有效和安全的[13,39]。这可以进一步解释我们本组研究中重度膈疝与轻度膈疝在微创手术率上无统计学差异的原因。
在本研究中将新生儿期病死率、ECMO使用率作为主要的预后评估指标,并对中重度与轻度膈疝进行了初步的比较。我院分娩中重度胎儿膈疝新生儿期病死率为26.7%(4/15),ECMO使用率为26.7%(4/15),50%(2/4)的ECMO患儿在新生儿期存活。中重度膈疝患儿的病死率与文献报道相一致[8,11]。总体上看,我科膈疝胎儿TOP率(10.3%)低于以心脏畸形为最常见的膈疝引产率(20%)[40]。胎儿膈疝新生儿期病死率为15.4%(6/39),这与文献报道12%~32%相一致[7,41]。中重度膈疝胎儿较轻度膈疝胎儿术中应用补片率显著增高(60.0%vs. 25.0%,P<0.05)。这与中重度患儿可能存在着更大的膈肌缺损面积有关。有文献报道,缺损面积决定了CDH患儿的存活且补片的使用是死亡和残疾的独立预测因素[42-44]。中重度膈疝患儿术后机械通气时间和住院时间显著长于轻度膈疝患儿(P<0.05)。这与中重度患儿肺发育不良往往更重有关[45-46]。本研究数据显示,中重度膈疝胎儿肺动脉高压率(86.7%)高于轻度胎儿膈疝(66.7%)。Kraemer等[47]报道未合并肺动脉高压机械通气时间为5~15 d(中位时间8 d),住院时间为16~59 d(中位时间33 d),合并肺动脉高压机械通气时间为49~181 d(中位时间77 d),住院时间为198~407(中位时间331 d)。我科胎儿膈疝机械通气时间和住院时间似乎均较上述报道短。另外,需要强调的是,中重度胎儿管理中存在着TOP、剖宫产、FETO、紧急EXIT、插管抢救、ECMO、微创手术、气胸等情况,这需要产科、新生儿科、儿外科、心脏外科的团队密切合作。因而,中重度膈疝胎儿应要求在具有多学科救治团队的专科医院中分娩。
缺乏长期预后分析是本文的主要不足。长期随访将有助更为全面地理解膈疝胎儿的临床预后和产前程序化管理模式效果。许多研究显示,胎儿膈疝远期可存在运动功能障碍、神经系统功能、呼吸系统功能等障碍[48-51],而我国对于胎儿膈疝远期预后报道甚少。小样本和回顾性分析是本研究的另一不足。
综上所述,本组胎儿CDH的新生儿期临床结局满意,有必要在CDH中应用产前程序化管理,但其远期的预后仍然需要前瞻性、长期随访进一步确定。

