酵母终止子工程:从机理探索到人工设计
盛月,张根林
(石河子大学化学化工学院,新疆兵团化工绿色过程重点实验室,新疆 石河子 832003)

合成生物学作为21 本世纪一个充满活力的新兴交叉学科,以工程化思想理性设计改造生命体、创造新功能。该技术突破了生命发生与进化的自然法则,推动了解读生命到编写生命的跨越,可为破解资源、能源、健康、环境、安全等重大难题提供重要技术支撑。通过引入新的合成途径或功能模块,已在微生物中实现了青蒿酸、人参皂苷、紫杉二烯、异丁醇等复杂或高值化合物的合成,在化学品合成、药物发现与制造、农业生产等领域均表现出了重要的应用价值[1-2]。
有效的生物元器件是途径组装和生命体改造的基础,其中控制元件更是影响人工生物体系的重要因素之一。原核生物中含有上万种调节线路,它们能够在转录或翻译水平对环境信号进行感应和应对,人们成功地从这些线路中挖掘出了启动子、转录调控因子、核糖体结合位点等大量的控制元件,并构建了人工核酸开关等应用于代谢途径的精细调控[3]。但由于真核生物复杂的遗传特性,在其中开发的控制元件相对单一,常见的控制元件主要是启动子,限制了真核生物中合成线路的构建和应用[4]。
近年来,科学家在酿酒酵母、大肠杆菌、病毒、哺乳动物和十字花科植物等物种中开展了大量的转录调控研究,发现不少基因的3′-UTR 区域含有调控mRNA 稳定性和亚细胞定位相关的功能元件。3′-UTR是mRNA上从终止密码子到poly(A)尾巴的一段RNA 序列,长度从几百个碱基至上千个碱基不等,常为冗余的重复序列,并且大多数可以形成茎环。将位于mRNA 3′-UTR 区域内能够利用自身“发卡”结构阻止RNA 聚合酶Ⅱ在模板上移动,并与其他高度保守元件和蛋白因子共同协作实现3′末端的加工,给予RNA 聚合酶Ⅱ转录终止信号,促进转录终止的元件称为终止子(terminator)[5-6]。酿酒酵母每个基因的表达均受终止子元件的调控,当转录进行到3′末端时,终止子利用自身富含GC 的区域形成一段稳定的发卡结构,阻碍了RNA 聚合酶Ⅱ在模板链上移动,导致转录终止。
不同活性终止子的使用能够影响mRNA 的稳定性、切割效率、聚腺苷酸化反应以及3′-UTR 区域的长度和稳定性,最终影响基因表达程度[7-10]。基于对终止子关键核心序列认识的不断提高,以更短、性能更强、活性可控、可设计为特征的终止子工程迅速发展。以这种表达“输出”控制方式的工程应用也不断涌现,表现出了良好的应用潜力。因此,本文作者针对合成生物技术常用的酿酒酵母模式底盘,以机理探索到人工设计为主线总结终止子的研究进展,主要包括终止子元件的结构与功能、作用机理、人工设计及应用进展,并对终止子工程面临的问题和发展趋势做出讨论,为开发合成生物学元件和异源合成途径优化提供有用的信息。
1 酿酒酵母终止子的结构与功能
1.1 终止子元件的基本构成
合成生物学按照工程学理念,将生命体系中发挥功能最简单、最基本的单元统称为生物元件,调控元件是生物调控的重要组成部分,启动子、终止子、转录调控蛋白因子等可以作为调控元件作用于基因转录、翻译水平[11-12]。为了明确酿酒酵母mRNA 3′末端形成所涉及的元件,丰富途径工程发展,1996年Guo和Sherman率先定义了酵母终止子形成所必需的最小元素集:效率元件(efficiency element,EE)、位置元件(positioning element,PE)、poly(A)位点[poly(A)sites,Py(A)n]以及围绕poly(A)位点的富T区域[图1(a)][13]。若将这些元素组合在一起,足够发挥酵母3′末端的转录终止功能。
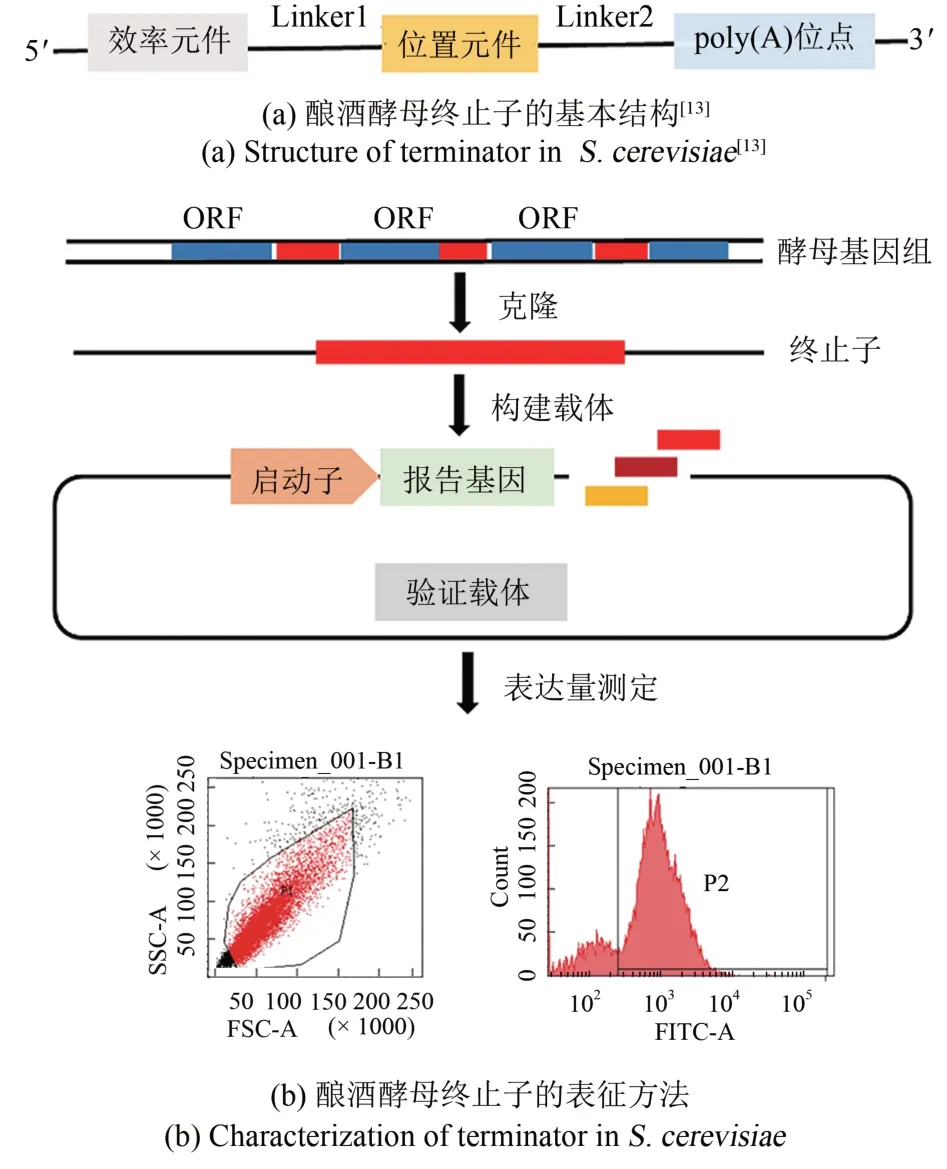
图1 酿酒酵母终止子的基本结构与表征方法[13]Fig.1 Structure of terminator in S.cerevisiae and their characterization[13]
现已证明,效率元件一般位于终止子序列最上游,富含TA,序列TATATA、TATGTA、TACATA、TAAATA、TACCTA 是常见的效率元件,当序列为TATATA时最有利于终止子效率文件的活性,并有提高下游位置元件使用效率的作用[14-15]。终止子的终止效果与效率元件的长度成正比,但效率元件的序列长度最少不能小于6 bp,大约50%终止子均有TATATA序列,其中第一和第五个碱基T对3′末端加工影响最大。另外,效率元件能够辅助下游位置元件定位,提高元件使用效率。mRNA 3′末端的形成需要poly(A)位点上游的恒定位置元件进行终止信号的识别。位置元件是富含A的元件,位于poly(A)位点上游约10~30 bp,序列AAAAAAAA、TTAAGAAC、 AAGAA、 AATAAATGA、 AAAAAA、AATAAA 是常见的位置元件。当位置元件的序列为AAAAAA 时,类似于哺乳动物中的六聚体定位poly(A)位点,终止子活性最强。位置元件募集大量转录终止因子、切割和多聚腺苷酸化因子共同完成加工和剪切过程,辅助识别切割位点,指导poly(A)位点的定位[16-20]。Guo 利用终止子 CYC1t 和ADH1t 对poly(A)位点的序列进行了系统研究,表明poly(A)位点实际序列由胞苷或胸腺嘧啶加上一个或多个腺苷残基组成,夹在两个富含U/GU 的侧翼序列之间,TTTCAAA 是聚腺苷酸化发生的最佳序列,切割位点通常发生在核苷酸CA 上,第二个核苷酸A始终是一个发生切割的腺苷残基,切割完成后添加poly(A)尾巴标志着转录完成,poly(A)位点的位置主要由效率元件和位置元件共同决定[13]。侧翼富含U/GU的区域可用于调节poly(A)位点的使用效率和精确t 切割位置,以完成mRNA 3′末端的多聚腺苷酸化加工形成成熟的mRNA[21-26]。
显然,这些简单的元素共同参与了3′末端的形成过程,但其他序列也会影响终止子的强度。研究表明,终止子的终止作用除了与上述元件及它们的序列有关之外,还与各个元件之间的连接序列Linker 1 和Linker 2 的序列和长度有关。如果效率元件、位置元件和poly(A)位点的序列是确定的,那么Linker 1 序列的GC 含量和Linker 2 序列形成的茎环结构将成为影响终止子强度的重要因素[27-28]。Guo[13]等通过CYC1-lacZ融合基因的转录分析证明,位置元件与效率元件相距10~20 bp,与poly(A)位点相距10~30 bp。
1.2 终止子的功能表征
终止子的活性一般通过所控制基因的蛋白质表达水平来表征。常利用绿色荧光蛋白基因(eGFP)、红色荧光蛋白基因(mKO2)等报告基因为功能基因,将终止子插入报告基因的下游,通过流式细胞仪等手段检测报告基因的表达情况,可将样品荧光值([GFP]t)与对照组荧光值([GFP]0)差值的对数(FⅠ)作为终止子活性值,该值越大表明终止子的转录终止能力越强[图1(b)],(P1 为对照组-eGFP阴性区域,P2 为样品组-eGFP阳性区域)。终止子是3′-UTR区域的功能元件,多为重复的冗余序列,常将位于基因3′-UTR 区的序列认为是终止子所在区域,因此在分析终止子时,常将蛋白质编码序列下游约500 bp 的序列或全部序列作为终止子元件,每个编码序列都与一个实质性的 3′-UTR 序列相关[29-30]。Yamanishi 等[30]从酵母基因组中克隆出约500 bp 的3′-UTR 区域,在eGFP下游插入不同的终止子,表征了酿酒酵母5880 个基因中的5302 个终止子,相对于PGK1 终止子的FⅠ值而言,发现酵母天然终止子的活性范围可达0.036~2.52。Curran 等[27]表征了 34 个不同的酵母终止子,发现最活跃的终止子能使目标基因的mRNA 半衰期增加2.5 倍,而使蛋白质过表达6.5倍。
1.3 终止子的分类
为了方便终止子研究与使用,可将终止子根据活性大小按照强、中、弱进行分类。由于强终止子序列更容易形成稳定的发夹结构,不仅能够更快速地阻止RNA聚合酶Ⅱ在模板链上继续前行,促进转录终止,也能提高mRNA 的稳定性,增加蛋白质的积累。因此强终止子的使用能够提高mRNA和蛋白质的产量[31-32]。弱启动子与强终止子的互补使用能达到和强启动子相似的基因表达效果,甚至某些情况下弱启动子结合中强度终止子可以使蛋白质表达效率提高几倍,但诱导型启动子和强启动子与终止子活性的影响不大。研究酵母转录和聚合酶的催化中心发现,终止子的终止调控作用是酵母基因表达不可或缺的。终止子作为基因调控元件,主要功能是负责转录终止、mRNA 3′末端加工,最终通过影响mRNA 的稳定性、翻译效率和定位调节蛋白质的产生。然而,终止子作为基因元件是独立于报告基因和编码区序列而行使功能的,其活性不受所表达功能基因的调节。通过测量天然终止子的活性,已经确定终止子的缺失会导致转录过程的冗长,而出现转录不稳定。本课题组前期用eGFP验证了糖酵解途径和TCA 循环途径中的100 个终止子,以酿酒酵母基因组为模板扩增相应的终止子片段,构建“TYS1p+eGFP+Terminators”基因表达盒,流式细胞仪检测终止子强度,也发现了天然终止子的活性差异,强度范围可达0.0613~1.8002[33]。以常用的终止子PGK1t 的FⅠ值为标准,人为地将FⅠ值小于0.0613 的终止子划分为弱终止子;将FⅠ值大于0.9826的终止子划分为强终止子;将FⅠ值在0.0613和0.9826 之间的终止子划分为中等强度终止子。因此,在100 个酵母天然终止子文库里含有45 个强终止子、31 中等强度终止子和24 个弱终止子,其 中 终 止 子 MⅠC60、 SOR1t、 ELO2t、 NTA1t、MMS22t和GRS2t是第一次被表征和报道。
2 酿酒酵母终止子的转录调控机理
转录是将RNA 聚合酶募集到启动子,合成mRNA 并在终止子序列上解离RNA 聚合酶的高度复杂的过程,受到多种因素的影响。其中两个关键的转录调控事件是转录起始调控和转录终止调控[34-36]。转录调控指通过改变转录速率从而改变基因表达的水平,可以控制转录何时发生以及产生多少,是基因表达调节控制中的一个重要环节[37-40]。研究表明,基因正确的表达需要RNA 聚合酶ⅠⅠ的有效终止以避免转录干扰和非编码RNA的合成。终止滞后将破坏同一染色体上的其他基因表达;终止提前将产生缩短的有缺陷的mRNA,从而导致蛋白质的变异,因此转录过程受到严格的调控。酵母的转录终止涉及转录终止因子、多聚腺苷酸化因子、组蛋白、核小体等,终止子利用自身的功能元件募集这些调控因子共同完成转录终止[41-43]。
酵母mRNA 3′末端是通过转录终止形成的,与其他高等真核生物相比,使用了更加复杂的加工机制。从机制上讲,终止子定义了3′-UTR 的序列和结构,在3′末端发出转录终止信号并利用自身元件募集蛋白因子负责转录终止,切割新生的mRNA 链发生聚腺苷酸化反应,有助于mRNA 的稳定性。终止子区域的活性与mRNA 丰度成正相关,表明终止子是mRNA 丰度的决定因素,由于终止子在mRNA 加工中的重要性,最不活跃的终止子区域倾向于编码更长的3′-UTR 区域,缺少终止子会产生延伸的转录本,导致转录本不稳定而无法翻译[44-47]。
2.1 转录终止因子在转录调控中的作用
终止子元件作为3′末端区域重要的调控元件,具有调控mRNA亚细胞定位、稳定性及翻译效率的作用。终止子区域的转录加工通常涉及两个调控过程,转录终止涉及3′末端mRNA 的切割和poly(A)位点的剪切;转录后调控涉及3′-UTR 区域的稳定性、翻译效率和mRNA 的定位。终止子内的高度保守序列招募RNA 结合蛋白和相关蛋白因子,用于转录后调节基因表达的各个方面[48-50]。具体而言,终止子元件上的功能元件作为转录终止的修饰位点,通过招募与转录调控相关的切割因子ⅠA、切割因子ⅠB、聚腺苷酸化特异性因子复合物CPF,共同完成3'末端复杂的加工机制[51-53]。在酿酒酵母中已经鉴定出超过20 种以上的蛋白质因子与mRNA 3′末端加工有关,但大多数蛋白质因子都没有关于详细功能的解析或与终止子结合靶标的信息[54]。
终止子通过切割因子ⅠA、切割因子ⅠB 识别自身效率元件和位置元件进行3′末端的加工和切割。而多聚腺苷酸化反应首先由切割因子ⅠB 和CPF 蛋白质复合物识别终止子元件上的ploy(A)位点及围绕ploy(A)位点的富U/GU 区域进行切割,在多聚腺苷酸聚合酶的催化下,3′末端会合成具有一定长度的ploy(A)尾巴,将mRNA 从细胞核内转运至细胞质中翻译成蛋白质[55-57]。切割因子 ⅠA、ⅠB 的亚基根据其不同的蛋白质结构域和裸露在外的氨基酸残基行使不同的功能,结合不同的终止子区域(图2)。突变或过表达切割因子ⅠA、ⅠB均会造成转录终止缺陷,但并不会完全停止转录。同样,终止子的缺失可能延长转录过程造成下游基因的通读,导致目标基因和蛋白质表达量的减少[58-59]。遗传和功能研究表明转录终止因子与RNA 的精确结合对于3′末端转录终止有巨大作用,在当前的酿酒酵母转录终止因子研究中,仅有非编码蛋白Nrd1、Nab3 在全基因组上的靶标RNA 序列研究较为清楚,分别识别 UGUAG/A 和 UCUUG[60-62]。另外,目前已确认转录终止因子Pcf11、Rtt103、Mbp1、Fkh1 主要作用于聚腺苷酸化反应,但它们如何与终止子结合行使终止功能还不完全清楚[63-66]。

图2 酿酒酵母终止子参与的可能终止机理Fig.2 Possible termination mechanism of terminators in S.cerevisiae
在上述转录终止因子中,发现切割因子ⅠB 家族包含的转录终止因子Pcf11 与裂殖酵母、哺乳动物、人、果蝇等中都含有类似的功能同系物,并贯穿于整个转录终止过程,推测Pcf11 具有多种功能[67-71]。第一,Pcf11 能够识别终止子区域上的位置元件,利用自身蛋白质结构域招募蛋白质因子Clp1、Rna14、Rna15 和切割与多聚腺苷酸化因子CPF 共同完成3′末端加工过程,同时促进新生pre-RNA 链从DNA-RNA-RNA 复合物中释放,促进转录终止[72-73]。第二,Pcf11介导与ploy(A)位点相关的切割和多聚腺苷酸化反应,在ploy(A)位点处完成切割并添加ploy(A)尾巴,促进mRNA 成熟,并与非编码RNA结合切割内含子连接外显子,构建不同长度的转录本[74-75]。第三,在转录延伸过程进行到3′末端时,Pcf11 蛋白发生磷酸化反应与RNAP ⅠⅠRbp1 亚 基 CTD 区 域 中 磷 酸 化 的 Ser2、Ser5 结合,促进 mRNA 切割、RNAP ⅠⅠ从 DNA 模板链上的解离,开启下一轮转录[76-79]。总之,转录终止因子Pcf11 通过识别终止子元件,参与mRNA 3′末端的加工和聚腺苷酸化反应,既能影响转录终止的时机又能调控mRNA 的稳定性,对转录过程具有全局调控作用,是一种重要的潜在全局调控元件。然而,目前对其具体的转录终止机制还不清楚,特别是关于Pcf11 是如何与终止序列识别并响应的、它的靶标RNA 如何、Pcf11是如何参与聚腺苷酸化反应进行poly(A)的位点选择的。相信通过构建转录终止因子Pcf11 等缺失菌株,利用高通量方法深入分析转录终止因子与终止子的结合位点和规律,将会进一步实现在全基因组层面分析转录终止过程的详细调控网络,为转录终止机理提供新的研究线索。
2.2 依赖于poly(A)位点的转录终止
真核生物的遗传信息由三种聚合酶进行转录,作用于不同类型的转录本,RNA 聚合酶ⅠⅠ转录大量mRNA和一些经典的非编码功能基因SnoRNA和SnRNA,这些转录产物的生物合成是一个严格调控过程,与其他RNA 加工事件共同进行[80-81]。对于蛋白质编码基因,转录终止主要依赖于poly(A)位点的终止路径,与切割和聚腺苷酸化因子相关。在真核生物中除了组蛋白mRNA 几乎绝大多数真核生物mRNA 和lncRNA 的3′末端都具有一串连续的腺苷,被称为poly(A)尾巴。poly(A)尾巴与mRNA 的出核转运、稳定性和翻译效率息息相关,具有重要的生物学意义[82-83]。
研究表明,绝大多数的mRNA 具有一个或两个以上的多聚腺苷酸化位点,酵母、哺乳动物、拟南芥高达70%以上基因具有选择性多聚腺苷酸化现象,在3′末端加工中具有重要作用,并受到复杂而精细的调控,涉及到许多蛋白质-RNA 之间的相互作用[84-85]。这种相互作用可分为两种情况:一种拥有多个 poly(A)位点,并且都在 3′-UTR 区对应的mRNA 编码区完全一样,只是3′-UTR 长短不同称为UTR-APA;一种是由选择性切割导致,poly(A)位点位于不同的外显子区域编码序列有可能发生改变,称为CR-APA[86-88]。在此过程中,贯穿整个转录过程的转录终止因子Pcf11 作为“加工支架”,能够辅助CPF 识别poly(A)位点的侧翼元件,有助于切割因子在poly(A)位点的准确切割,辅助蛋白质复合物与pre-mRNA 的稳定结合,有助于mRNA在蛋白质合成中有效地发挥作用[89-90]。可以看出,poly(A)位点选择性多聚腺苷酸化会直接影响到mRNA的稳定性和翻译效率。
poly(A)位点位于整个转录本的3′末端,位点的选择直接影响到mRNA最重要的调控区3′-UTR,是绝大多数RNA 结合蛋白和microRNA 调控的靶标区域,因此poly(A)位点的选择会直接影响到mRNA的稳定性和翻译效率[91-92]。然而,酵母中选择性多聚腺苷酸化的具体调控机理尚不明确,对其具体分子机制及功能性结果等尚处于研究的起步阶段。认为多聚腺苷酸化过程通常与终止子序列具有内在联系,终止子元件上的ploy(A)位点与多聚腺苷酸化反应必需的蛋白质复合物的识别密切相关,其中3′末端的切割和多聚腺苷酸化是两个重要的步骤[93-95]。pre-mRNA 切割和聚腺苷酸化是一种机制,令编码蛋白mRNA 和长链非编码RNA的3′末端中断。该过程涉及大量多聚腺苷酸化因子与终止子功能元件之间的相互作用,其中ploy(A)位点的准确切割取决于切割和多聚腺苷酸化因子CPF 蛋白质复合体,识别终止子区域内的ploy(A)位点、富含GU/U 的侧翼元件,促进ploy(A)位点的多聚腺苷酸化反应过程。
2.3 不依赖poly(A)位点的转录终止途径
与蛋白质编码基因的转录终止相比,酿酒酵母大部分非编码转录事件不依赖于RNA 切割终止,而是需要Nrd1-Nab3-Sen1蛋白复合物途径终止。该途径包括大多数小核仁RNA、隐形不稳定转录本等。非编码蛋白Nrd1、Nab3 在全基因组上的靶标RNA 序列研究较为清楚,通过与RNA 聚合酶ⅠⅠ的亚基Rbp1和终止子区域中的GUA/G核苷酸相互作用,分别识别UGUAG/A和UCUUG,其中Nrd1还可以通过促进过早转录终止来调控数百种蛋白质编码基因,这些靶标RNA序列在SnoRNA序列中是频繁的,特定的RNA 基序对于Nrd1-Nab3-Sen1 蛋白复合物结合到新生的RNA上是至关重要的[96-98]。
3 酿酒酵母终止子的人工设计与合成
酿酒酵母可以利用自身有效的同源重组在体内进行遗传电路或合成途径的组装,但当外源基因序列与酵母基因组序列重复或高度相似时,会给多基因装配带来问题[99]。大多数天然终止子的序列较长,作为元件使用时与酵母基因组同源重组的风险较大,可能会导致体内组装构建物中重复序列的重排,在构建大型遗传回路或途径时较为困难,同时过长或太复杂的终止子也会影响异源基因mRNA的稳定性和翻译效率,降低表达水平[100]。为了避免这些不足,终止子工程应运而生。终止子设计的基本原则是,采用最少元素设计,将功能元件的最佳序列组合在一起,对天然终止子序列进行简化,合成人工终止子,不仅使其具有与天然终止子相同的效应,由于其与酵母基因组几乎没有同源性,大大降低了同源重组率,还能大幅度缩短终止子长度,减轻质粒载体和菌株代谢负荷[101]。
终止子设计是沿着相对较短的线性DNA 进行模块化组合的,可以创建高度精确的基因表达模式。从头合成终止子的设计将提供比天然终止子更大的优势,就像合成启动子可以胜过天然启动子一样,合成终止子可能同时影响多个mRNA 特性,即多聚腺苷酸化水平和3′-UTR 区域的结构。为了构建一系列合成的终止子,可从基础元件、间隔区、二级结构、GC 含量等方面设计(图3)。Curran 等[102-103]基于构成终止子结构的基础元件,设计出30个短的、合成长度为35~70 bp的人工终止子,与常用的CYC1终止子相比,合成的短终止子更能提高mRNA 的稳定性和增加蛋白质产量,其中人工终止子最高使荧光蛋白输出增加3.7 倍,转录水平增加4.4 倍,并且合成的终止子在酿酒酵母和解脂耶氏酵母中都具有很高的活性,证明了这些设计理念可在多种酵母菌种中转移。

图3 酵母终止子设计的思路Fig.3 The strategy for yeast terminators design
表达增强型终止子使酿酒酵母基因表达效率比对照提高了11 倍,与不使用终止子情况相比提高了35 倍,为今后终止子人工设计提供了理论依据和设计规则:如荧光蛋白的表达量与效率元件的序列长度成正比;位置元件和poly(A)位点对荧光蛋白的表达量没有太大影响[104-105]。本课题组在优化效率元件、位置元件和poly(A)位点基础方面,进一步探讨了间隔区序列对终止子活性的贡献。在Guo首次描述定义酵母终止所需最小元素集的基础上,通过构建266 个长度约60 bp 的人工终止子文库,初步发现了一些规律:终止子活性随效率元件与位置元件间Linker 1序列GC含量的升高而降低,且随Linker 1序列中T的增加而增加;Linker 1序列GC 含量对荧光蛋白表达量的影响要大于Linker 2序列;Linker 2 序列构成的茎环对不同活性终止子具有不同程度的影响,降低弱、中等强度终止子的茎长有利于提高mRNA表达量和蛋白质产量[15,106]。这些研究充分证明终止子的活性是可以调节可以控制的,更短、最小序列的终止子可能被编入未来基因调控元件的设计和预测模型中,也将为理解终止子在基因表达调控中的作用提供重要信息。表1列举了常用酵母终止子的相关信息。
4 终止子在酵母途径精细调控中的应用
尽管利用强启动子控制途径酶的表达是代谢工程和合成生物学中常用的调控方法,但随着对转录终止过程的逐步解析,终止控制已经受到越来越多的关注[107]。由于终止子有助于mRNA 稳定,将天然终止子用于基因表达盒构建是构建外源途径的必然选择[108-109]。而使用合成的人工终止子可以更加理性地调控mRNA 的半衰期,减少或增加蛋白质产生[110],因此通过选择合适活性的终止子可以对代谢途径进行精细调控[111-112]。利用终止子优化合成途径时,可考虑以下原则:①尽量选择相对较短的终止子,以避免冗余序列带来的干扰;②选择终止子时要同时考虑相应组成型启动子的活性,弱、强元件的搭配可以达到使用高活性启动子的效果;③使用诱导性启动子时,终止子的调控作用将会明显降低,因此只需考虑终止子是否易得、易操作;④若难以判断某一基因对多基因途径的影响时,可优先考虑使用中等活性终止子,既能保证目的基因的有效表达,又能有效避免途径上游基因对下游基因的干扰。例如,本课题组通过优选天然终止子来控制番茄红素合成途径,结合柠檬酸分批补料发酵使酿酒酵母合成番茄红素的产量获得了大幅提升[113],在此基础上,利用短的、人工合成的终止子控制番茄红素途径基因的表达,使番茄红素产量又提高了13.0%,并发现在某些情况下中等活性终止子比强终止子更有利于代谢途径表达。当合成终止子用于较长途径的β-香树脂醇合成时,也表现出了良好的效果,使β-香树脂醇产量提高了约12 倍[114]。目前,已在酵母中建立了大量的天然终止子文库,同时部分结构优化的人工终止子元件已应用于代谢途径调控中,它们的调控能力较天然终止子有显著提高,在代谢工程中具有极大的潜力。这些实例充分证明了终止子调控技术在控制代谢途径中的重要作用,不仅能够用于调节基因表达效率,还可以有效增强代谢途径中目标产物的产量。

表1 常用酵母终止子的信息Tab.1 properties of commonly used yeast terminators
5 结语与展望
合成生物技术突破了生命发生与进化的自然法则,推动了生命科学由解读生命到编写生命的跨越,将在破解资源、能源、健康、环境、安全等重大难题方面提供重要支撑。过去的一段时间里,启动子、终止子等调控元件的研究为提升基因和途径的表达给予了许多贡献。然而,偏离期望的元件功能仍然是导致设计周期多次迭代、遗传改造和途径优化快速发展的严重阻碍。稳定、正交、可预测、可调的元件设计是优化控制元件功能必须满足的要求,控制元件的最小化已成为趋势。迄今为止,人们对终止子结构与功能、作用机理的探索取得了重要进展,新的合成终止子已经为代谢工程和合成生物学应用提供了重要支持。但由于真核细胞终止子受其所在染色质环境的高度调控,对酵母终止子的工程化努力仍然较少。终止子与各类转录终止因子如何识别、识别位点或序列是什么,这些问题仍然是终止子优化设计的限制。因此,有必要进一步制定控制终止子染色质环境的设计规则,开发新技术来预测和设计期望功能的终止子。
为避免野生型酵母染色质环境对终止子研究的干扰,利用人工合成酵母体系研究人工设计终止子的特性和调控机理将会是一种重要的技术选择[115-116]。另外,新一代高通量测序技术为研究终止子转录机理注入了巨大的活力,是研究转录机理的新的发展趋势。如紫外交联免疫沉淀测序、染色质免疫沉淀测序技术可为终止子元件与蛋白质的结合靶点提供服务;多聚腺苷酸化位点测序技术将为多聚腺苷酸化反应机理研究发挥积极作用[117-122]。
另外,巴斯德毕赤酵母、多形汉逊酵母、解脂耶氏酵母等非模式酵母近年来也展现出了优良的工业应用价值,通过构建文库等方法在这些酵母中也筛选到了一些内源终止子[123-125]。尽管非模式酵母中终止子研究较少,但终止子是重要的合成生物学元件之一,是构建基因表达盒和途径的基本要素,因此非模式酵母中终止子的筛选、人工构建甚至异源终止子的优化等也将会是今后该领域的研究重点。相信通过终止子等元件的逐渐解析和开发,会弥补非模式酵母遗传背景不够清楚、代谢调控复杂性高的限制,必将为非模式酵母合成生物学的发展带来新突破。

