大宗化学品细胞工厂的构建与应用
于勇,朱欣娜,张学礼
(中国科学院天津工业生物技术研究所,天津 300308)
通过合成生物学技术构建微生物细胞工厂,能够将糖类等可再生的生物资源转化为多种大宗化学品,实现大宗化学品的绿色清洁生产,可以摆脱对石油资源的依赖,解决石化制造过程中的高耗能和高污染问题,对促进国民经济可持续发展至关重要[1]。本文对微生物细胞工厂构建技术、代谢调控机制及大宗化学品生物制造的典型案例进行了综述,并对细胞工厂的未来进行了展望。
1 微生物细胞工厂构建技术
1.1 基因组编辑技术
基因组编辑技术是细胞工厂代谢途径构建及优化的重要技术。通常的基因编辑技术有:Red同源重组技术[2-3]、锌指核酸酶技术(zinc-finger nuculeases,ZEN)[4]、转录激活因子效应物核酸酶技术(transcription activator-like effector nucleases,TALEN)[5]等。这些基因编辑技术在合成生物学的发展中具有“里程碑”式的意义,但存在耗时长、成本高及宿主局限性等缺陷,无法满足高效构建细胞工厂的需求。
CRⅠSPR/Cas (clustered regularly interspaced short palindromic repeats/CRⅠSPR-associated proteins)基因编辑技术具有操作简单、基因编辑效率高、成本低廉等优势,近年来得到了深入的开发,并广泛应用于生物及医药领域。在大宗化学品代谢途径构建和改造中,CRⅠSPR/Cas 基因编辑技术显示了广泛的适用范围,成功地应用于大肠杆菌、谷氨酸棒杆菌、丙酮丁酸梭菌、链球菌、芽孢杆菌等原核微生物及酿酒酵母、曲霉等真核微生物细胞工厂的构建[6-7]。
首先,CRⅠSPR/Cas 技术可成功地应用于基因表达强度的调控。Heo 等[8]将该技术用于丁醇代谢途径的改造,通过高效编辑大肠杆菌柠檬酸合成酶基因(gltA)的启动子区域降低该基因的表达强度,将柠檬酸合成酶的活性调整为出发菌的55%,将丁醇的产量提高了1.3倍。
其次,CRⅠSPR/Cas 技术还可用于基因整合。Bassalo 等[9]使用该技术将alsS、ilvC、ilcD、kivD和adhA等5 个与异丁醇合成相关的基因构成的长达10 kb 的基因簇一步整合进大肠杆菌基因簇,并获得了异丁醇产量达2.2g/L的菌株。向丙酮丁醇羧菌中引入异丙醇的合成途径,得到了产量达4.45g/L的异丙醇生产菌[10]。
再次,CRⅠSPR/Cas 技术还可用于基因敲除。Cho 等[11]使用该技术敲除了谷氨酸棒杆菌中γ-氨基丁酸合成途径的竞争途径,将γ-氨基丁酸的产量提高到27.5 g/L。
近年来,科学家们开发出更为简便的CRⅠSPR/Cas 单碱基编辑技术,不需要同源臂,可在染色体上直接对基因进行定点突变。其基本原理为利用CRⅠSPR/Cas 系统确定突变位点,通过脱氨酶催化脱氨使单碱基发生转换。如:通过偶联胞嘧啶脱氨酶实现C到T的转换;通过偶联腺苷脱氨酶实现A 到 G 的转换。David R. Liu 团队将 CRⅠSPR/Cas9和逆转录酶融合表达,开发了“Prime Editing”系统,突破了CRⅠSPR/Cas 碱基突变类型,能进行C到 T、T 到 C、A 到 G、G 到 A 四种碱基置换[12],拓展了基因编辑技术的应用范围。
1.2 多基因同时调控技术
通常情况下,高效的产物合成途径不仅受限于某个单一的限速步骤,而是依赖多个酶的协同平衡[13]。虽然通过质粒过表达的方式可以实现单一基因的过表达,但同时也会造成细胞代谢高负荷,对生长代谢和产物合成均不利。近些年来,科学家们开发了多基因同时调控技术,合理调控代谢途径表达的平衡。
Keasling 团队[14]开发了一种多基因同时调控技术, 称为可调控基因区域文库(tunable intergenic regions, TⅠGRs)技术。这一技术被成功用于大肠杆菌中外源甲羟戊酸(mevalonate)途径的多基因协调表达,将甲羟戊酸的产量提高了7 倍。Warner 等[15]开发了一种基因组可追踪多元重组工程技术(trackable mutiplex recombinerring,TRMR),能同时对上千个位点进行分析和修饰。Ⅰsaacs 等[16]构 建 了 多 元 自 动 基 因 组 工 程 技 术(multiplex automated genome engineering, MAGE),能同时瞄准并改造单个细胞基因组上的多个靶点,从而在一个细胞群体中形成基因组多样性。利用自动化的MAGE 技术,对番茄红素生产途径上的24 个基因同时改造,一天可以产生数十亿不同基因型的突变株,经过3天的进化,从中挑选到番茄红素生产能力提高了5倍的菌株。
本文作者团队开发了一种CRⅠSPR/Cas9辅助的染色体多基因同时编辑技术,基于未发生重组的菌株染色体被活性Cas9 切割导致死亡的特征,显著提高了筛选效率,能在染色体上同时对三个基因进行快速的文库调控,三个基因同时编辑的效率达到了70%,操作周期为4 天。采用该技术,快速获得了木糖代谢速率提高了3 倍的多基因编辑菌株[17],极大地缩短了途径优化周期。该技术解决了传统Red同源重组系统只能对单个基因进行文库调控的缺点,为代谢途径多基因同时调控提供了新思路。
1.3 蛋白骨架技术
在细胞工厂的代谢途径中,参与反应的酶与底物之间的距离及合成途径上相邻的酶所处的空间位置是影响代谢途径效率的一个重要因素。通过人工合成蛋白质骨架的技术,使酶按照特定的空间位置锚定在骨架上,可以使相关的酶聚集在特定的区域,增加了酶与底物的结合概率,进而提高产物合成速率[18]。另外,蛋白质骨架也可以调节酶的催化效率,获得最优的催化效率组合,最终提高产物合成效率[19]。利用蛋白骨架技术,Keasling 团队将甲羟戊酸合成途径的三个酶组装到蛋白质骨架上,将甲羟戊酸产量提高了77 倍[19]。近来,香港中文大学和武汉大学团队,利用RⅠAD和RⅠDD 短肽,将途径中的多个酶按不同数量进行连接和组装,构建出多酶复合体,能快速提高萜类化合物合成途径的效率,并在酿酒酵母产番茄红素细胞工厂中得到验证[20]。
1.4 基因动态调控技术
细胞内的代谢活动是一个复杂而精密的动态过程,传统的诱导型或固定强度启动子虽然可以实现转录水平的调控,但外源代谢途径往往会对细胞生长造成干扰,如有毒中间产物积累。另外,基因表达太弱又难以得到产物。因此,基因动态调控技术受到越来越多的关注。基因动态调控技术的基本思路是:设计人工基因回路,使细胞能够感应外部环境条件的变化,在适当时间开启或关闭基因表达从而实现代谢通路的动态调控。已经建立的基因动态调控技术有:环境信号诱导的表达调控系统(如碳源调控系统、光调控系统和温度调控系统等)和内源信号诱导的表达调控系统(如群体感应调控系统和压力感应调控系统)[21]。基因动态调控技术为细胞根据外部环境按需调控目的基因表达强度提供了技术方法。
1.5 高通量筛选技术
细胞工厂的快速构建离不开高通量筛选技术的助力。高通量筛选实验的成功,依赖于恰当的实验设计、良好的分析方法和质量控制方法,通过获取可靠的测量值并选择合适的阈值,从而“命中”目标样品[22]。微孔板是常用的高通量筛选试验器具,孔板内发生的生物、化学和物理变化事件可以由多功能酶标仪、流式细胞仪、液相色谱仪和质谱仪等检测仪器连续自动化读取。高通量筛选技术已用于基因调控元件强度分析[23]、酶元件的新活性检测[24]、基因线路的活性检测[25]、天然产物的活性筛选[26]等。可以预见,高通量筛选技术将在元件工程、线路工程、基因组工程、基因编辑和微生物组工程等合成生物学研究的多个层面拓宽研究思路。
2 微生物高效合成化学品的代谢调控机制
要获得一个高效的细胞工厂,就需要从物质代谢、能量代谢和细胞生理代谢三方面深入解析微生物高效合成化学品的代谢调控机制。物质代谢方面,需要研究元件与合成途径的适配机制,解除限速步骤,避免有毒中间代谢物积累,使碳代谢流最大程度地流向目标化学品。能量代谢方面,需解析能量对合成代谢的调控机制,使细胞代谢底物时产生足够的还原力和ATP 去满足化学品合成需求。细胞生理代谢方面,需阐明细胞耐渗透胁迫机制,提高化学品的产量。下面以作者团队在丁二酸细胞工厂上的研究为例,从物质代谢、能量代谢和细胞生理代谢三方面做具体的阐述(图1)。
2.1 物质代谢调控
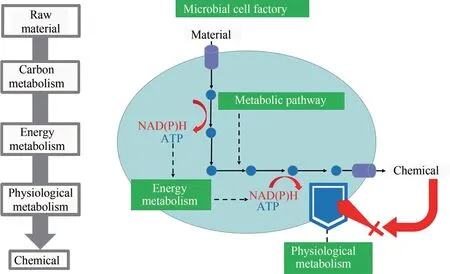
图1 微生物高效合成化学品的代谢调控机制Fig.1 Mechanisms of metabolic regulation for efficient production of chemicals
微生物化学品的合成途径由多步生化反应组成,参与反应的酶元件与合成途径的适配性,影响着产物合成的效率。蛋白酶催化活性太低,成为整条途径的限速步骤;蛋白酶催化活性太高,而下游蛋白催化活性又较低,又会造成中间代谢物的积累。某些中间代谢物甚至对细胞会有较大的毒性,影响细胞的生长。作者团队通过研究丁二酸合成途径中各个酶的活性与丁二酸生产速率之间的相互关系,从合成途径的19 步生化反应中系统解析出4 个限速酶:葡萄糖转运蛋白[27]、磷酸烯醇式丙酮酸羧化酶[28]、丁二酸转运蛋白[29]和转醛酶[30](图2)。优化这4 个酶元件与途径的适配性,构建出了丁二酸高效合成途径。
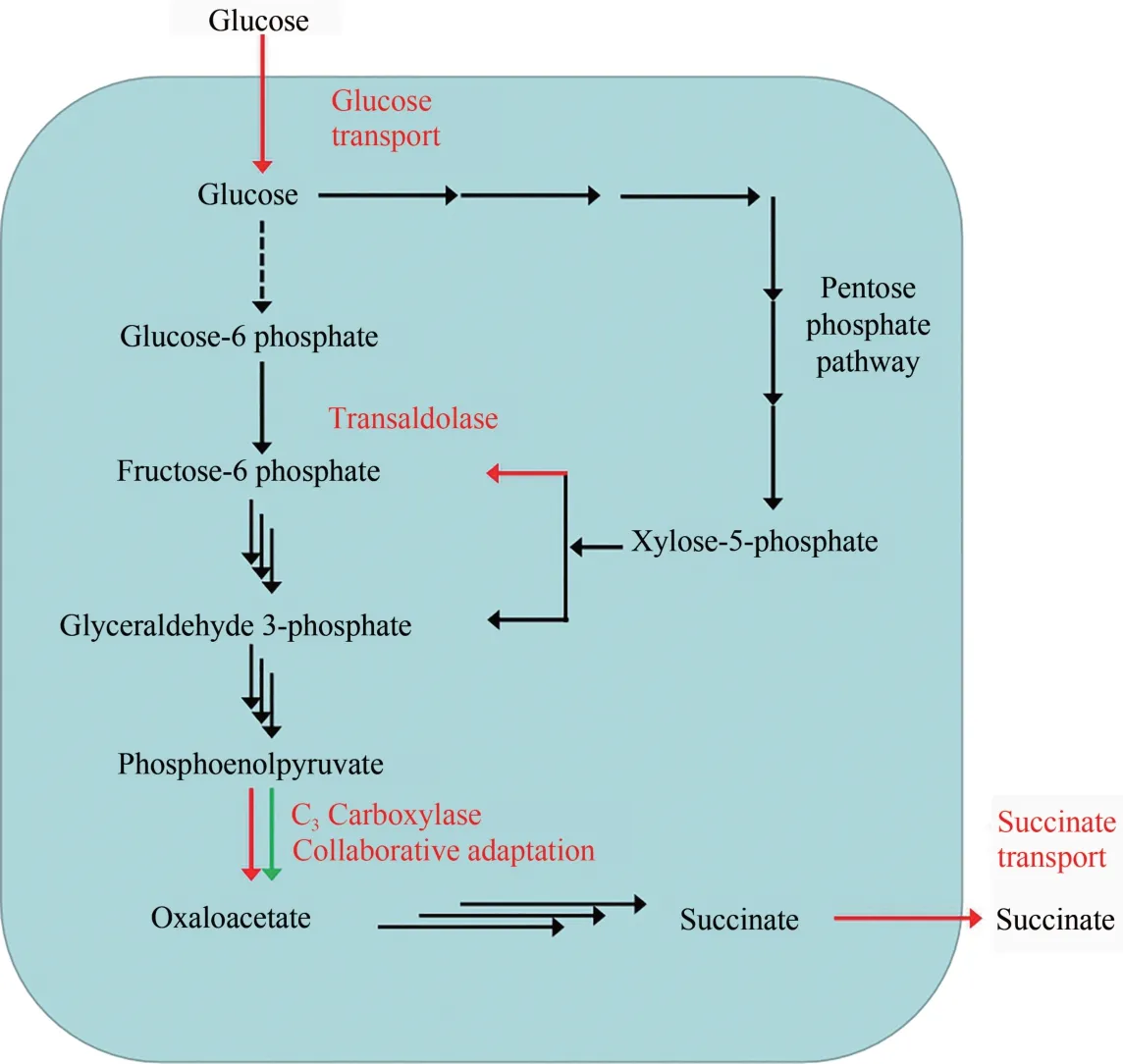
图2 丁二酸合成的4个限速步骤Fig.2 Four rate-limiting steps for synthesis of succinate
2.2 能量代谢调控
还原力和ATP 是能量代谢的关键调控因素。细胞在代谢葡萄糖等底物时产生还原力,在合成化学品时需要还原力。还原力供给量若小于需求量,会影响化学品的转化率和合成途径效率。另外,细胞需产生足够的ATP 供细胞生长和产物合成。
本文作者团队系统研究了丁二酸厌氧合成的能量代谢调控机制。葡萄糖厌氧生产丁二酸的理论转化率为1.71 mol/mol。通过糖酵解途径,大肠杆菌每代谢1 mol 葡萄糖产生2 mol NADH,而合成1.71 mol 丁二酸需要3.42 mol NADH,这导致NADH 供给量与需求量之间的不平衡。为解决这个问题,作者团队设计了一种新的还原力供给模式,用C5磷酸戊糖途径替代C6糖酵解途径,并结合转氢酶,将1 mol 葡萄糖代谢产生的NADH 从2 mol 提高到3.67 mol(图3),满足了丁二酸最大转化率的还原力要求。在实际生产中,将丁二酸的糖酸转化率从1.12 mol/mol 提高到1.61 mol/mol(从理论最大值的65%提高到94%)[31]。
甘油是一种高还原力碳源,用于丁二酸生产有较大优势:1 mol 甘油与1 mol CO2理论上可合成1 mol 丁二酸。但在厌氧条件下,从甘油到丁二酸的合成途径不能产生出足够的ATP,导致丁二酸产量和生产速率相当低。作者团队使用来自克雷伯氏菌的ATP 依赖型二羟基丙酮激酶(DhaK)替代了大肠杆菌原有的PEP 依赖型二羟基丙酮激酶(DhaKLM),在大肠杆菌中构建出一条新的甘油厌氧代谢途径。和原有途径相比,新途径能产生质子动力势为细胞生长和丁二酸外排提供额外能量。丁二酸产量、比生产速率和胞内ATP含量分别增加了282%、63%和338%[32]。利用质子动力势提高ATP供给也为途径中能量代谢调控提供了思路(图4)。

图3 调控葡萄糖能量代谢模式解决丁二酸合成中的还原力问题Fig.3 Regulation of glucose energy metabolism to solve reducing equivalent problem for synthesis of succinate
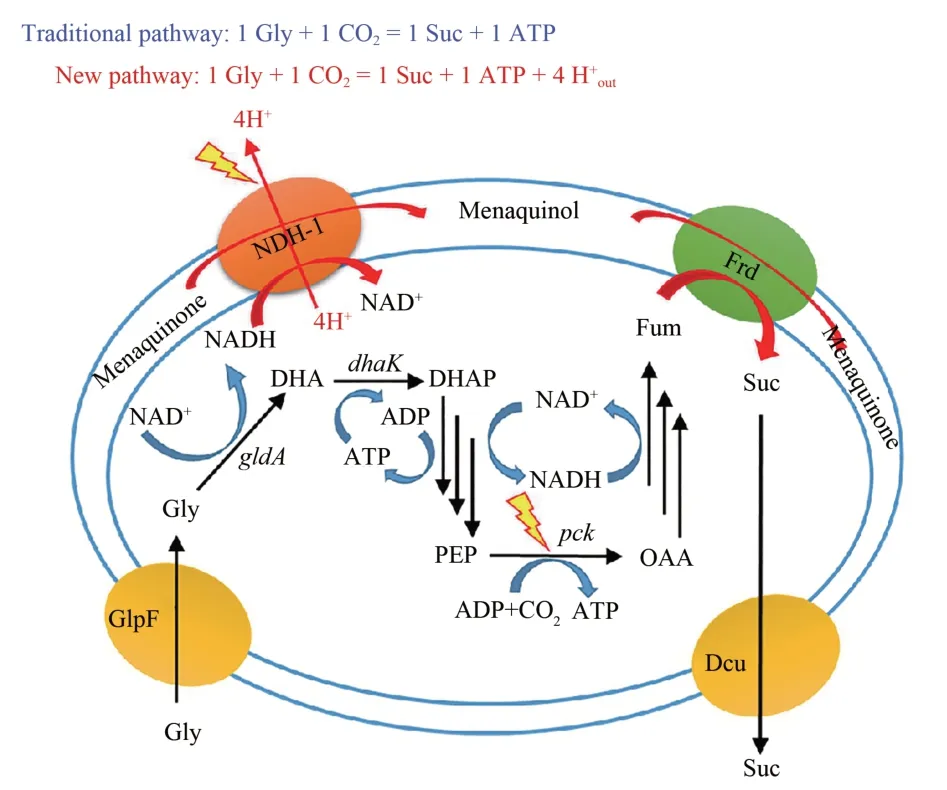
图4 调控甘油能量代谢模式解决丁二酸合成中的能量问题Fig.4 Regulation of glycerol energy metabolism to solve energy problem for synthesis of succinate
2.3 细胞生理代谢调控
优越的细胞生理性能是获得高效细胞工厂的关键因素之一。耐渗透胁迫是细胞生理性能的重要方面。对于分泌到胞外的大宗化学品,产量越高,渗透胁迫越大,细胞需具备耐渗透胁迫能力才能获得高产量。作者团队在丁二酸细胞工厂中发现了大肠杆菌细胞耐渗透胁迫的一种新机制。高渗透胁迫在厌氧条件下造成胞内Cu(Ⅰ)的积累,对Fe-S 簇生物合成机器和含Fe-S 簇的重要代谢酶具有很大的破坏性,导致细胞在生理和代谢层次的全局紊乱。cusCFBA基因簇的激活能提升细胞外排Cu(Ⅰ)的能力,使细胞具备更强的耐渗透胁迫能力。外源添加Cu(Ⅰ)螯合剂含硫氨基酸(甲硫氨酸或半胱氨酸)也能提高大肠杆菌细胞的耐渗透胁迫能力[33](图5)。该研究是首次发现含硫氨基酸可作为厌氧条件下的渗透保护物质,为提升细胞耐渗透能力提供了一种新思路。
3 大宗化学品生物制造的具体案例
利用上述的技术路线和策略,国内外研究人员构建出了一系列的微生物细胞工厂,实现了多种大宗化学品的生物制造。本文将对氨基酸、有机酸和有机醇三类大宗化学品细胞工厂进行阐述。
3.1 氨基酸
L-丙氨酸不仅是一种重要的氨基酸,还是重要的平台化学品。用于生产新型环保无磷螯合剂甲基甘氨酸二乙酸(MGDA)、维生素B6和氨基丙醇等,全球市场容量约5 万吨/年。作者团队通过合成途径的设计与构建,代谢进化及细胞性能优化,构建出了能够将葡萄糖高效转化为L-丙氨酸的细胞工厂[34],在250 m3发酵罐中,发酵40 h,产量达155 g/L,糖酸转化率高达95%。目前利用该技术在安徽华恒生物科技股份有限公司建成年产2.6 万吨L-丙氨酸的生产线,在国际上首先实现发酵法L-丙氨酸的产业化,生产成本比传统技术降低50%以上。L-丙氨酸生产成本的降低,促进了下游产品MGDA 的应用。目前MGDA 全球需求量约16 万吨,预计未来3~5 年全球MGDA 市场将以约22%的年复合增长率保持增长趋势,进而将带动L-丙氨酸需求的不断增加。MGDA 的推广应用对保护水体生态环境意义重大[1]。该案例是国际上首个成功实现产业化的厌氧发酵氨基酸品种,大幅减少资源和能源消耗,有效降低产品成本,并实现生产过程二氧化碳零放排。除L-丙氨酸以外,作者团队与华恒生物公司以相同的思路开发出L-缬氨酸厌氧发酵技术,推动我国氨基酸产品在厌氧发酵领域的进一步发展。
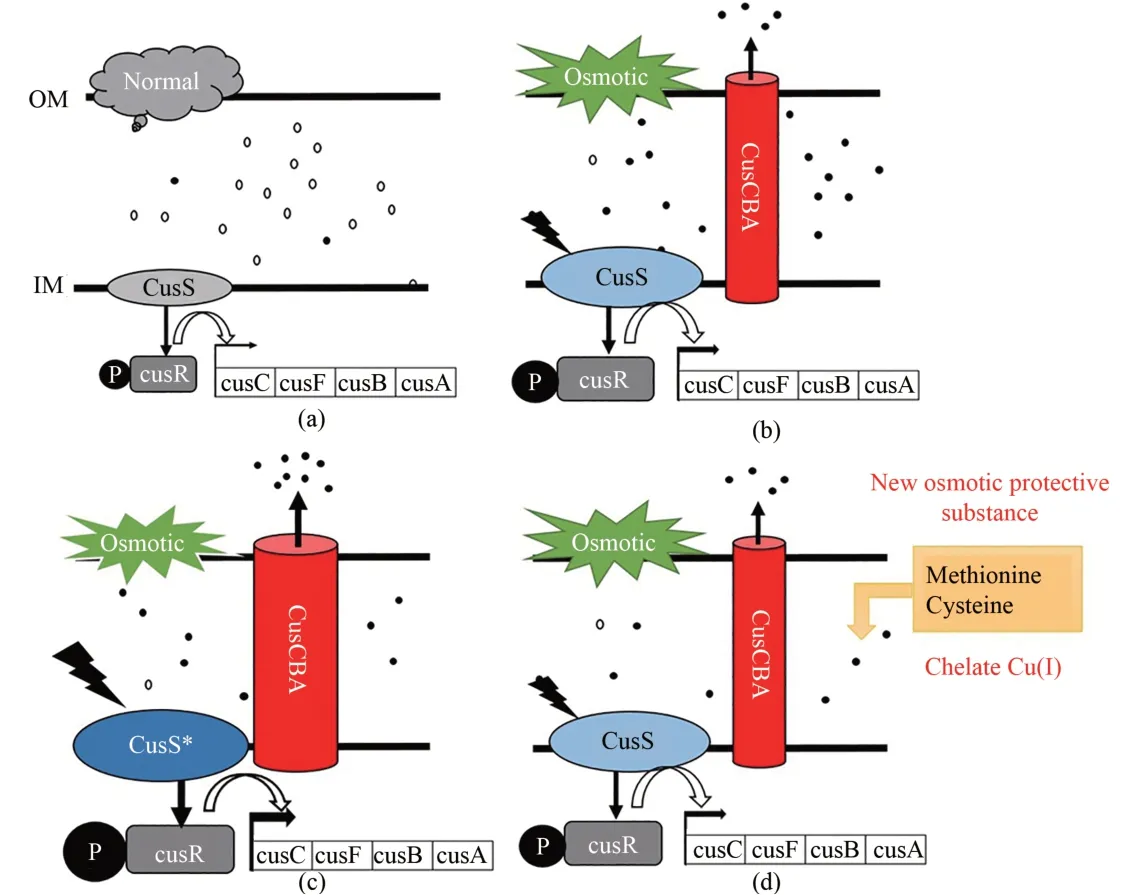
图5 大肠杆菌细胞耐渗透胁迫的新机制Fig.5 New osmotolerance mechanism of Escherichia coli
L-甲硫氨酸是人体必需氨基酸,在食品、医药及饲料添加剂方面有广泛应用。工业上主要通过化学法合成DL-甲硫氨酸,存在环境污染、分离困难等问题。韩国希杰集团拥有成熟的生物法制备L-甲硫氨酸技术,其与阿克玛共同投资4.5 亿美元在马来西亚建设世界首个生物L-甲硫氨酸工厂,产能达8 万吨[35],其生产的L-甲硫氨酸比化学法合成的DL-甲硫氨酸的生物利用率提高了20%~40%[36]。浙江工业大学采用系统分析的策略[37],上调或抑制了中央代谢和氨基酸合成途径中的80个基因,探究了它们对积累L-甲硫氨酸的影响,并以此优化了L-甲硫氨酸的代谢途径,最优菌株补料分批发酵48 h 产16.86 g/L 的L-甲硫氨酸。该研究探究了L-甲硫氨酸的生产瓶颈,对L-甲硫氨酸的发酵生产有很大的指导意义。
3.2 有机酸
丁二酸是一种重要的平台化合物,与其还原产物1,4-丁二醇聚合可生成重要的生物降解塑料聚丁二酸丁二醇酯(PBS),全球潜在市场达160亿美元/年。目前其生产方式是以顺酐为原料的石化路线。作者团队通过对丁二酸合成途径进行设计、调控和性能优化,在产业化生产中将糖酸转化率提高至1.02 g/g。在山东兰典生物科技股份有限公司成功应用,已建成年产2 万吨的生产线,在国内首次实现了发酵法生产丁二酸的产业化,成本与传统石化路线相比降低了20%。该技术对降低丁二酸成本,促进PBS 可降解塑料产业实践具有重要意义[1]。
D-乳酸(光学纯度99.5%以上)是合成聚乳酸的关键原料。作者团队以大肠杆菌为底盘细胞,使D-乳酸成为厌氧条件下丙酮酸代谢的唯一途径,并通过进化代谢的方法构建出高效生产高光学纯度D-乳酸的大肠杆菌细胞工厂。该技术在山东寿光巨能金玉米得到产业化应用,D-乳酸光学纯度超99.5%。建成了年产1 万吨D-乳酸的生产线,在国内首次实现发酵法D-乳酸的产业化。该技术对降低高光纯度D-乳酸成本,促进聚乳酸可降解塑料产业推广具有重要意义[1]。
丙二酸是高价值的化学品,主要用于医药、特种材料和香料,丙二酸及衍生化学品的市场规模超过10 亿美元。石化法生产丙二酸需要氯乙酸和氰化钠,成本高且污染环境。Lygos 公司开发了一种丙二酸的发酵生产技术,利用蛋白质工程的方法,获得了高活性丙二酰辅酶A水解酶,能将丙二酰辅酶A催化为丙二酸,优化合成途径后,最终获得的高效的酵母细胞工厂,丙二酸产量可达100 g/L 以上。该技术成功实现了丙二酸的大规模发酵法生产[38],对环境污染少,生产成本显著低于石化法。
L-苹果酸是一种重要的有机酸,可作为酸味剂,添加在食品中有防腐的作用。传统的苹果酸生产主要基于石油基化工路线,产品为DL-苹果酸,应用范围有限。微生物发酵能生产高光学纯度的L-苹果酸,与DL-苹果酸相比利用率更高。目前,丝状真菌是合成苹果酸的主要微生物,诺维信公司从米曲霉出发,强化了还原型TCA 途径和苹果酸转运,发酵产L-苹果酸产量可达154 g/L,转化率1.03 g/g[39]。然而,丝状真菌发酵需要以葡萄糖或甘油为碳源导致原料成本高;需常温(28~37 ℃),要进行冷凝处理导致能源成本高。针对这些问题,中国科学院天津工业生物技术研究所从能够耐高温且能以纤维素为原料的嗜热毁丝霉菌出发,构建了可在45 ℃高温条件下发酵产L-苹果酸的细胞工厂。在底物利用方面,不仅可以利用葡萄糖高效发酵合成L-苹果酸,还可以直接利用纤维素和半纤维素,产量超过180 g/L。这种新的L-苹果酸细胞工厂能高温发酵,能利用多种底物,显著降低了成本,具有广阔的应用前景。
戊二酸是一种重要的五碳平台化合物,可用于合成聚酯和聚酰胺。北京化工大学设计了新的戊二酸合成途径,利用大肠杆菌自身的赖氨酸降解途径合成戊二酸,将降解途径中伴生的L-谷氨酸和NAD(P)H 回补于赖氨酸合成途径。辅因子被循环利用,形成强大的代谢驱动力,使代谢流最大程度地流向戊二酸合成途径。优化天然转运蛋白的表达,解决了中间产物尸胺和5-氨基戊酸的胞外积累问题。最终获得的戊二酸细胞工厂,在补料发酵的条件下产量达54.5 g/L,转化率0.54 mol/mol,这是目前报道的大肠杆菌产戊二酸的最高水平[40]。
己二酸是一种六碳二元羧酸,主要用于合成尼龙66、尼龙56 等尼龙纤维。己二酸的化工生产路线主要是硝酸氧化法(KA 油法),但环境污染严重。在生物合成方面,美国Ⅴerdezyne 公司、荷兰DSM 公司和美国Genomatica 公司都在积极开展生物合成己二酸项目。江南大学将嗜热裂胞菌Thermobifida fusca中的己二酸降解途径反转为己二酸合成途径,己二酸的产量达到了0.36 g/L。进一步确定了该途径的关键限速酶为5-羧基-2-戊酰-CoA 还原酶,通过进一步的代谢调控,最终获得了己二酸细胞工厂,利用甘油发酵生产,产量达68 g/L[41]。
3.3 有机醇
1,3-丙二醇(PDO)是一种重要的化工材料,其与对苯二甲酸缩聚而成的对苯二甲酸丙二醇酯(PTT)是一种性能优异的新型材料,不仅生物可降解,还具有涤纶的抗污性、腈纶的蓬松性和尼龙的弹性等特点。美国杜邦公司设计并构建了以葡萄糖为原料生产1,3-丙二醇的细胞工厂,将来自酿酒酵母的甘油合成途径和来自克雷伯氏菌的1,3-丙二醇合成途径导入大肠杆菌中,减少进入TCA 循环的碳代谢流,促进葡萄糖向甘油代谢,显著提高了PDO 的转化率,1,3-丙二醇产量达135 g/L, 生 产 速 率 达3.5 g(/L·h), 转 化 率 达1.21 mol/mol[42]。与传统的石油化工路线相比,杜邦公司的1,3-丙二醇生产技术的能耗降低了40%,二氧化碳排放降低了40%。
1,4-丁二醇(1,4-BDO)主要用于制造聚酯和氨纶,每年的需求量达200万吨。自然界中尚未发现1,4-丁二醇的合成途径。Genomatica公司根据已知化合物官能团的转换,计算出10 000 种可能的1,4-BDO 合成途径。并基于操作可行性筛选出两种最优的1,4-BDO 合成途径,在此基础上,在大肠杆菌中整合进多种不同来源的基因进而构建出1,4-BDO 的合成途径,1,4-BDO 产量初步达到18 g/L[43]。通过进一步的调控,1,4-BDO 产量提升至200 g/L[44]。
异丁醇作为一种含有四个碳原子的高级醇,广泛应用于食品、化学和药品等工业领域。由于异丁醇有高能量密度、较小的挥发和腐蚀性、较高的辛烷值等特点,是一种优秀的燃油添加剂。利用氨基酸(缬氨酸、亮氨酸和异亮氨酸)合成途径的中间代谢物2-酮酸,在大肠中引入外源的2-酮酸脱羧酶(KDC)和醇脱氢酶(ADH),即可将不同碳链的酮酸中间物转化为相应的长链醇。加州大学洛杉矶分校利用2-酮酸和Ehrilich 途径构建和优化了异丁醇合成途径。最终获得的细胞工厂在微氧条件下,112 h异丁醇产量达到23g/L;进一步采用原位汽提技术,减小异丁醇对细胞的毒性,72 h异丁醇的产量高达50g/L[45]。
4 总结与展望
细胞工厂现有的发展多是基于自然界中已有生物合成途径的化学品。然而,绝大部分化学品是没有天然生物合成途径的,这给生物制造产业发展带来了极大的挑战。酶是细胞完成代谢催化的基本功能单元,是细胞工厂构建的源泉。为了获得所需要的功能基因,科学家们发展出了从蛋白质非理性设计到半理性设计再到理性设计的蛋白质设计改造技术,来获得具有催化新功能的酶元件。蛋白质非理性设计作为最早的蛋白质进化方法,其并不需要事先了解蛋白结构信息和催化机制,通过位点饱和突变、易错PCR 及DNA shuffling 等技术建立文库并筛选特定性状提高的突变体,重复数轮积累有益突变最终获得性能改进或具有新功能的酶[46]。随着对蛋白质结构和功能的理解,并借助蛋白保守位点和晶体结构分析,科学家们开发出半理性设计技术,通过预测一些蛋白的突变靶点,构建具有针对性的突变体文库,减少工作量。该技术广泛应用于酶的立体/区域选择性、稳定性和催化活性的改造[47],例如对P450-BM3 单加氧酶进行改造,使其与醇脱氢酶或过氧化物酶偶联用于手型二醇及衍生物的催化合成[48]。
蛋白质从头设计于2016 年被Science杂质列入年度十大科学突破[49],目标是创造自然界不存在的并具有特定功能的酶。其中最有影响力的David Baker团队开发的Rosetta软件是目前最强大的蛋白质设计软件,该软件集蛋白质从头设计、酶活性中心设计、配体对接、生物大分子计算建模与分析于一身[50]。目前已有很多具有重要生物功能的新酶被设计出来,如以二氧化碳为碳源合成羟基丙酮的关键催化酶[51]、催化羟醛缩合反应(retroaldol reaction)和狄尔斯-阿尔德反应(Diles-Alder reaction)的新酶[52-53]。中科院天津工业生物技术研究所、中科院微生物所和山东大学团队合作,设计并创造了乙醇醛合酶, 继而创造了一个合成乙酰辅酶A 的碳一(甲醛)代谢途径[54]。中科院微生物所从新酶设计催化的角度实现了β-丙氨酸的生物合成。将来源于Bacillussp.YM55-1 的天冬氨酸酶用计算机重新设计,改变底物的偏好性,不以天冬氨酸为底物而以烯酸为底物,得到一系列位置选择性与立体选择性的人工β-氨基酸合成酶[55],其中以丙烯酸为底物的β-氨基酸合成酶被用于β-丙氨酸的合成。该技术已与安徽华恒生物股份有限公司合作,实现了产业化生产。
随着新酶设计能力的不断提高,我们希望细胞工厂能像化学合成一样,基本实现所有化学品的生物合成。同时,也希望通过合成生物学技术的辅助,让越来越多化学品细胞工厂的生物制造成本不断降低,与石化制造路线相比更有竞争力。

