PI-RADS v2.1 联合PSA 密度对有临床意义前列腺癌的预测价值
丁志广 钟淑媛 魏晓婷 胡根文 邹锦森 成志强 徐坚民
众多研究已证实多参数磁共振成像的前列腺影像报告和数据系统第2 版(Prostate Imaging Reporting and Data System version 2,PI-RADS v2)的临床应用价值,同时也发现一些不足和局限性[1-3]。2019 年PI-RADS 指导委员会对PI-RADS v2 进行若干修改后推出PI-RADS v2.1,并鼓励对其临床价值和局限性开展研究[4]。PI-RADS 的目的是检出有临床意义前列腺癌(clinically significant prostate cancer,CsPCa)[5],但其未结合临床指标。本研究采用PI-RADS v2.1 评分结合临床指标,以建立穿刺结果的预测模型,评估预测模型对穿刺结果的预测价值并进行风险分层。
资料与方法
1.一般资料
回顾性收集深圳市人民医院(暨南大学第二临床医学院)2018 年1 月~2019 年6 月因排尿困难、尿频、尿急、前列腺特异性抗原(prostate specific antigen,PSA)水平升高(PSA 取距离MRI 检查最近的一次)或直肠指检异常疑似前列腺病变且行MRI检查和穿刺活检的患者348 例。纳入标准:行多参数磁共振检查(multiparametric magnetic resonance imaging,mp-MRI),检查后3 个月内首次经直肠超声(transrectal ultrasound,TRUS)引导下进行穿刺活检;排除标准:(1)缺乏完整病例资料或MRI 扫描参数不同者;(2)具有经尿道前列腺电切史者;(3)过去2 周内因尿路感染、尿潴留而留置导尿管者;(4)患者配合差或MRI 图像有明显伪影,无法行PI-RADS v2.1 评分;(5)前列腺癌骨转移或邻近脏器侵犯;(6)MRI 检查前已行内分泌治疗、放疗及手术治疗。根据该标准,最终入组243 例,排除105 例中包括17 例缺乏完整的临床资料或穿刺活检时间与MRI 检查时间超过3 个月,11 例曾有前列腺电切术或膀胱手术病史,41 例导尿管留置,13 例有骨转移或邻近脏器侵犯,23 例只行双参数MRI 检查或图像质量不佳。
2.扫描方法与参数
根据PI-RADS v2.1 推荐的T2WI、T1WI、扩散加权(diffusion weighted imaging,DWI)和动态增强MRI(dynamic contrast-enhanced-MRI,DEC-MRI)行3.0 T 磁共振成像(Siemens Skyra),采用18 通道体部矩阵线圈,嘱患者少量留尿,以耻骨联合上方约1 cm 处为中心进行扫描,扫描范围至少包括前列腺及精囊,层厚3.5 mm,层间距0 mm,层数20 层。T2WI 含横断位、矢状位及冠状位,采用快速SE 自旋回波序列(TR 6100 ms,TE 101 ms);DWI 的b 值为50、800、1500 s/mm2,采用单次激发自旋回波平面回波成像(single short echo planar imaging,SS-EPI)序列(TR 4200 ms,TE 74 ms,并排采集加速因子2,相位编码方向为前后方向);DCE-MRI采用3D 扰相梯度回波的T1WI 抑脂成像序列(TR 4.32 ms,TE 1.99 ms,并排采集加速因子2),单次序列采集扫描时间14 s。经静脉快速团注钆喷替酸葡甲胺0.2 mmol/kg。
3.图像分析
在未知病理结果的情况下由两名放射科医生(分别具有2 年和15 年以上的前列腺疾病MRI诊断经验)采用盲法在PACS 系统上对每个病例予以1 至5 分的评分。评分标准依照PI-RADS v2.1。当评分不一致时,两位医师协商得出最终得分。对多灶性病变,以PI-RADS v2.1 最高分值作为最终评分。前列腺测量:在T2WI 正中矢状位上测量前列腺的最大纵径和前后径,在轴位上测量最大横径,前列腺体积(prostate volume,PV)=最大左右径×最大前后径×最大上下径×0.52;前列腺特异性抗原密度(prostate-specific antigen density,PSAD)值=PSA/PV。
4.穿刺活检、组织病理学和分组
mp-MRI 检查后3 个月内在直肠超声引导下进行12 针前列腺系统穿刺活检,并在TRUS-MRI融合图像引导下对mp-MRI 上可疑病灶或不确定病灶加穿1~2 针,由1 名泌尿专业的超声科副主任医师及1 名泌尿科主治医师共同完成,穿刺针为针突22 mm 的TSK-18G 全自动型活检针,将每针穿刺的组织独立装瓶、标记,活检组织用10%甲醛溶液固定;由1 名病理科副主任医师对穿刺的组织进行病理诊断和Gleason 评分(Gleason score,GS),以穿刺活检中GS 评分最高的一针为最终病理诊断。CsPCa 定义为GS≥3+4。将入组病例分为CsPCa 组与非CsPCa 组,非CsPCa 包括前列腺增生(benign prostate hyperplasia,BPH)和无临床意义前列腺癌(clinically insignificant prostate cancer,CisPCa),即GS≤6 分。
5.统计学分析
统计分析采用SPSS 23.0、MedCalc 15.2.2 及R 语言6.3.5。将PI-RADS v2.1 评分和临床指标纳入单因素分析,临床指标包括年龄、PSA、游离PSA/总PSA(free PSA/total PSA,fPSA/tPSA)、PV 及PSAD;由于临床医生描述的主观性和少数病例资料的缺失,直肠指检未被纳入。对上述资料进行正态性检验,对符合正态分布的采用独立样本t 检验进行单因素分析,以±s 表示;对不符合的使用Mann-Whitney U 检验进行单因素分析,以中位数(上下四分位数)表示;评估各个指标在CsPCa 组及非CsPCa 组间的差异,将差异有统计学意义的指标作为危险因子,用Logistic 回归行多因素分析,确定独立危险因子,联合独立危险因子建立CsPCa 的预测模型;绘制各独立危险因子与联合预测模型的受试者工作特征(receiver operating characteristic,ROC)曲线并比较曲线下面积(area under curve,AUC),评估其诊断效能。校准曲线用于评估模型绝对风险预测值的准确性,决策曲线评估预测模型的净效益。对独立危险因子进行等级划分和组合,以作穿刺前CsPCa 的风险分层与评估。
结果
基线研究及单因素研究:243 例患者纳入本研究,CsPCa 57 例(GS 等于7 分30 例,8 分12 例,9 分14 例,10 分1 例),非CsPCa 186 例(CisPCa 21 例,BPH 165 例);PI-RADS v2.1 评分结果显示PI-RADS 1~2 分130 例(53.50%),PI-RADS 等于3 分45 例(18.52%),PI-RADS4~5 分68 例(27.98%),典型病例如图1~4。单因素分析显示PI-RADS v2.1 评分、年龄、PSA、fPSA/tPSA、PV 及PSAD 在CsPCa 组与非CsPCa 组之间差异均具有统计学意义(P<0.05)(表1);绘制上述有统计学意义指标的ROC 曲线,计算其AUC 值,得出相应AUC 值分别为0.934、0.588、0.738、0.733、0.719 和0.845,各指标的敏感度、特异度、阳性预测值及阴性预测值,如表2 所示。
多因素分析与联合独立危险因子预测模型:对CsPCa 组与非CsPCa 组间差异有统计学意义的指标进行多因素Logistic 回归分析,结果显示PIRADS v2.1 评分(OR:7.816,95%CI:4.383~13.936,P<0.001)和PSAD(OR:8.188,95%CI:2.558~26.204,P<0.001)是CsPCa 的独立危险因子,截断值分别为4 和0.17 ng/ml2。把独立危险因子作为自变量,穿刺结果为因变量,联合独立危险因子建立预测CsPCa的Logistic 回归模型,该模型的敏感度91.23%,特异度88.71%,阳性预测值71.2%,阴性预测值97.1%,其AUC 值为0.959(P<0.0001,95%CI:0.926~0.980),高于PI-RADS v2.1 和PSAD 的AUC 值,且差异有统计学意义(Z=3.062、4.222,P<0.05)(图4)。联合独立危险因子的Logistic 回归模型为:
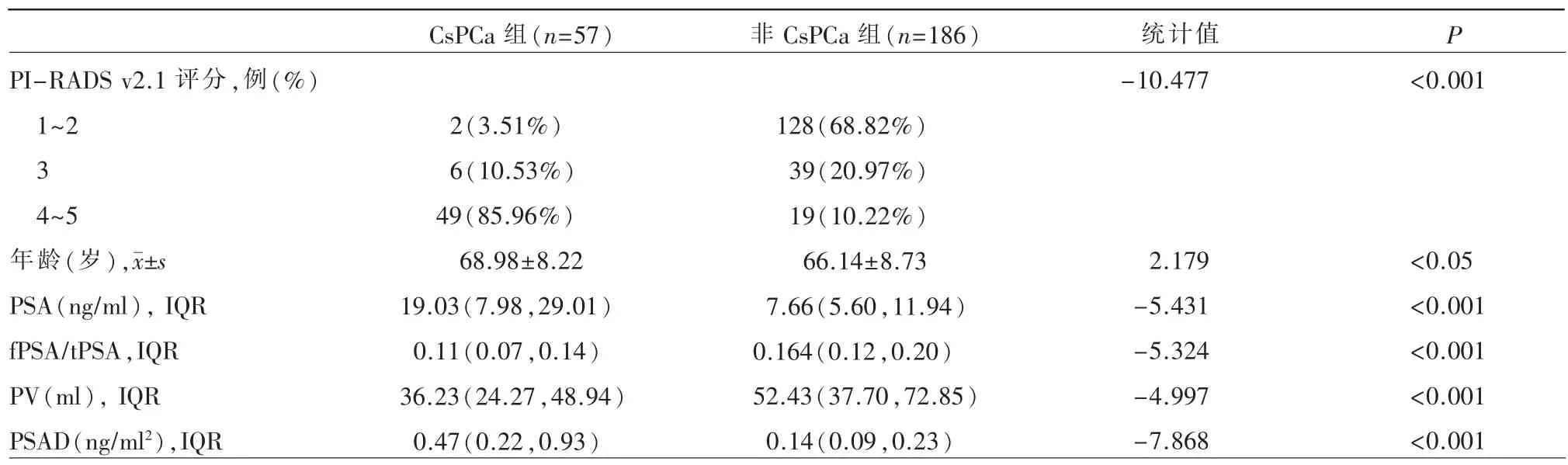
表1 CsPCa 组与非CsPCa 组间各单因素比较
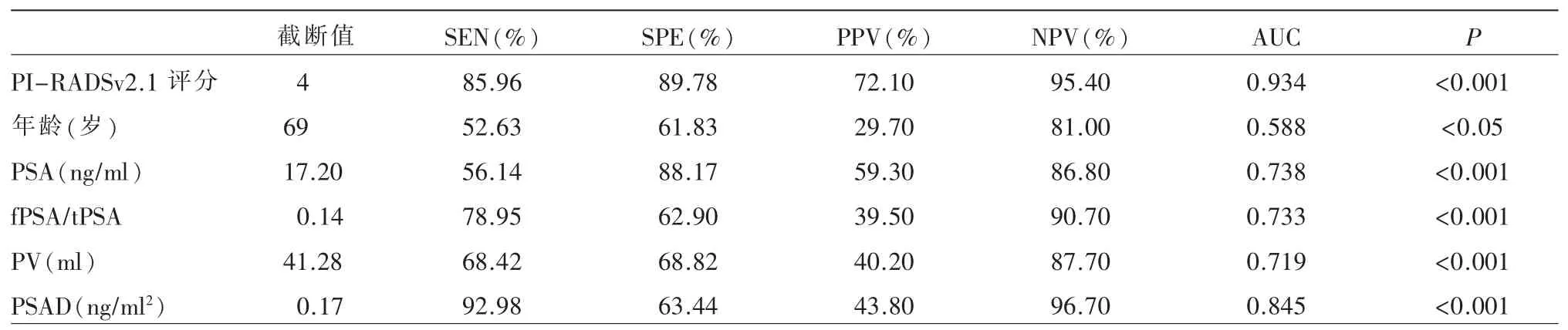
表2 各危险因子对CsPCa 的独立诊断效能
Logit(P)=-8.915+2.056×PI-RADS v2.1 评分+2.103×PSAD
联合预测模型的校准曲线及决策曲线:校准曲线评价联合预测模型的校准度。检验联合预测模型的校准度,结果显示模型具有良好的校准度,平均绝对误差为0.008(图5)。决策曲线显示当风险阈值大于等于0.05 时该预测模型就能获得净收益(图6),且优于PI-RADS v2.1 和PSAD。
风险分层与评估:根据本组PSAD 的最佳截断值,将PSAD 值分为3 个风险等级,小于0.17 ng/ml2、0.17~0.27 ng/ml2、大于0.27 ng/ml2;将PI-RADS v2.1 评分也分为3 个风险等级,即1~2 分、3 分、4~5 分。将二者风险等级进行组合绘制预测CsPCa穿刺结果的风险分层图,显示对应区域CsPCa 的阳性率(表3)。当PI-RADS v2.1 评分小于等于2且PSAD 小于等于0.27 ng/ml2或PI-RADS v2.1评分为3 且PSAD 小于0.17 ng/ml2时,为一低风险区,CsPCa 阳性率为0%;当PI-RADS v2.1 评分为3 且PSAD 大于0.27 ng/ml2或PI-RADS v2.1得分大于等于4 且PSAD 大于等于0.17 ng/ml2时为一相对高风险区,CsPCa 阳性率大于30%。
讨论
与PI-RADS v2.0 评分相比,2.1 是在其基础上进行一些标准的修改,放宽了一些帮助较小的要求与建议,更新了部分技术的要求和解释。其主要的变化是针对2 分和3 分的评分细则进行修订,对前列腺的体积测量也做了明确的说明[6],因此,PI-RADS v2.1 是一种更简单、更直接、可重复性更好的评估方法,有利于医生之间对MRI 上前列腺病灶的评估进行沟通,但PI-RADS v2.1 并没有改变v2.0 评分系统的总体范围和原则,所以PI-RADS v2.1 并不是v2.0 的升级版[7]。
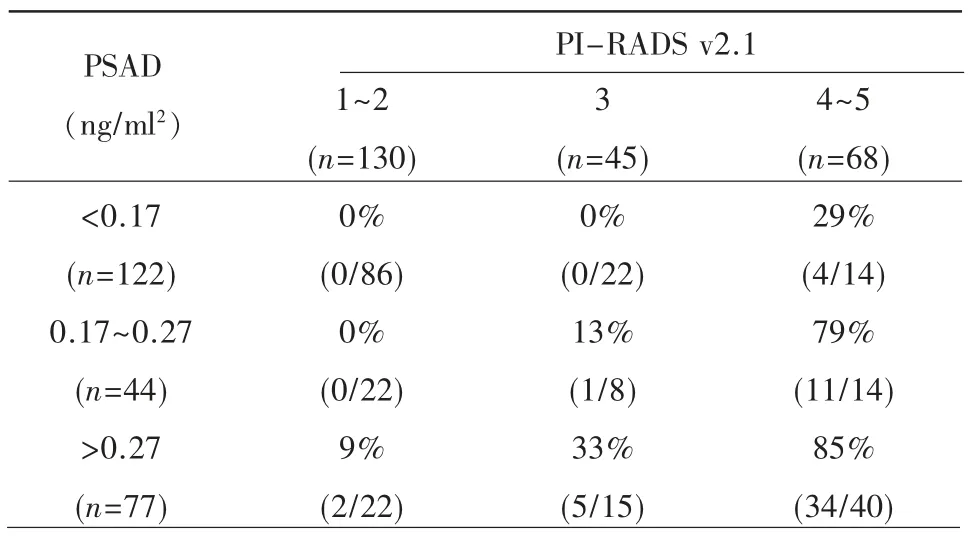
表3 PI-RADS v2.1 评分联合PSAD 分组对CsPCa 的分层
PI-RADS v2.1 评分仍侧重于mp-MRI 图像的解读和推测发生CsPCa 的概率,并不包含临床指标和管理建议,特别当PI-RADS v2.1 评分3 分时,面临进行穿刺还是进行主动监测的选择[8,9],因此,PI-RADS 评分仍未能完全转化为临床实践,即不能单纯的依靠其评分决定是否进行前列腺穿刺[7,10]。联合某些临床指标或基因生物学标记,提高其穿刺结果的预测效能并进行风险评估,对临床穿刺前的决策更具有实际意义[11,12]。
本研究显示PI-RADS v2.1 评分、年龄、PSA、fPSA/tPSA、PV 及PSAD 均为CsPCa 危险因子,其中PI-RADS v2.1 评分及PSAD 是CsPCa 独立危险因子,且AUC 高于其他危险因子。PI-RADS v2.1 大于等于4 分时诊断CsPCa 敏感度和特异度均较高,分别为85.96%和89.78%,阳性和阴性预测值为72.1%和95.4%,显示单独应用PI-RADS v2.1 具有良好的预测价值,与既往研究相符[13,14],但当PI-RADS v2.1 为3 分时,病变难以定性诊断,是否决定穿刺就显得困难[15]。PSAD 作为临床生物标记物的应用,近年来受到关注,其较PSA 有更好的诊断效能[16]。PSAD 具有较高敏感度但其特异度较低。既往文献对PSAD 的取值有所差异,有些文献是将PSA 大于50 或100 ng/ml 去除,有些文献则把所有PSA 值纳入研究,这些都会直接影响PSAD 截断值,继而影响联合预测模型得出的风险概率[17-19]。本研究样本为2018 年1 月~2019 年6 月间在我院经穿刺活检并进行过MRI 检查的病例,将可能导致PSA 值异常而影响模型准确性的原因排除在外。通常认为对临床决策有帮助的PSAD阈值为0.15 ng/ml2[20,21],本组资料的PSAD 截断值为0.17 ng/ml2,其敏感度高(92.98%),特异度较低(63.44%)。为了提高穿刺结果的预测效能,本研究联合独立危险因子建立CsPCa 的Logistic 回归预测模型,该模型的敏感度91.23%,特异度88.71%,AUC 值为0.959,其预测效能优于单独应用PI-RADS v2.1 和PSAD。校准曲线显示预测模型实际发生率和预测发生率拟合度良好,决策曲线显示当风险阈值大于等于0.05 时就能获得净收益,表明联合独立危险因子的预测模型对CsPCa 有更好的预测价值。
联合独立危险因子建立的预测模型在实际临床应用中较为繁琐。为了更简便地预测穿刺结果并进行相应穿刺决策,利用PI-RADS v2.1 评分和PSAD 值的组合划分风险等级并构建风险分层图,可以直观地显示预测穿刺为CsPCa 的概率。当PI-RADS v2.1 评分小于等于2 且PSAD 小于等于0.27 ng/ml2或PI-RADS v2.1 评分为3 且PSAD 小于0.17 ng/ml2时,为一个低风险区,穿刺结果为CsPCa 概率极低,可以进行适当的主动监测,避免不必要的穿刺;当PI-RADS v2.1 评分为3 且PSAD 大于0.27 ng/ml2或PI-RADS v2.1 评分大于等于4 且PSAD 大于等于0.17 ng/ml2时为一个相对高风险区,CsPCa 阳性率大于30%,该范围内患者建议及时穿刺活栓以明确诊断,进行穿刺活检;两者间的范围内为中风险区,CsPCa 的阳性率小于30%。与单纯应用PI-RADS v2.1 评分相比,如评分为大于等于4 分时才决定穿刺活检,本组病例将漏诊14%的CsPCa,对于评分为3 分的患者,联合PSAD 有助于临床穿刺决策。
局限性:(1)本研究为回顾性研究且病理结果通过穿刺获得,非前列腺根治术后标本的大切片病理,可能导致部分假阴性;(2)PI-RADS v2.1 评分是取外周带及移行带病灶中的最高评分,没有对CsPCa 的风险进行分区预测;(3)本研究为单个中心研究结果,尚需进一步外部验证。
综上所述,PI-RADS v2.1 评分与PSAD 联合预测模型对CsPCa 穿刺结果的预测具有重要价值,将二者等级划分和组合有助于穿刺前CsPCa的风险评估和决策。