海水循环水系统中环境因子对大西洋鲑体内土腥味物质含量的影响*
魏发奕, 韩 萃, 李 丽,2**, 董双林,2, 高勤峰,2
(1.海水养殖教育部重点实验(中国海洋大学),山东 青岛 266003;2.青岛海洋科学与技术试点国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266237)
大西洋鲑(Salmosalar)俗称三文鱼,其肉质鲜美,富含优质蛋白和人体所需多不饱和脂肪酸,具有较高的经济价值[1],是世界上重要的养殖种类。我国对三文鱼的需求量大,据挪威海产外贸局预计,中国(含香港)市场在2025年对三文鱼的需求量会突破30万t[2]。当前中国三文鱼主要依赖进口,原因是大西洋鲑属于冷水性鱼类,其最适生长水温为10~18 ℃,然而我国海域水温在夏季过高,普通网箱养殖的大西洋鲑无法顺利度夏[3]。作为一种养殖环境可控的生产模式,封闭式循环水养殖系统(Recirculating aquaculture system,RAS)是大西洋鲑养殖的一种重要方式。
养殖鱼类的土腥味问题给水产养殖业和消费者带来很大困扰[4]。目前认为水体中产生的土腥味物质有5种,其中以土臭素(Geosmin,GSM)和二甲基异冰片(2-methylisoborneol,MIB)最为常见[5-6]。Watson发现水体中GSM和MIB浓度分别达到4和9 ng/L时,就能被人类味觉所识别[7-10]。大西洋鲑作为一种适合生食的鱼类,在食用过程中出现的土腥味更为严重。不同养殖系统其土腥味产生的原因不同,蓝绿藻是室外池塘养殖系统中土腥味的主要来源,而放线菌是室内循环水养殖系统GSM和MIB等土腥味物质的主要来源[11-12]。蓝绿藻和放线菌代谢产生的土腥味物质进入水体,通过皮肤、鳃等组织侵入鱼体,在富含脂肪的组织内富集[13-16]。
此外,前期研究表明,土腥味物质的产生受环境因子的影响。Robertson和Robin认为GSM和MIB在冬季会减少,这可能是因为冬季温度较低,抑制了微生物的代谢[17-18]。Suffet的研究显示,随着温度不断上升以及水质富营养化加重,部分放线菌的代谢水平加剧,GSM和MIB含量不断升高[6]。在循环水系统中尽管土腥味常发生在有机物含量较高的水体中,但有关水质与微生物生长以及与土腥味物质产生的相关性并不清晰。相对于淡水养殖系统,有关土腥味物质在海水循环水养殖系统中的分布和产生机制的研究相对较少。
因此,本研究以室内封闭式海水循环水养殖系统为研究对象,于养殖的不同时期(2018年4月、7月、10月和2019年1月)采集水样和大西洋鲑样品,通过分析比较不同时期养殖系统水质指标、浮游植物群落结构、细菌群落结构和鱼体中土腥味物质含量的差异,揭示海水循环水养殖系统中土腥味产生的机制,为改善我国大西洋鲑养殖环境,提高其品质提供基础资料。
1 材料与方法
1.1 养殖系统与样品获取
实验样品来源于山东某养殖基地,基地车间每个鱼池面积约16 m2,水深3~3.5 m,根据养殖鱼的不同规格来决定放养密度。养殖模式为封闭式循环水养殖系统,日换水量占总水量的10%,循环频率为19次/天,残饵和粪便通过水流旋转聚集到养殖池底部中央并排出鱼池,经沉淀池分离后,养殖水由循环泵上部的出水口流出,经微滤机过滤、蛋白分离后,进入生物滤池,经紫外杀菌后充以液氧保持养殖水体的溶解氧,最后流回到养殖池。
于2018年4月、7月、10月及2019年1月在基地采集水样和大西洋鲑,分别标记为YT1、YT2、YT3和YT4。每批次随机采集大西洋鲑6尾,规格信息见表1。用浓度为260 mg/L的MS-222麻醉大西洋鲑[19],取背肌置于密封袋中,在现场用液氮速冻后放入保温箱(匡途,33L)附以干冰中暂存,带回实验室后置于-80 ℃冰箱中保存。

表1 不同时期采集的大西洋鲑样品规格
1.2 水样测定和浮游植物、细菌群落结构的鉴定

1.2.2 浮游植物鉴定 取2 L未经过滤的养殖水装入聚乙烯瓶中用鲁哥试剂固定,置于4 ℃黑暗环境下静置保存,参照《海洋调查规范》(GB17378.7—2007),用浮游生物计数框统计浮游植物种类和数量。
1.2.3 细菌群落鉴定 在现场取养殖水2 L,经0.22 μm无菌混合纤维素酯膜抽滤,用锡箔纸将滤膜包裹后装入冻存管内,置于保温箱中附以干冰暂存,回到实验室后置于-80 ℃冰箱中保存,用于测定细菌群落结构。用CTAB法提取滤膜上细菌群落的DNA,将得到的DNA置于TE溶液中进行保存,然后通过琼脂糖凝胶电泳来检测样品DNA的完整性,当纯度和浓度达到Miseq测序要求后保存于-20 ℃条件下备用。使用16S rRNA引物,515F:5’-GTGCCAGCMGCCGCGG-3’; 907R:5’-CCGTCAATTCMTTTRAGTTT-3’、New England Biolabs公司的Phusion®High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶对样品的V4~V5区进行PCR扩增。然后通过琼脂糖凝胶电泳对PCR产物进行检测,使用qiagen公司的试剂盒回收产物DNA。最后通过TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒来构建数据文库,用Qubit和qPCR来检验文库,对符合标准的文库使用HiSeq2500 PE250进行上机测序(北京诺禾致源科技股份有限公司)。为保证分析的准确性,测序后优化有效序列,生成操作分类单元(OTU),聚类相似性定位97%,OTU种属鉴定比对可信度阈值设定为80%。
1.3 土腥味物质的分析
1.3.1 鱼背肌中土腥味物质的提取 采用微波蒸馏法[21]提取鱼背肌中的土腥味物质。准确称取90 g背肌,置于500 mL自制蒸馏瓶中,密封,放入微波蒸馏装置[21](见图1),向反应瓶中通入流速为70 mL/min的助推氮气,调节微波加热功率为350 W,加热一定时间,通过低温(4 ℃)冷凝装置对馏分降温,收集管置于冰水浴中收集馏分,集满馏分后将收集管密封放入4 ℃冰箱中保存。

图1 微波蒸馏提取装置示意图
1.3.2 土腥味物质的富集 采用固相微萃取法富集土腥味物质。取微波蒸馏得到的馏分充分混匀,从中抽取10 mL加入装有3 g NaCl(有机纯,使用前在450 ℃烘烤4 h)和微型磁力搅拌子的20 mL顶空瓶(美国Agilent公司)中,将顶空瓶置于加热磁力搅拌台(IKA®RCT basic加热型磁力搅拌器,德国IKA公司)上,搅拌速度1 500 r/min,60 ℃预热15 min后,将50/30 DVB/CAR/PDMS萃取头(美国Supelco公司)插入顶空瓶中,并调整、固定萃取头在顶空体积中的位置,60 ℃萃取30 min后取出,并迅速插入气相色谱-质谱仪(美国Agilent公司)进样口,进行气相色谱-质谱联用(GC/MS)分析。
1.3.3 土腥味物质的测定 采用气相色谱-质谱联用仪测定土腥味物质的含量。气相色谱-质谱仪使用的色谱柱为HP-5MS毛细管柱(美国Agilent公司,30 mm×0.25 mm×0.25 μm);进样口温度250 ℃,热解析15 min;程序升温:初温40 ℃,保持2 min,以8 ℃/min升温至250 ℃,保持10 min;载气:He;流量:0.8 mL/min,不分流;质谱条件:离子源温度230 ℃,传输线温度280 ℃。数据采集:TIC(Total ion chromatograms,总离子流色谱图);EIC(Extract ion chromatograms,选择离子色谱图),GSM和MIB的特征性m/z分别为112.0和95.0。
使用上述条件测定标准溶液GSM和MIB(美国Sigma公司,色谱纯,浓度100 μg/mL,纯度99.9%,溶于甲醇保存)的检出限(S/N=3)分别为1.04和2.11 ng/L,线性范围为0.2~1 000 ng/L,相关系数R2分别为0.999 0和0.999 2。对浓度为100 ng/L的GSM和MIB混合溶液进行精密度测定实验(n=6),相对标准偏差分别为4.8%和5.4%,测定的回收率分别为98.6%和97.3%。
1.4 数据统计与分析方法
所有数据采用平均值±标准差(X±SD)表示。在SPSS 21.0(IBM Corp, Armonk,NY,USA)软件中采用Kolmogorov-Smirnov检验和Levene检验方法分别进行数据的正态分布检验、方差齐性检验,合格后进行单因素方差分析(ANOVA),组间差异采用Duncan’s多重比较进行分析,以P<0.05作为显著性差异标准;对浮游植物、细菌群落和土腥味物质间的相关性进行Pearson相关性分析;采用R语言(v. 3.5.1)的ade4包和ggplot2软件包进行细菌群落的主成分分析(PCA);采用R语言中的vegan包进行环境因子与细菌群落间的典型相关分析(CCA)。
2 实验结果
2.1 不同时期养殖系统水质的变化
除叶绿素a以外,其它测定水质指标包括水温、溶氧、盐度、pH、氨氮、亚硝氮、硝氮、活性磷酸盐、总氮、总磷、总悬浮物和溶解性总有机碳在不同采样时期差异显著(P<0.05)(见表2)。YT1中溶解性有机碳水平显著低于其他时期(P<0.05);YT2中亚硝氮、总氮、总磷和总悬浮物水平显著高于其他时期(P<0.05);YT2和YT3中总氨氮水平显著高于YT1和YT4(P<0.05);YT3和YT4中硝氮显著高于YT1和YT2(P<0.05);YT4中溶解性活性磷显著高于其他时期(P<0.05)。
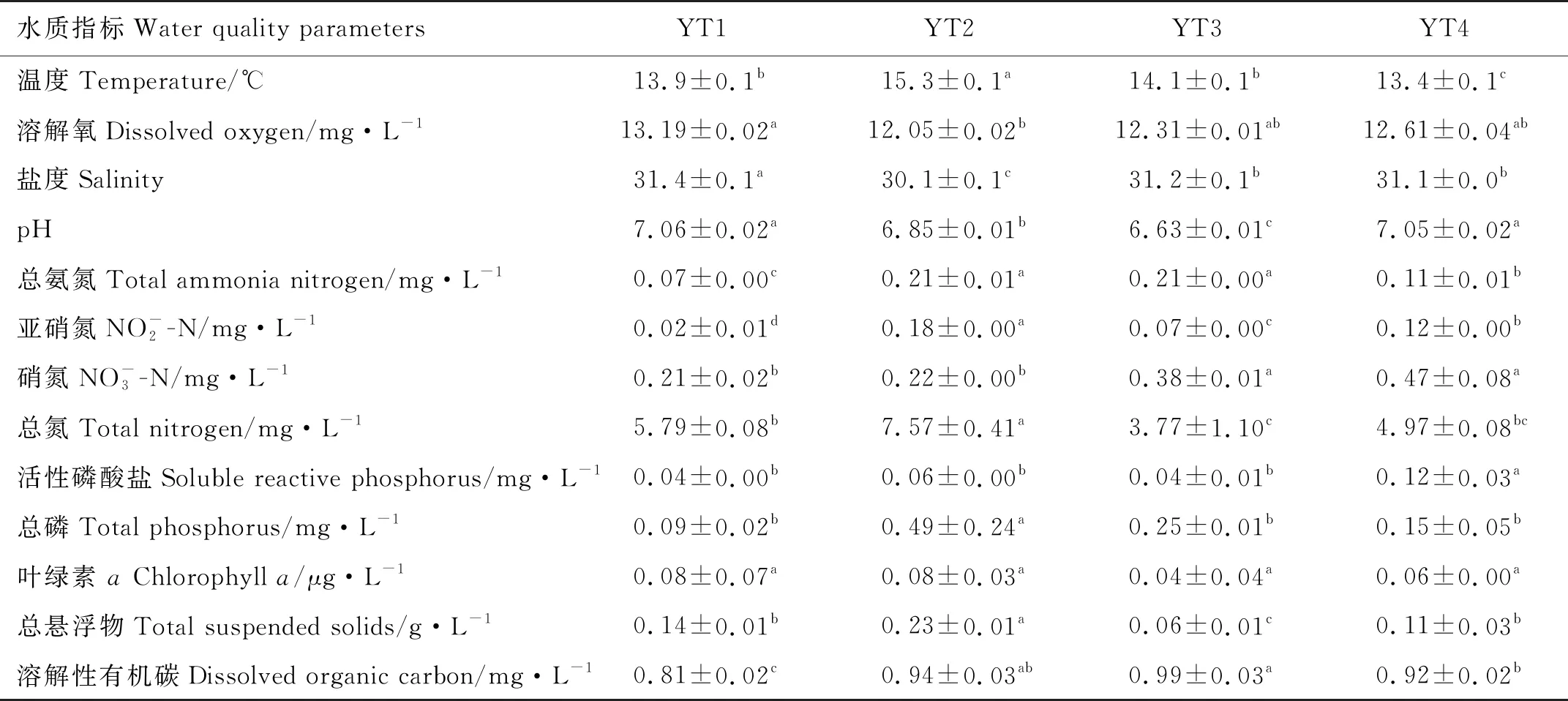
表2 不同时期循环水养殖系统水质比较
2.2 大西洋鲑体内土腥味物质含量
不同时期大西洋鲑背肌中土腥味物质的含量如图2所示,GSM的含量均显著低于MIB(P<0.05);YT1和YT4的MIB含量显著低于YT2和YT3(P<0.05);MIB和GSM含量均在YT2达到最高值。
2.3 浮游植物群落
循环水养殖系统养殖池不同时期水体浮游植物的种类组成见表3,在所有采集的样品中,鉴定出浮游植物7门13目,共26属,其中,硅藻4目8属,占总属数的29.63%;绿藻3目8属,占总属数的29.63%;蓝藻2目2属,占总属数的11.11%;甲藻1目3属;裸藻1目3属;黄藻1目1属;金藻1目1属。将个体数占总捕获量5%以上者定义为优势类群,在10月,蓝藻占绝对优势,而在其他时期,硅藻和绿藻是优势物种。
养殖池中浮游植物优势属见表4,浮游植物优势属共15个,YT2中最多,YT3中最少。其中,小球藻属为YT1和YT2中的优势属;水网藻属、膝沟藻属和直链藻属为YT2和YT4中的优势属;颤藻属在4组样品中均为优势属。在YT2和YT4中,水网藻属在系统中均占据绝对优势,其丰度分别占YT2和YT4浮游植物总丰度的53%和78%。
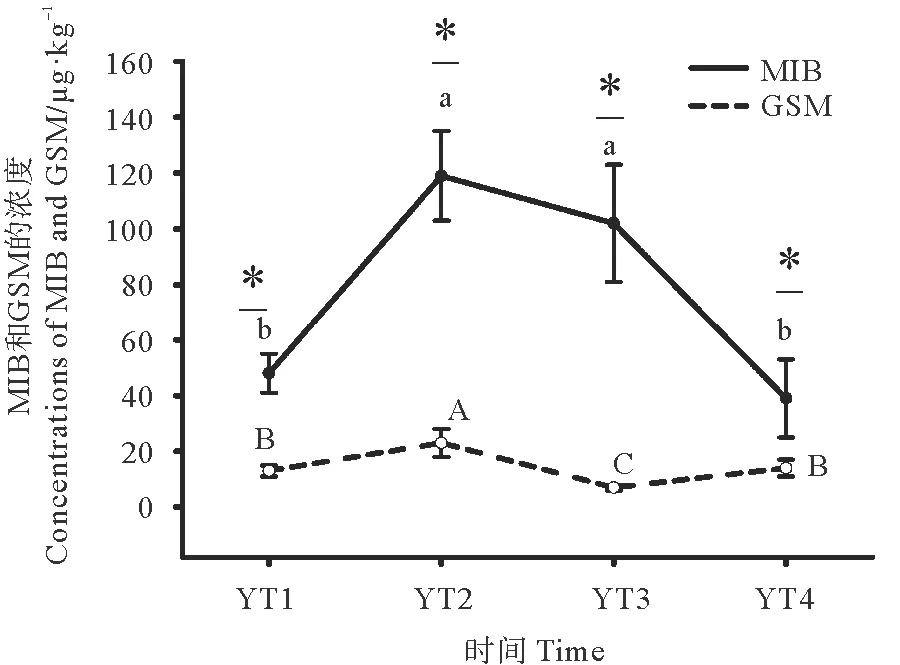
(表示同一时期GSM与MIB之间差异显著,不同小写字母表示MIB浓度在不同时期差异显著P<0.05,不同大写字母表示GSM浓度在不同时期差异显著P<0.05。YT1表示2018年4月采集的样品;YT2表示2018年7月采集的样品;YT3表示2018年10月采集的样品;YT4表示2019年1月采集的样品。下图同。represent a significant difference between GSM and MIB during the same period. Different lower-case letters indicate that the concentration of MIB varies significantly over periods P<0.05,while different capital letters indicate that the concentration of GSM varies significantly over periods P<0.05. YT1, samples collected in April 2018; YT2, samples collected in July 2018; YT3, samples collected in October 2018; YT4, samples collected in January 2019.The abbreviations in the other figures indicate the same meaning.)
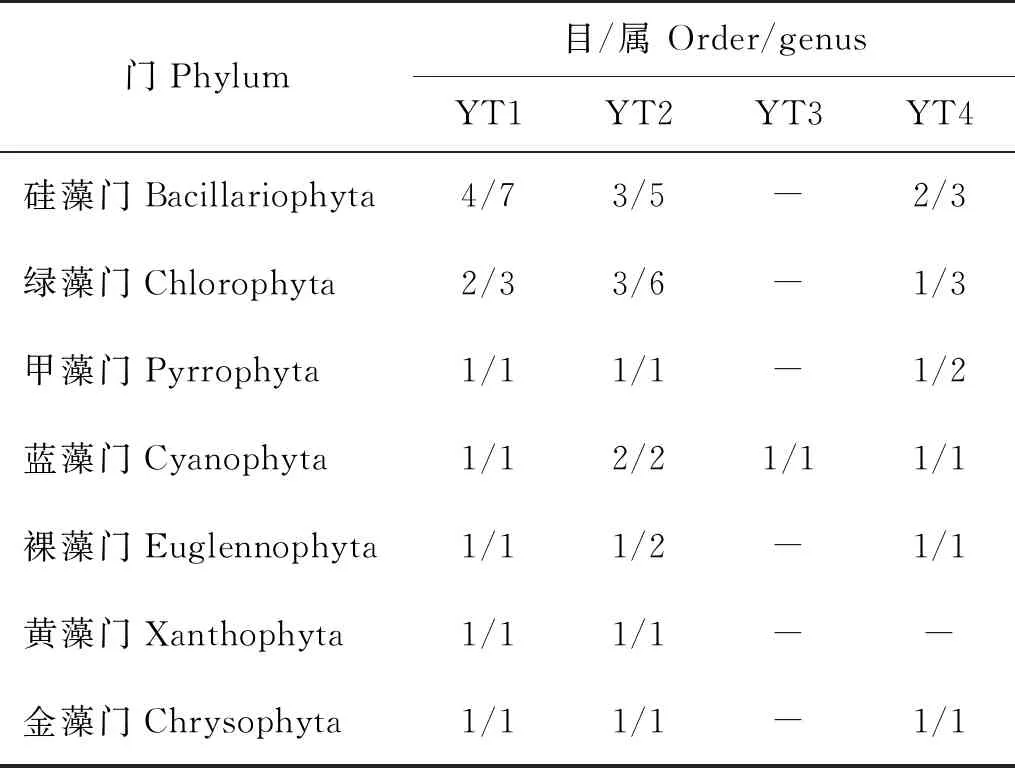
表3 循环水养殖系统不同时期浮游植物的种类组成Table 3 Species composition of phytoplankton in different periods in recirculating aquaculture system

表4 循环水养殖系统浮游植物优势属

续表4
采用Pearson相关分析法对MIB、GSM与浮游植物群落进行相关性分析(见表5)。MIB与所有的浮游植物在门水平未表现出显著相关性;GSM与硅藻门、绿藻门和甲藻门呈极显著正相关(P<0.01)。
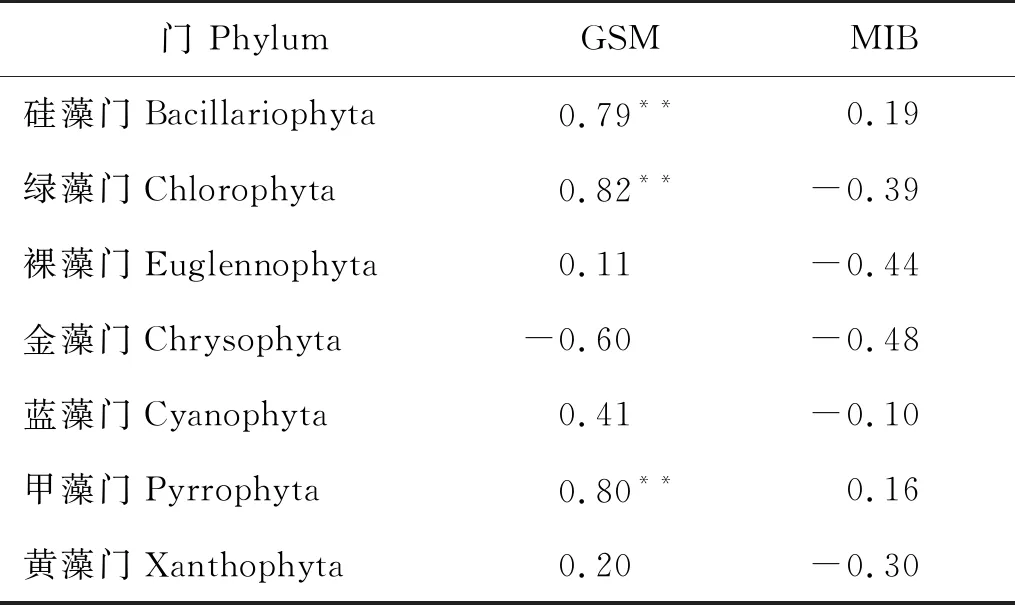
表5 大西洋鲑中土臭素和二甲基异冰片含量与养殖水体中浮游植物群落在门水平的相关性
2.4 细菌群落
以系统在不同时期中排名前十的细菌群落分别绘制其在门和属水平的相对丰度图(见图3)。养殖池在不同时期均以变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)为主(见图3(a)),二者占比均在18%以上。系统在YT3中以变形菌门为主,其次为拟杆菌门,且在YT3中,变形菌门的相对丰度要明显高于其他时期,此时拟杆菌门的相对丰度在4组中是最低的;相反地,系统在YT1和YT4中以拟杆菌门为主,其次是变形菌门;而在YT2中,两者水平相当。蓝细菌门(Cyanobacteria)在所有样品中占比均小于0.3%;酸杆菌门(Acidobacteria)均小于0.01%;放线菌门(Actinobacteria)在YT2中最高达到1.4%,在YT4中最低为0.2%。
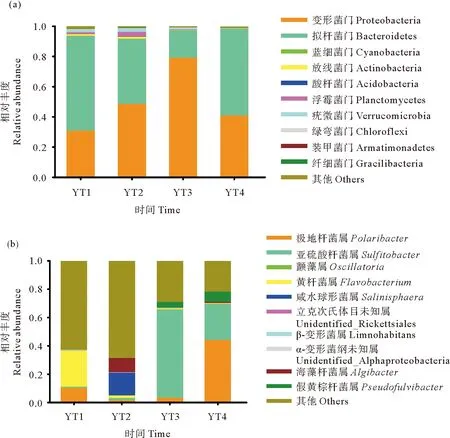
图3 不同时期细菌群落门(a)和属(b)水平下相对丰度比较
不同时期系统中的细菌群落属水平相对丰度见图3(b)。极地杆菌属(Polaribacter)的丰度在YT4中最高为44.3%,YT2中最低为10.2%;亚硫酸杆菌属(Sulfitobacter)的丰度在YT3和YT4中分别为62.2%和25.2%,在YT1和YT2中均低于2%;不同时期颤藻属(Oscillatoria)和α-变形菌纲中一个未识别的属(Unidentified_Alphaproteobacteria)的丰度均小于0.3%;黄杆菌属(Flavobacterium)在YT1中的相对丰度达到25.4%,而在其他时期均在1%左右。
在对水样中细菌群落结构初步分析的基础上,对不同时期细菌样品的相对丰度进行主成分分析,结果显示前两个主成分累积贡献率占总体变量的52.77%,PC1解释了29.06%的变量,PC2解释了23.71%的变量。以第一主成分和第二主成分分别为横坐标和纵坐标作图(见图4)。从图4中可以看出,YT1和YT2的细菌群落较为分散且分布较远,YT3和YT4的细菌群落分布集中且相距较近,差异性不大。

图4 循环水养殖系统中细菌群落的主成分分析Fig.4 Principal component analysis (PCA) of bacterial communities in recirculating aquaculture system
图5显示了不同时期循环水养殖系统中细菌群落结构与总悬浮物、氨氮、活性磷、总氮、总磷和溶解性总有机碳6种环境因子的相关性。YT1与溶解性总有机碳呈负相关;YT2与总磷和总氮具有较大的正相关;YT3、YT4较为接近,与氨氮、活性磷和溶解性总有机碳正相关。
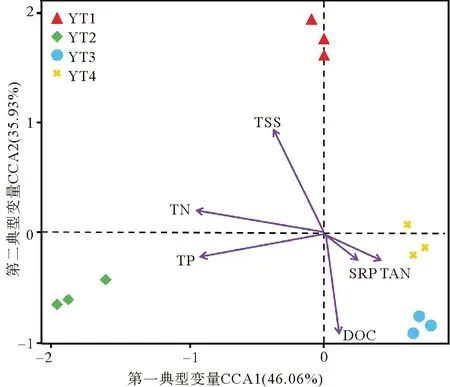
图5 循环水养殖系统中细菌群落与环境因子的典型相关分析Fig.5 Canonical correlation analysis (CCA) of the relationship between bacterial communities and environmental factors in recirculating aquaculture system
将鱼体中GSM和MIB含量与门和属水平上的细菌群落进行相关性分析,如表6和7所示,GSM与浮霉菌门和纤细菌门呈极显著正相关(P<0.01),与放线菌门呈显著正相关(P<0.05);MIB与变形菌门、酸杆菌门和疣微菌门呈显著正相关(P<0.05),与拟杆菌门呈显著负相关(P<0.05)。同时,GSM和MIB与蓝细菌门中的颤藻属呈显著正相关(P<0.05),与α-变形菌纲未知属呈正相关,且MIB呈显著正相关(P<0.05);GSM与亚硫酸杆菌属呈负相关,MIB与极地杆菌属呈负相关。
3 讨论
3.1 大西洋鲑体内土腥味物质含量分析
本研究中,MIB在大西洋鲑鱼体中的含量高于GSM。前期研究发现,不同地区养殖池中土腥味物质组成及含量有所差别,前人曾对美国东南部4个州的养鲶池土腥味物质组成进行分析[22],结果表明路易斯安那州MIB较常见,而在阿拉巴马州GSM更普遍。徐立蒲[23]等发现北京淡水养殖池中的主要土腥异味物质成分是GSM,而天津寡盐水鱼池水中主要土腥味物质是MIB。廖涛[24]通过观察斑马鱼对GSM和MIB的富集发现,鱼肉中的土腥味物质主要来源于养殖环境中的MIB和GSM,但鱼体对GSM的富集速度明显比MIB要快;朱厚亚等[25]将水库中分离得到的颤藻培养后得到MIB和GSM两种土腥味物质,但MIB的含量低于GSM;陈娇等[26]发现水库中MIB为放线菌的主要产物,水体中的大多数放线菌可同时产生MIB和GSM,但不同的放线菌产生两种土腥味物质的能力有差异,并且环境中放线菌的生物量与MIB和GSM的含量不一定呈正相关。本实验循环水养殖系统中,致嗅微生物的群落结构复杂,不同时期微生物群落结构不同,有关MIB和GSM浓度差异的具体产生机制尚不清晰。

表6 大西洋鲑中土臭素和二甲基异冰片含量与养殖水体中细菌群落在门水平的相关系数Table 6 Correlation coefficients between the concentration of geosmin (GSM),2-methylisoborneol (MIB) in S.salar and bacterial community at phylum level in recirculating aquaculture system
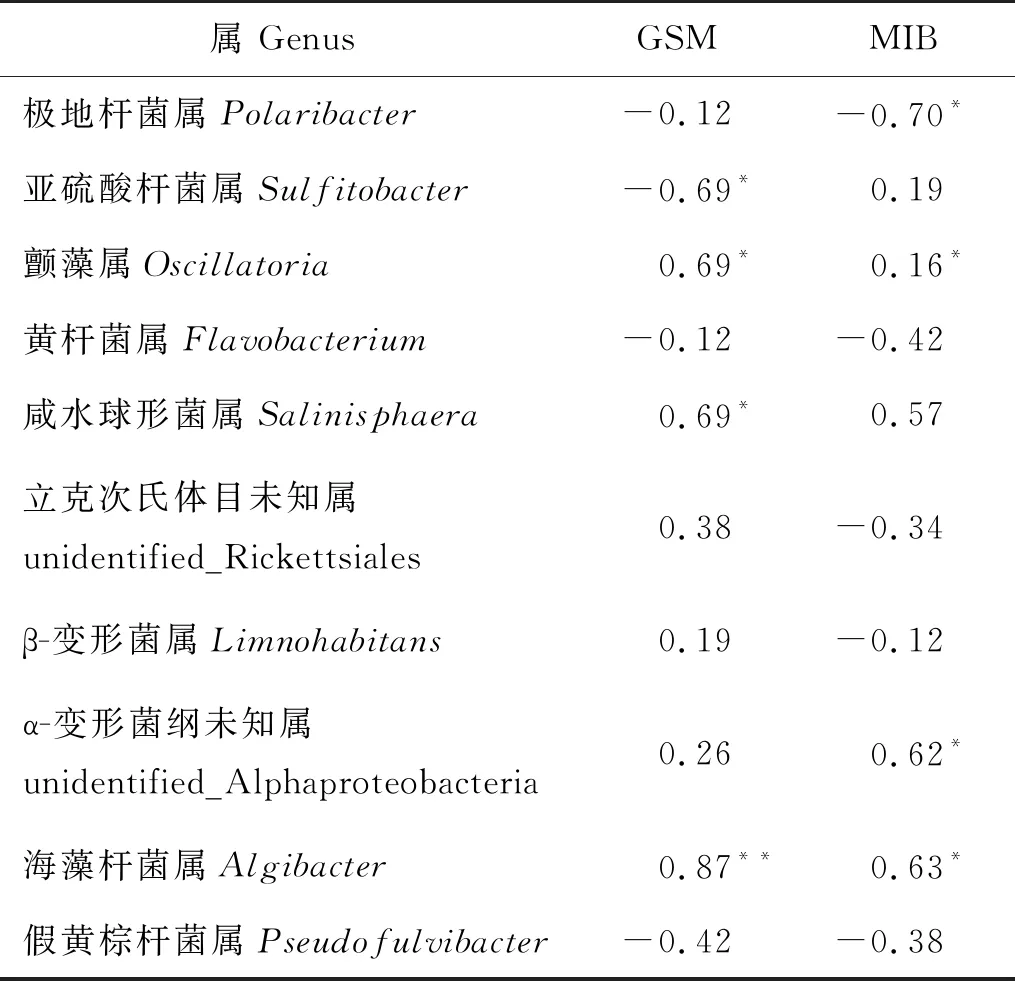
表7 大西洋鲑中土臭素和二甲基异冰片含量与养殖水体中细菌群落在属水平的相关系数Table 7 Correlation coefficients between the concentration of geosmin (GSM), 2-methylisoborneol (MIB) in S. salar and bacterial community at genus level in recirculating aquaculture system
研究表明GSM在鱼体内含量达到900 ng/kg或MIB达到600 ng/kg时[15],产生的土腥味会严重影响鱼产品的品质[27]。本实验检出的土腥味物质中,MIB为主要的土腥味物质来源,但最高值小于119 ng/kg,符合市场要求。本研究大西洋鲑的土腥味物质含量明显低于其他养殖品种,例如鱼菜共生系统中罗非鱼肌肉中的MIB含量达600 ng/kg,而GSM含量接近900 ng/kg[28-29],青岛市场市售鳙鱼肉中GSM平均含量为5 400 ng/L[21]。对鲑科鱼类的研究发现,淡水养殖虹鳟体内MIB含量为730 ng/kg,半咸水养殖银鲑体内GSM含量高达4 580 ng/kg[30]。
3.2 土腥味物质的产生与浮游植物的关系
前期研究发现,一些浮游植物种类可引起土腥味[31-32]。本研究发现,GSM和MIB均与绿藻门和硅藻门呈显著正相关,在7月MIB和GSM的含量均达到最高值,此时浮游植物的丰度最多,且多以绿藻门、硅藻门和蓝藻门的种类为主。前期研究表明,蓝藻门的微囊藻、颤藻和席藻等可产生GSM和MIB[33-34],绿藻门中栅藻以及硅藻门中的颗粒直链硅藻、针杆藻、舟形藻和小环藻也有可能产生土腥味物质[23]。
10月两种土腥味物质含量也较高,此时水体浮游植物以蓝藻门的颤藻为主,李铮[35]发现,8—11月色球藻和颤藻处在最佳繁殖期,水库内的蓝藻占比可高达89.3%。同时,7月系统中TSS含量显著高于其他时期,而Robin的研究发现,TSS增加会导致水环境中的浮游植物群落逐渐转变为蓝藻群落,继而导致土腥味物质的产生[17]。氮、磷是导致水体富营养化的重要因子,也是浮游植物生长的限制元素[36]。Smith[37]对世界范围内17个湖泊的水质分析后发现,蓝藻的生物量与环境中TN/TP具有相关性,当TN/TP<29时,环境中的优势种倾向于蓝藻。唐汇娟[38]对国内35个湖泊(23个爆发过水华)的水质数据分析后发现,没有发生过蓝藻水华的水体里,N/P(原子比)<13,而发生过水华的湖泊里,N/P在13~35之间。本研究发现,7和10月TN/TP分别为15.45和15.08,N/P分别为10.17和16.5,这表明10月系统的养殖环境更倾向于蓝藻的生长,而实验结果显示,10月系统中蓝藻占绝对优势。Yagi[39]发现MIB和GSM通常会在7—10月期间出现,尤其在8月最严重[15],本研究中,7月循环水系统中浮游植物优势属最多、丰度最大,10月系统中浮游植物群落单一,颤藻成为优势种,此时土腥味物质含量较高。
3.3 土腥味物质含量与细菌群落的关系
本研究中各时期细菌群落中变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)两个门在群落结构占比均在90%以上;罗金飞[40]也发现,变形菌门和拟杆菌门为拟穴青蟹(Scyllaparamamosain)循环水系统中细菌群落结构的优势细菌门。但各个时期,细菌群落结构又形成一定差异,例如1和10月的细菌群落相似性较高,优势菌属有极地杆菌属(Polaribacter)和亚硫酸杆菌属(Sulfitobacter),刘璐[41]发现亚硫酸杆菌属是东凤螺养殖水体中主要的微生物种类;1和4月的细菌群落优势菌属有极地杆菌属(Polaribacter),吴建绍[42]研究发现健康的双斑东方鲀循环水养殖系统核心细菌群落以极地杆菌属(Polaribacter)为主。黄杆菌属(Flavobacterium)作为4月细菌群落中的优势属,与溶解性有机碳呈负相关性,黄杆菌属通过溶藻和分解有机质来生存,可以净化水质[43],这与本实验监测到4月的水质优于7和10月的现象相符合。
本研究中,GSM和MIB均与颤藻属呈正相关且GSM与放线菌门呈正相关,徐立蒲等[23]研究发现,颤藻和放线菌是产生GSM的来源之一。Ma[31]研究发现在蓝藻水华生长期,MIB占据主导地位。韩正双[44]发现,目前已发现的可降解水中GSM和MIB的微生物主要是细菌,本实验中GSM和MIB含量与黄杆菌属呈负相关,在4月黄杆菌属在菌群结构中占比高达25%,而MIB和GSM的含量均较低,这可能与黄杆菌对土腥味物质的降解有关。Guttman和Van Rijn[45]在厌氧污泥中观察到黄杆菌属的某些菌株可降解GSM和MIB,并且已经应用于生物过滤器来净化水质[44]。
4 结语
通过对不同时期封闭式循环水养殖系统水质以及大西洋鲑体内土腥味物质含量的检测,发现大西洋鲑鱼肉中MIB含量均高于GSM,MIB为土腥味物质的主要来源。大西洋鲑体内GSM和MIB浓度分别小于119和23 ng/kg,符合市场要求。鱼体内MIB在7和10月含量较高。不同时期水质因子不同,浮游植物和细菌群落结构也有差异。水质因子可能通过影响浮游植物和细菌群落结构间接影响养殖鲑鳟鱼体内土腥味物质的含量。

