上转换发光纳米技术检测食品中磺胺类药物含量
桂丽娟,梁紫璐,罗永文,庄健乐,毕水莲
(1.广东药科大学食品科学学院,广东中山 528458)(2.广东药科大学公共卫生学院,广东广州 510006)(3.华南农业大学兽医学院,广东广州 510642)(4.华南农业大学材料与能源学院,广东广州 510642)
磺胺类药物(Sulfonamides,SAs)是一种具有对氨基苯磺酰胺结构的人工合成抗菌药物,SAs由于对氨基苯磺酰基上的R基能够被不同的杂环所取代,可形成含五元杂环的SAs和含六元杂环的SAs[1]。SAs抗菌谱广,对多数革兰氏阳性菌、阴性球菌及某些革兰氏阴性杆菌均有抑制作用[2]。SAs因抗菌广、成本低而被广泛用于畜牧业和水产养殖业以防治疾病和促进生长[3,4],随着抗生素的广泛和过度使用,导致动物性食品中SAs的残留十分严重,人类通过长期摄入这些动物性食品会引起过敏、抗生素耐药性、菌群紊乱甚至细胞癌变等问题[5-7]。而我国农业部规定动物性食品中磺胺类药物的残留限量不能超过100 μg/kg[8]。
SAs的检测方法常见的有微生物检测法[9,10]、免疫检测法[11,12]、毛细管电泳[13,14]、高效液相色谱法[15,16]和液相色谱-质谱法等[17,18]。微生物检测法是通过抗生素药物对微生物抑制作用来测定抗生素药物残留量的方法,该方法价格低廉、简单,但操作过程繁琐且易受主观因素影响导致结果不够准确。免疫学分析法操作简单,适用范围广;而高效液相色谱法和液相色谱-质谱等方法虽然灵敏度和特异度较高,但这些方法均存在成本高、对操作人员要求高以及样品前处理过程复杂等问题[19],不利于快速检测目标物,因此,有必要建立一种快速检测食品中残留SAs的有效方法。
上转换发光纳米材料(Upconverting nanoparticles,UCNPs)是一种在近红外光激发下能发出可见光的发光材料,即能够将近红外长波长的激发光转换为短波长的紫外或可见光[20,21]。该类材料不仅具有低毒性、高抗光漂白性、没有生物样品背景荧光干扰等优点,还具有很大的反斯托克斯效应和较强的细胞组织穿透力[22,23],因此成为了很多上转换发光纳米技术(Upconversion fluorescence nanotechnology,UPNT)中理想的荧光供体,在生物成像、生物传感、生物检测、光动力治疗和食品安全等方面被广泛运用[24-27]。而大多数应用于生物检测领域的上转换纳米材料都是基于荧光共振能量转移(Fluorescence resonance energy transfer,FRET),FRET是一种通过分子间偶极-偶极耦合从被激发的供体荧光团转移到受体荧光团的能量转移现象[28]。为了提高FRET的效率和灵敏度,合适的能量供体与受体显得尤为重要,UCNPs因其独特的光学特性常被用作能量供体[29,30],而金纳米颗粒(Gold nanoparticles,GNPs)因具有良好的荧光淬灭能力被广泛用作能量受体[31]。基于 UCNPs所构建的FRET体系已被用于检测各种目标物[32-34]。Hu等[29]人利用与抗体相结合的上转换纳米粒子NaYF4:Yb/Tm和被抗原包被的单分散磁性聚苯乙烯微球(MMPMs)建立了一种用于检测食品中磺胺喹喔啉的荧光免疫测定法,得到检测限0.5 μg/kg。随后该研究团队基于 UCNPs或量子点和包被抗原的胶体金纳米建立了荧光猝灭免疫色谱条用于检测磺胺类药物,其中磺胺喹喔啉和磺胺甲恶唑的检测限分别为 1 ng/mL和5 ng/mL[35],虽然该方法成本低,易于判断,但通过目测色谱带的变化易受主观因素的影响,且灵敏度和特异度有待提高。因此,本文基于上转换纳米粒子NaYF4:Yb,Er和GNPs来构建更为灵敏、稳定的检测食品中含五元杂环磺胺类药物的方法。
1 材料与方法
1.1 材料与试剂
稀土氧化物(氧化钇,氧化镱,氧化铒,99.99%)、硝酸(HNO3)、氟化钠(NaF)、柠檬酸钠、氢氧化钠(NaOH)、正硅酸乙酯(TEOS)、3-氨丙基三乙氧基硅烷(APTES)、氨水(NH3·H2O,25%)均为分析纯,购买于国药集团化学试剂有限公司;氯金酸(HAuCl4,Au≥47.5%)、PVP(平均分子量58000)、戊二醛(25%,AR),硼氢化钠(NaBH4,GR)、三羟甲基氨基甲烷(Tris)、甲氧苄氨嘧啶(Trimethoprim,TMP)、磺胺甲恶唑(Sulfamethoxazole,SMZ)、乙醇(分析纯),均购买于上海阿拉丁生化科技股份有限公司;磺胺类抗原(SAs Ag-BSA,-20 ℃保存)、含五元杂环磺胺类药物抗体(SAs-Ab,-20 ℃保存)、牛血清白蛋白(BSA,4 ℃保存),购于美国Sigma-Aldrich公司;磷酸缓冲溶液(0.01 mol/L PBS,实验室自制);牛奶(伊利牛奶,500 mL);实验中用水均为超纯水。
1.2 主要仪器和设备
Nicolet iS5傅立叶变换红外光谱仪、低温高速离心机和溴化钾压片,均购自美国ThermoFisher公司;XD-2X/M4600型号X射线衍射仪,北京普析通用仪器有限公司;JEM-2100F型号透射电子显微镜,日本电子株式会社;UV-1800紫外分光光度计,日本Shimadzu公司;Nova Nano SEM 430场发射扫描电子显微镜,荷兰FEI公司;KQ-2200DB型超声波清洗器,反应釜,均相反应器和磁力加热搅拌器,均购自郑州巩义仪器设备公司;pH计,上海雷磁仪器厂;配备有R928光电倍增管探测器的JOBIN YVON TRIAX 320光谱仪,法国HORIBA Jobin Yvon公司;976 nm激光二极管,美国Coherent Corp公司。
1.3 方法
1.3.1 上转换发光材料NaYF4:Yb,Er的制备及修饰[36,37]
通过水热法制备 NaYF4:Yb,Er,具体步骤如下:称取一定量的稀土氧化物氧化钇、氧化镱和氧化铒分别放入不同的烧瓶中,然后向烧瓶中滴加HNO3溶液直到氧化物溶解,通过加热蒸发去除多余的HNO3溶液,最后加入去离子水即可配成稀土硝酸溶液。然后分别取2.5 mL硝酸钇溶液,1.5 mL硝酸镱和1.2 mL硝酸铒溶液,混合均匀;再取2 mL的柠檬酸钠溶液和25 mL NaF溶液,在磁力搅拌下缓慢滴加到上述混合溶液中,然后将混合溶液转移到高压反应釜中,用NaOH调节溶液的pH值(pH=5),磁力搅拌1 h。搅拌完后将反应釜放入烘箱干燥,180 ℃加热4 h,然后使反应釜冷却至室温,将得到的沉淀物转移到离心管中进行离心,离心后弃上清液并用二次蒸馏水、乙醇清洗3次,最后收集洗涤好的沉淀于60 ℃烘箱中烘干24 h,即可获得上转换发光材料(NaYF4:Yb,Er),研磨成粉末备用。
为使合成的上转换纳米材料具备良好的生物相容性,需对其进行表面修饰。采用改良的 Stӧber法[38]对其进行修饰,取制备好的NaYF4:Yb,Er粉末40 mg溶于60 mL正丙醇溶液中,搅拌均匀后将混合溶液放入恒温水浴锅中35 ℃下搅拌40 min,然后分别量取20 mL纯水和2.5 mL 25%的氨水加入上述混合溶液中,反应1 h。取25 μL正硅酸乙酯并将其溶于20 mL的正丙醇溶液中,然后将其逐滴滴加至上述溶液,继续反应4 h。为了表面修饰上氨基,将0.2 mL的APTES溶液溶于30 mL的正丙醇溶液,并滴入到上述溶液中,剧烈搅拌1 h,接着将反应后的溶液转移至离心管中离心,离心后弃上清,得到的沉淀物用乙醇和蒸馏水洗涤3次。最后将其放入60 ℃烘箱中烘干12 h,即可获得氨基化的上转换纳米粒子NaYF4:Yb,ErUCNPs。
1.3.2 UCNPs连接抗磺胺类抗体的制备
参照文献[39],采用经典的戊二醛交联法稍作修饰进行制备,具体为:取制备好的氨基化上转换纳米粒子粉末20 mg,利用超声将其分散在5 mL PBS溶液中,然后加入 1.25 mL 25%戊二醛溶液和 100 mg NaBH4,混合后在室温下振荡1 h。反应结束后,将反应后的产物进行离心,得到的沉淀用PBS洗涤3次,洗涤完后将沉淀物再次超声分散在 PBS中,然后将25 μL SAs-Ab和100 mg NaBH4加入上述溶液,在室温摇床上振摇1 h。最后,加入100 mg Tris作为封闭剂,室温下缓慢振摇1 h。反应结束后通过离心得到沉淀物,用PBS洗涤3次后去掉上清液并用1 mL PBS收集沉淀,得到的SAs Ab-NaYF4:Yb, ErUCNPs于4 ℃下保存。
1.3.3 金纳米材料(Gold nanoparticles,GNPs)制备及偶联磺胺类抗原
GNPs是通过利用柠檬酸钠作为还原剂进行制备[40,41],具体为:先用0.0216 g HAuCl4和240 mL去离子水混合以制备 HAuCl4水溶液,然后将溶液转移到三颈圆底烧瓶中,剧烈搅拌下升温到100 ℃,保持10 min。然后取柠檬酸钠0.125 g溶解于12.5 mL去离子水中制备成柠檬酸钠水溶液,接着迅速将柠檬酸钠溶液加入到上述溶液中,溶液颜色由黄色变成酒红色后,保持反应30 min,自然冷却到室温后加入1 mL去离子水和0.0042 g PVP,混合后室温下搅拌过夜,即可得到的GNPs溶液。
取上述制备好的GNPs 10 mL,用PBS将溶液的pH值调至8,然后往溶液中加入20 μL SAs Ag-BSA,冰浴中搅拌1 h。接着加入50 mg BSA作为封闭剂,继续搅拌1 h。反应后将溶液在10000 r/min下离心10 min,得到沉淀用0.01 mol/L PBS洗涤3次,弃上清液,最后分散在10 mL 0.01 mol/L PBS中,得到GNPs偶联SAs Ag BSA的溶液,即SAs Ag BSA-GNPs。
为使 SAs Ag BSA-GNPs能够很好的与 SAs Ab-NaYF4:Yb, ErUCNPs结合到一起,通过固定GNPs的量,调整磺胺类抗原的含量,使其添加量由20 μL增加到60 μL,以得到最合适的SAs Ag BSA-GNPs含量。
1.3.4 构建UCNPs-GNPs体系,检测不同含量的SAs
将含有 100 μL 25 μg/mL SAs Ab-NaYF4:Yb,ErUCNPs溶液分别添加到一系列含有SAs Ag-BSA溶液的小试管中,反应0.5 h后取制备好的20 μg /mL SAs Ag-BSA-GNPs溶液适量加入上述小试管中,然后加入PBS溶液定容至1 mL,室温下振摇40 min,用光谱仪进行荧光测定。
1.3.5 检测牛奶中含五元杂环SAs
将相同浓度的SAs Ag-BSA、BSA、抗生素SMZ和 TMP分别加入到牛奶中,形成混合溶液。然后将等量的牛奶混合溶液分别加入到含有 100 μL 25 μg/mL的SAs Ab-NaYF4:Yb,ErUCNPs溶液的若干小试管中,反应 0.5 h,接着将适量 20 μg/mL SAs Ag-BSA-GNPs溶液加入上述混合溶液中,并用 PBS溶液将溶液定容至 1 mL,同时使混合物浓度调整为20 ng/mL,置于摇床上反应40 min后,进行荧光测定。
1.3.6 数据处理
利用扫描电子显微镜(Scanning electron microscope,SEM)和X射线衍射(X-ray diffraction,XDR)分别对NaYF4:Yb,Er UCNPs的形貌和晶型结构进行表征;对NaYF4:Yb,Er UCNPs修饰前后的表征通过傅立叶变换红外光谱仪(Fourier transform infrared spectroscopy,FT-IR);利用透射电子显微镜(Transmission electron microscope,TEM)和紫外吸收光谱(Ultraviolet visible spectroscopy,UV-vis)检测合成的GNPs以及偶联磺胺类抗原的金纳米颗粒。在976 nm激发光下对偶联了磺胺类抗体 NaYF4:Yb,Er UCNPs进行荧光测试,观察其是否成功连接上抗体。
2 结果与讨论
2.1 UCNPs-GNPs体系的原理
UCNPs-GNPs体系的原理实际上是荧光共振能量转移(Fluorescence resonance energy transfer,FRET)的过程,FRET是一种通过分子间偶极-偶极耦合从被激发的供体荧光团转移到受体荧光团的非辐射能量转移现象[28]。其作用机理如图 1所示,通过将NaYF4:Yb,Er UCNPs作为能量供体,GNPs作为能量受体,分别结合SAs抗体和抗原,由于能量供体的发射光谱与能量受体的吸收光谱能够发生重叠,抗原抗体会发生特异性结合,因此能够缩短供受体分子之间的间距,使二者足够靠近,从而实现能量淬灭。通过添加一定量的游离抗原,让其和GNPs上的抗原发生免疫竞争,从而破坏UCNPs和GNPs的FRET体系,使荧光量得以恢复,因此可根据荧光强度的变化对游离的抗原进行量化。而实现FRET主要需满足以下2个条件:(1)供体的发射光谱和受体的吸收光谱要有重叠;(2)供体必须足够靠近受体,二者之间的间距要足够小[42]。

图1 NaYF4:Yb,Er UCNPs和GNPs的FRET过程Fig.1 The FRET Process Between NaYF4:Yb,Er UCNPs and GNPs
2.2 UCNPs和GNPs的合成表征

图2 (a)NaYF4:Yb,Er UCNPs的SEM图;(b)GNPs的TEM图;(c)NaYF4:Yb,Er UCNPs的XRD图;(d)NaYF4:Yb,Er UCNPs修饰前后的红外谱图Fig.2 (a) The SEM image of NaYF4:Yb,Er UCNPs; (b) the TEM image of GNPs; (c) The XRD patterns of NaYF4:Yb,Er UCNPs; (d) The image of FT-IR spectrum of the NaYF4:Yb,Er UCNPs before and after surface modification(amino-NaYF4:Yb,Er UCNPs)
利用扫描电子显微镜(SEM)对 NaYF4:Yb,Er UCNPs的形貌进行表征,图2a为NaYF4:Yb,Er UCNPs的 SEM 图。从图中可看出通过水热法制备的NaYF4:Yb,Er UCNPs粒径均一,约为80 nm。由于合成的上转换发光材料表面没有羧基或氨基等亲水性的官能团,不能与生物大分子材料相结合,因此需对其表面进行氨基化修饰[43]。利用X射线衍射(XDR)对NaYF4:Yb,Er UCNPs晶型结构进行表征,结果如图2c所示。从图 2c中可看出,采用二氧化硅壳包被并用TEOS和 APTES进一步功能化修饰 NaYF4:Yb,Er UCNPs后,所得的氨基功能化NaYF4:Yb,Er UCNPs与标准卡片JCPDS No.16-334一致,且没有明显的杂质峰,这表明NaYF4:Yb,Er UCNPs具有纯正六方相晶型,同时氨基化修饰后与修饰前相比,上转换纳米材料的结构没有受到影响,修饰后的荧光强度增强,这为后续构建FRET体系提供了良好的基础。图2d为NaYF4:Yb,Er UCNPs修饰前后的红外图谱(FT-IR),从FT-IR中可看出,修饰前,在3417、2928、2873 cm-1处出现了强度不一的吸收峰,其中在3417 cm-1观察到羟基的伸缩振动特征峰;2928和2873cm-1等处出现了属于亚甲基的不对称和对称伸缩振动特征峰。氨基修饰后,出现了一个位于1084 cm-1处新的吸收峰,同时伴随2928、2873cm-1处的吸收峰消失,这归结于二氧化硅键的对称伸缩振动,说明上转换纳米材料已成功被二氧化硅包覆。而在3251和1612 cm-1处均出现了由氨基引起的振动峰,这也证明了所制备的NaYF4:Yb,Er UCNPs氨基化修饰成功。
用透射电镜(TEM)对GNPs的合成进行表征,结果如图2b所示。通过柠檬酸钠合成法制备的GNPs表面带有负电荷,形状近似为球形,尺寸相对均匀,为10 nm,具有良好的分散性[38]
2.3 NaYF4:Yb,Er UCNPs连接SAs Ab和GNPs连接SAs Ag-BSA的表征
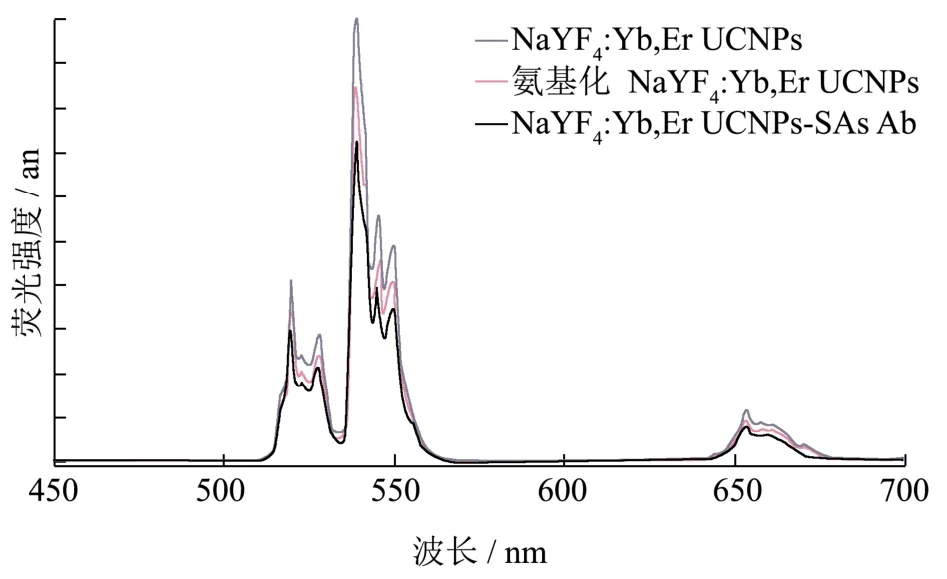
图3 976 nm激发下NaYF4:Yb,Er UCNPs荧光图谱和GNPs的紫外吸收光谱Fig.3 Fluorescence spectra of NaYF4:Yb, Er UCNPs in the 976 nm excitation and the UV absorption spectra of GNPs
上转换发光纳米材料在976 nm激发光下发射出绿光,如图3所示。从图中可看出NaYF4:Yb,ErUCNPs具有三个荧光特征发射峰,分别位于525 nm,541 nm和660 nm处,这是由于离子与离子之间发生能级跃迁所致。其中541 nm处的荧光强度最强,呈现出明显的绿色荧光,故将其作为响应光谱,后续平台的构建主要看此处的荧光强度变化。此外,通过对UCNPs和SAs-Ab偶联前后的荧光图进行对比,发现偶联后的波长和形状与偶联前相一致,发射峰的位置没有改变,但位于541 nm处荧光强度有所减弱,说明UCNPs已经成功连接上抗体。

图4 不同SAs Ag-BSA 含量结合GNPs的可见吸收光谱图Fig.4 The visible absorption spectrum of different SAs Ag-BSA amout binding with GNPs

图5 SAs Ag-BSA GNPs的紫外-可见吸收光谱和SAs Ab-NaYF4:Yb,Er UCNPs的荧光发射光谱图Fig.5 The fluorescence recovery UV-vis absorption spectrum of SAs Ag-BSA GNPs and the UC fluorescence emission spectrum of SAs Ab-NaYF4:Yb,Er UCNPs
图4为不同含量的SAs Ag-BSA与GNPs结合后可见吸收光谱图,可看出GNPs的紫外可见吸收光谱由偶联前的520 nm红移到偶联后的525 nm处,这种红移现象与YOU等[40]人的研究相似,说明GNPs已成功偶联上了SAsAg-BSA,在红移的过程中没有明显的峰展宽,说明GNPs不仅没有聚集现象而且具有良好的分散性,同时,偶联SAs Ag-BSA后的GNPs所产生的红外的吸收光谱红移后有利于提高FRET体系的灵敏度[44]。从图中也可看出,随着SAs Ag-BSA的增加,吸收峰位置发生了变化,其位置变为 528 nm处。当抗原浓度增加到40 μL和60 μL时,吸收峰位置不再随之改变,可见当抗原浓度为20 μL时是最适宜浓度。当UCNPs和GNPs结合后引起能量共振转移时,GNPs的吸收光谱和UCNPs的荧光发射光谱具有重叠的光谱(如图5所示),能够发生荧光淬灭,说明UCNPs与GNPs之间存在静电吸引,能很好的结合到一起。
2.4 基于 UCNPs-GNPs体系检测磺胺类药物的结果

图6 (a)不同浓度的SAs Ag-BSA在FRET体系的荧光强度;(b)不同浓度SAs Ag-BSA中FRET体系的荧光强度关系;(c)20 ng/mL浓度下BSA、SAs Ag-BSA、SMZ和TMP的荧光强度Fig.6 (a) The fluorescence spectra in the FRET system with different concentrations of SAs Ag-BSA; (b) The relationship between the different concentration of SAs Ag-BSA and the fluorescent intensity in FRET system; (c) The differential fluorescence response of the aptasensor to BSA、SAs Ag-BSA、antibiotic of SMZ and TMP at the same concentration (20 ng/mL)
为了定量检测磺胺类药物,改变游离抗原的加入量,检测在976 nm的红外光激发下的发光强度变化量。如图6a所示,荧光量随着游离抗原浓度的增加而逐渐增加。图 6b为不同浓度 SAs Ag-BSA下UCNPs-GNPs体系的荧光强度关系,其中I-I0代表荧光淬灭-恢复量(I:加入不同浓度SAs Ag-BSA后的UCNPs-GNPs体系荧光量,I0:没有加 SAs Ag-BSA的UCNPs-GNPs体系荧光量),随着SAs Ag-BSA浓度的增加,体系中的荧光恢复量逐渐增加,直到 100 ng/mL荧光强度开始趋于平稳。在0.08~100 ng/mL范围内抗原浓度与 UCNPs的荧光强度显示出了良好的线性相关,相关系数(R2)为0.99371,且当浓度高于100 ng/mL时,UCNPs的荧光强度逐渐平稳,检测限为0.08 ng/mL,比文献报道的基于NaYF4:Yb/Tm和MMPMs所构建的检测方法的检测限低[29],这说明本文所构建的FRET体系能够用于磺胺类药物的免疫测定。
2.5 牛奶中磺胺类药物检测结果
图6c为20 ng/mL浓度下BSA、SAs Ag-BSA、TMP和 SMZ的荧光强度变化图。如图所示,在UCNPs-GNPs体系中,添加了牛奶的溶液的荧光强度比添加了PBS的荧光强度略有减弱,但总体上影响不大,说明牛奶并不会改变上转换发光材料的发光性质。而添加了BSA和TMP的混合溶液与未添加抗原的牛奶混合溶液相比,荧光强度基本保持一致,没有明显改变,说明二者不会与体系中的SAs Ab-UCNPs发生免疫反应,也不会和SAs Ag-BSA-GNPs形成免疫竞争。而添加了SAs Ag-BSA和SMZ的溶液,荧光强度均增强,说明二者能够与体系中的抗体发生免疫反应。同时,也证明所构建的FRET体系具有良好的特异性。BSA和TMP都不含有五元杂环,不能与体系中的抗体发生反应,而SAs Ag-BSA和SMZ都含有五元杂环,能够与UCNPs-GNPs体系中的抗体发生特异性结合,使得UCNPs和GNPs的FRET体系破坏,荧光淬灭消失,使得荧光量得以恢复,这说明基于UCNPs-GNPs所构建的FRET体系可以运用到牛奶样品中含五元杂环磺胺类药物的检测。
3 结论
本研究利用 UCNPs发光性能好、低毒性、抗光漂白、对生物样品无损伤等特点,结合 GNPs构建FRET体系,为SAs检测提供了一种快速、灵敏、稳定的方法,能够检测痕量含五元杂环SAs残留,得到最低检测限为 0.08 ng/mL,线性相关度在 0.08~100 ng/mL之间,同时也适用于牛奶中含五元杂环SAs的检测,为食品安全检测提供技术支持与良好的保障,也为UPNT运用于检测食品中更多的有害物质提供了新思路和良好的基础。

