牛磺酸治疗通过激活自噬介导对老年大鼠骨量和骨强度的保护作用
郑英慧 卢启贵 黄东红 谢平金
1.广州中医药大学,广东 广州 510006 2.深圳市罗湖医院集团罗湖区中医院,广东 广州 518001
骨质疏松症(osteoporosis, OP)是一种代谢性疾病,其特征在于成骨细胞形成与破骨细胞吸收之间的不平衡。它是一种隐秘且不可预测的疾病,直到晚期才出现症状,因此被称为沉默杀手[1-2]。据估计,全球骨质疏松症的患病人数超过2亿,每年的医疗费用超过100亿美元[3],骨质疏松症已经成为严重影响人们健康的疾病。目前,治疗骨质疏松症最常用的药物为双膦酸盐、甲状旁腺素片段、RANK配体抑制剂以及中成药等。在这些治疗方法中,具有抗骨质疏松活性但几乎没有副作用的天然化合物值得探讨[1]。牛磺酸存在于骨骼中,但其功能尚不完全清楚。早期有研究[4]表明牛磺酸通过ERK1/2激活信号途径刺激成骨细胞的增殖和分化。同时牛磺酸抑制IL-1α、PGE2和脂多糖诱导的破骨细胞形成[5]。最新一项研究[6]表明补充牛磺酸可以预防酒精对去卵巢(OVX)大鼠骨代谢的影响。这些研究表明牛磺酸可能对维持老年大鼠骨量有积极的作用。然而,牛磺酸对老年大鼠骨量丢失的影响尚未见报道,因此本研究将观察牛磺酸对老年大鼠骨量的影响并初步探讨其相关机制。
1 材料和方法
1.1 材料
将10只3月龄体重(290±10)g的雌性Sprague-Dawley(SD)、20只24月龄体重(510±30)g的雌性Sprague-Dawley(SD)大鼠(购自上海西普尔-必凯实验动物有限公司)饲养在温度(23±2)°C、恒定湿度(45%~50%)、12 h/12 h暗光照循环的空调房间中,大鼠可以自由接触实验室提供的标准颗粒饮食和水。适应性饲养1周后随机分为三组:对照组:3月龄雌性大鼠(CON组,10只);模型组:24月龄雌性大鼠(MOD,10只);牛磺酸组: 24月龄雌性大鼠(NHS,10只),接受2 g/kg牛磺酸(购于南京化学试剂股份有限公司,纯度>98%)灌胃治疗;对照组和模型组给予同样剂量的生理盐水治疗,连续干预12周后,在最后给药治疗的第二天清晨处死大鼠并收集血液样品,同时解剖其双侧股骨进行进一步检测。
1.2 方法
1.2.1血清指标测定:收集大鼠动脉血并在4 °C下以1 200 r/min离心10 min。血清骨碱性磷酸酶(BALP,U/L)、1型前胶原氨基端肽(P1NP,ng/L)、抗酒石酸酸性磷酸酶(TRACP-5b,U/L)和β-胶原降解产物(β-CTX,ng/mL)检测采用南京建成市售试剂盒,按生产厂家说明书进行检测血清水平。
1.2.2组织学分析:大鼠右侧股骨在切片之前使用10%的EDTA脱钙4周。待脱水和石蜡包埋后,右股骨组织切成4 μm厚度进行苏木精-伊红(H&E)染色。使用医学影像分析系统(BI-2000)获取股骨干骺端骨小梁结构图像特征。
1.2.3Micro-CT分析:将左侧股骨标本通过Micro-CT测量(μCT80,Sanco Medical,Brüttisellen,Switzerland),并通过相关分析软件(μCT80 Evaluation Program v6.51,Sanco Medical,Switzerland)进行评估。扫描后,选择股骨远端高于生长板2 mm的松质骨作为VOI,该VOI仅限于股骨内部区域,其中通过使用CT分析器软件绘制自由形式等高线来提取骨小梁。使用标准化技术勾勒松质骨的微观结构,通过多平面重组获得三维(3D)图像,以确定骨体积分数(BV/TV,%)、骨小梁厚度(Tb.Th,μm)、骨小梁数目(Tb.N,mm-1)、骨小梁间隙(Tb.Sp,μm) 和骨密度(BMD,mg/cm3)。
1.2.4生物力学检测:Micro-CT检测过后,使用Instron 4302系统进行三点弯曲实验评估。将左侧股骨放在材料检测机支架上,两个支架之间的距离为1.5 mm,测试区域定义为股骨的最中央部分。以2 mm/min的速度施加压缩载荷直至骨折。通过连接的计算机监控骨折时的最大载荷(N)和弹性模量(mm2)的数据。
1.2.5蛋白印记检测:生物力学检测之后将左侧股骨远端骨组织匀浆于RIPA缓冲液中(Beyotime,中国,上海)。采用BCA蛋白分析试剂盒(Beyotime)测定蛋白浓度。蛋白质样品用12 % SDS-PAGE凝胶分离,然后转移到聚偏二氟乙烯(PVDF)膜(Bio-Rad,Hercules,CA,USA)上。用5 %脱脂牛奶封闭膜,用特异性抗体:抗P62(1∶500,Abcam)、Beclin-1(1∶1 000,Cst)、抗LC3(1∶1 000,Cst)、抗Runx2(1∶1 000,Abcam)和抗BMP2 (1∶1 000,Abcam)孵育4 ℃过夜。以GAPDH作为内对照。用增强化学发光(ECL)试剂(Beyotime)显示蛋白质条带,并用Image J软件进行分析。
1.3 统计学分析
数据使用均数±标准差表示。使用SPSS 19.0 进行分析,组间比较使用Tukey检验,然后用单因素方差分析(ANOVA)分析各组之间的差异。P<0.05表示比较差异有统计学意义。
2 结果
2.1 Micro-CT结果分析
股骨干骺端骨小梁二维图像如图1 A所示。股骨干骺端的微观参数如图1B~1F所示。MOD组左侧股骨BMD、BV/TV、Tb.N和Tb.Th较CON组明显降低,而Tb.Sp则明显升高(P<0.05)。NHS组左侧股骨BMD、BV/TV、Tb.N和Tb.Th均明显高于OVX组(P<0.05),而Tb.Sp则明显低于OVX组(P<0.05)。

图1 三组大鼠股骨干骺端Micro-CT检测结果Fig.1 Micro-CT detection results of femoral metaphysis of three groups of rats注: A:Micro-三维重建结果;B:BMD;C: BV/TV;D:Tb.Th; E:Tb.Sp;F:Tb.N;与CON组相比,*P<0.05; 与MOD组相比,#P<0.05。
2.2 股骨组织病理学
股骨干骺端骨小梁HE染色如图2所示,CON组织显示股骨干骺端骨小梁致密,骨小梁网状结构正常。MOD组组织表现为疏松均匀的骨小梁变薄,导致骨小梁间隙变宽。NHS组骨小梁数量和连接增加明显,表现出明显的结构恢复。

图2 三组股骨的组织病理学Fig.2 Histopathology of femurs of the three groups注:A: CON组;B: MOD组;C: NHS组;苏木精-伊红染色(放大倍数,×10)。
2.3 股骨的生物力学变化
股骨三点弯曲试验表明,CON组的最大载荷和弹性模量均高于MOD组,两组间比较差异有统计学意义(P<0.05),NHS组的最大载荷和弹性模量均高于MOD组(P<0.05)。见图3。
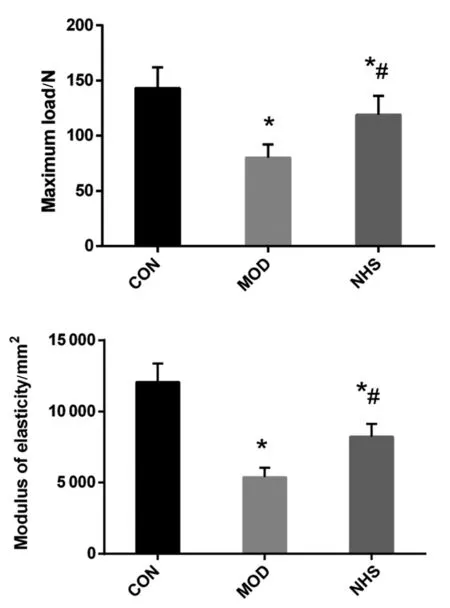
图3 右股骨的三点弯曲试验结果Fig.3 Three-point bending test results of the right femur of rats注: 与CON组相比,*P<0.05; 与MOD组相比,#P<0.05。
2.4 血清指标比较
各组大鼠血清骨代谢指标BALP、TRACP-5b、P1NP和 β-CTX水平如图4所示。和CON组比较,MOD大鼠血清BALP、P1NP、TRACP-5b和β-CTX水平明显升高;NHS治疗后能显著降低BALP、P1NP、TRACP-5b和β-CTX的水平,组间比较差异有统计学意义(P<0.05)。

图4 各组大鼠血清骨代谢指标水平Fig.4 The bone metabolism index levels in serum of rats in each group注: 与CON组相比,*P<0.05; 与MOD组相比,#P<0.05。
2.5 WB检测结果
和CON组比较,MOD组Runx2、BMP2、Beclin-1和LC3Ⅱ/LC3-Ⅰ表达水平明显下调,而P62表达水平明显上调,比较差异有统计学意义(P<0.05)。和MOD组比较,NHS组Runx2、BMP2、Beclin-1和LC3Ⅱ/LC3-Ⅰ表达水平明显上调,而P62表达水平显著下调,比较差异有统计学意义(P<0.05)。见图5。

图5 使用WB检测Runx2、BMP2、P62、Beclin-1和LC3Ⅱ/LC3-Ⅰ的相对表达Fig.5 Relative expression of Runx2、BMP2、P62、Beclin-1and LC3Ⅱ/LC3-Ⅰusing Western blotting注: 与CON组相比,*P<0.05; 与MOD组相比,#P<0.05。
3 讨论
随着人类寿命的延长,骨质疏松症已成为一个主要的临床问题,其特征是骨量和强度的丧失,从而导致脆性骨折[2]。OP治疗分为两类,一类是抑制过度骨吸收的抗吸收药物,另一类是促进骨形成的合成代谢药物[1]。目前OP的治疗药物包括双膦酸盐类化合物、地诺单抗和甲状旁腺素片段(PTH)。然而,触发破骨细胞凋亡的双膦酸盐的作用在大约3~5年后达到了瓶颈。此外,据报道[7]长期使用双膦酸盐与非典型股骨骨折相关。此外,停止使用会导致骨周转迅速增加,导致骨迅速丢失,并可能增加骨折的发生[8]。PTH通过激活成骨细胞促进骨形成,通过与PTH/PTHrP1型受体结合和刺激Wnt信号通路发挥作用;然而,甲状旁腺素的治疗被限制在2年内[9];此外,甲状旁腺素的常见不良反应包括头晕、头痛、恶心和腿部抽筋[9]。因此需要开发新的具有抗骨质疏松症作用且无副作用的药物用于防治老年骨质疏松症。
本研究表明12周牛磺酸治疗能显著提高老年大鼠的BMD。与本研究相似,有研究[10]表明在成长中的雄性大鼠中补充牛磺酸具有显著的作用,即在生长早期增加股骨的BMC重量。此外,Choi等[11]一项研究报告指出,在生长期雌性大鼠中补充牛磺酸后第9周,牛磺酸饮食显著增加了股骨BMD。此外,与对照组相比,在补充精氨酸和牛磺酸的组中,每单位体重的股骨骨矿物含量显著增加[11]。本研究中三点弯曲试验表明年龄导致大鼠股骨最大载荷和弹性模量显著降低,而牛磺酸治疗能显著改善股骨的最大载荷和弹性模量。
Micro-CT和组织切片分析进一步表明,年龄会导致股骨微结构出现严重的破坏,牛磺酸治疗后能显著改善年龄导致骨量丢失,提示牛磺酸可提高老年大鼠的骨量和强度。本研究同时检测血清指标BALP、P1NP、TRACP-5b和β-CTX水平改变。P1NP是一种成骨细胞分化标志物,β-CTX是胶原的产物[12],BALP是成骨分化早期的重要标志物[13],TRACP-5b是破骨细胞分化过程中过度表达[14]。本研究结果显示老年大鼠血清P1NP、BALP、TRACP-5b和β-CTX水平升高;而牛磺酸能降低年龄对骨代谢的影响,显著降低P1NP、BALP、TRACP-5b和β-CTX水平。本研究结果与先前的结果一致,牛磺酸能改善骨量流失大鼠模型中骨代谢指标[15]。
在最近的几十年中,人们逐渐意识到自噬在干细胞的自我更新、多能性、发育、分化和静止中起着重要作用[16]。 近年来的研究注意到自噬过程与细胞分化有关。例如,在胚胎干细胞中观察到自噬蛋白的存在,并且自噬蛋白在分化过程中表达增加;原代人骨髓间充质干细胞表现出高水平的自噬蛋白,在这些细胞分化为成骨细胞后,其水平降低[17]。在本研究中,使用牛磺酸治疗可上调成骨分化、矿化和成骨相关蛋白RUNX2和BMP2的表达。除此之外,蛋白质印迹分析的结果证实了牛磺酸增加了骨组织的自噬相关蛋白表达。据报道[18],自噬缺陷与年龄导致的骨髓间充质干细胞成骨分化受损有关。此外,自噬的激活可以部分逆转骨髓间充质干细胞的老化[19]。本研究表明自噬可能参与牛磺酸对老年大鼠介导的保护作用。
总的来说,牛磺酸可以通过自噬的激活保护年龄引起的骨代谢加速,从而改善了老年大鼠的骨量丢失。但是本研究有其不足之处,首先未进一步研究牛磺酸对破骨细胞、成骨细胞的影响,接下来会研究牛磺酸体外表现;其次,本研究仅仅选取一种剂量的牛磺酸来研究药物作用,是否是最合适的剂量却不得而知。接下来会进一步研究牛磺酸对不同原因诱导的骨质疏松的影响。

