氨基改性SBA-15介孔分子筛固定化双酶/环氧复合涂层的制备及其耐蚀性
陈晓蕊,鲁 新,孙俊芝,刘 芳,赵朝成
(中国石油大学 化学工程学院,青岛 266580)
金属的腐蚀防护在现代工业中起着重要的作用[1]。金属腐蚀会造成设备损坏,甚至在石油、农业等行业中导致物料泄漏,污染周围环境,威胁人们的安全。目前,人们主要采用表面涂层技术、电化学保护、添加缓蚀剂等方法来防止金属腐蚀的发生。其中,有机涂层防护成本较低且具有相对较好的防腐蚀性能,是迄今为止最经济有效的方法之一[2]。
环氧树脂由于具有良好的耐热性,黏合性,介电性和耐腐蚀性而被广泛应用[3]。然而,环氧树脂涂层是一种脆性材料,具有交联结构,抗冲击能力较差,断裂强度较低[4]。因此需要对环氧树脂进行改性以提高其力学性能。如通过加入与环氧聚合物相容的物质,可以降低环氧树脂涂层的孔隙率,阻断有害物质的扩散路径[5]。目前,研究较多的是加入纳米粒子来提高环氧树脂的性能。
溶菌酶(lysozyme,EC 3.2.1.17)是一种专门作用于微生物细胞壁的水解酶,其具有溶菌作用,故命名为溶菌酶[6]。脂肪酶(甘油酸酯水解酶,EC3.1.1.3)是一类特殊的生物酶,其广泛用于催化酯水解或醇解、酯合成和酯交换等反应[7]。谯康全等[8]研究发现溶菌酶可以作为生物缓蚀剂,在硫酸介质中对Q235碳钢具有缓蚀效果。脂肪酶对于脂类物质具有降解能力,故可作为缓蚀剂用于循环冷却水中[9]。前期研究也发现,溶菌酶与脂肪酶都具有缓蚀作用[10-13]。酶是一种蛋白质,受温度、pH等因素的影响较大,故需对游离酶进行固定化[14]。
SBA-15介孔分子筛的孔道均一、孔径可调,且其均一纳米尺寸的孔径允许酶分子的进入,同时其功能性表面基团可以根据目标分子进行改变,因此SBA-15介孔分子筛作为酶分子固定的载体有很高的优越性。单一的SBA-15介孔分子筛存在化学反应活性不高、活性位点较少等缺点,可以通过化学改性来提高其化学活性。
本工作制备氨基改性的SBA-15介孔分子筛,以氨基改性SBA-15介孔分子筛作为固定化酶的载体,分别确定溶菌酶和脂肪酶固定化的最佳条件,采用正交试验确定双酶共固定化的最佳条件,将共固定化双酶添加到环氧树脂中制备环氧复合涂层,通过极化曲线和电化学阻抗谱分析该复合涂层的耐蚀性。
1 试验
1.1 氨基改性SBA-15介孔分子筛的制备及表征
称取4 g的三嵌段共聚物(P123,分析纯)溶于30 g去离子水和60 g 2 mol/L HCl溶液中,在40 ℃恒温水浴加热搅拌1 h,再用移液管缓慢滴加8.4 mL正硅酸四乙酯(TEOS),继续恒温搅拌22 h;将混合溶液移入带有聚四氟乙烯内衬的不锈钢高压反应釜中,在130 ℃下结晶老化48 h;冷却至室温后过滤得到产物,用去离子水洗涤产物三次,并在100 ℃烘箱中干燥过夜;在550 ℃的马弗炉中焙烧产物6 h,去除产物中模板剂,得到SBA-15介孔分子筛。
取1 g SBA-15介孔分子筛和30 mL甲苯加入到圆底烧瓶中,逐滴加入1.7 mL 3-氨基丙基三乙氧基硅烷(APTES),在80 ℃下加热搅拌,冷凝回流6 h,混合液冷却至室温后,抽滤,先用甲苯冲洗滤出产物3~5次,再用无水乙醇反复洗涤,然后在100 ℃下干燥过夜后,得到氨基改性SBA-15介孔分子筛。
采用扫描电镜(SEM)、X射线衍射光谱仪(XRD)和傅里叶变换红外光谱仪(FT-IR)对氨基改性SBA-15介孔分子筛的形貌、结构进行表征。通过氮气吸附-脱附试验得到氨基改性SBA-15介孔分子筛的吸脱附曲线和孔径分布情况。
1.2 固定化单酶条件优化
取一定量的氨基改性SBA-15介孔分子筛,分别加入含溶菌酶和脂肪酶的Na2HPO4-NaH2PO4缓冲液中,在25 ℃对溶菌酶和脂肪酶进行固定化。通过单因素试验,以相对酶活为评价指标,对给酶量即溶菌酶和脂肪酶的质量浓度,固定化时间,缓蚀液pH,缓冲液离子强度等固定化条件进行优化。
固定化脂肪酶的相对酶活测定:以三丁酸甘油酯为底物,将50 μL的三丁酸甘油酯加入到50 mL锥形瓶中,再加入磷酸缓冲溶液,然后添加适量的固定化脂肪酶,将锥形瓶放置在37 ℃的水浴锅中恒温加热搅拌,反应15 min后,加入10 mL甲醇终止反应。以酚酞为指示剂,用0.05 mol/L NaOH滴定反应所产生的酸。定义在37 ℃,pH为7.5,1 g脂肪酸每分钟水解释放出1 μmol 游离有机酸所需的固定化脂肪酶的量为一个活力单位。在同组试验中,酶活最高值计为100%,其余试验点的酶活与最大酶活之比即为相对酶活。
固定化溶菌酶的相对酶活测定:将1 mL一定浓度的溶菌酶溶液加入6 mL 1.2 g/L羧甲基壳聚糖(pH 4.5)中,在55 ℃的水浴锅中反应60 min,取出后加入1 mL铁氰化钾溶液和3滴60 g/L的NaOH溶液,摇匀后测定其pH为碱性后,移入100 ℃的沸水中进行灭活处理5 min,冷却至室温后,在420 nm波长处测其吸光度。
1.3 共固定化双酶条件优化
选用以下4种方式将溶菌酶和脂肪酶共固定化在氨基改性SBA-15介孔分子筛上:(1) 先固定溶菌酶,后固定脂肪酶;(2) 先固定脂肪酶,后固定溶菌酶;(3) 脂肪酶和溶菌酶同时在缓冲液pH为6.5时固定;(4) 脂肪酶和溶菌酶同时在缓冲液pH为7.0时固定。选用相对酶活最高的方式为共固定化双酶方法,再进行条件优化。
以溶菌酶质量浓度、溶菌酶固定化时间、脂肪酶质量浓度、脂肪酶固定化时间为影响因素,以缓蚀率为评价指标设计正交试验对共固定化双酶条件进行优化。正交试验中,每个影响因素选择5个水平,选择L25(56) 型正交表,因素水平表如表1所示。
1.4 共固定化双酶缓蚀性能的测定
根据GB/T18175-2000《水处理剂缓蚀性能的测定 旋转挂片法》标准对Q235碳钢进行腐蚀试验,腐蚀介质为循环冷却水,并加入不同量共固定化双酶作为缓蚀剂,试验温度为40 ℃,挂片转速为75 r/min。采用失重法计算Q235钢的腐蚀速率,如式(1)所示,并根据式(2)计算缓蚀率。

表1 正交试验因素水平表Tab. 1 Factor and level table of orthogonal test
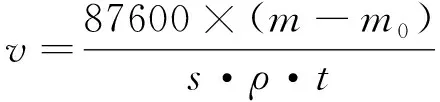
(1)
式中:v为试片腐蚀速率,mm/a;s为试片的表面积,cm2;ρ为试片的密度,g/cm;t为试验时间,a。
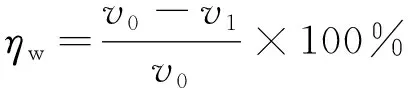
(2)
式中:ηw为根据腐蚀速率计算的缓蚀率,%;v0、v1为在未添加和添加共固定化双酶时试片的腐蚀速率,mm/a。
1.5 涂层制备及其电化学测试
Q235碳钢试片经砂纸打磨,依次浸泡在丙酮中(除油污)和无水乙醇中(除水),用滤纸和脱脂棉擦净后,置于干燥皿中干燥1 h以上。称取10 g环氧树脂,加入不同质量分数的共固定化双酶,经过机械搅拌和超声分散后使共固定化双酶均匀分散在环氧树脂中,将添加了共固定化双酶的环氧树脂涂料涂覆在Q235碳钢表面,常温固化72 h后形成氨基改性SBA-15介孔分子筛共固定化双酶/环氧树脂复合涂层(以下称复合涂层)。
电化学测试在CHI660E型电化学工作站上进行,并采用三电极体系:带有复合涂层的Q235碳钢为工作电极,饱和甘汞电极为参比电极,铂丝电极为辅助电极。以3.5%的NaCl溶液为工作介质,待开路电位稳定后,测复合涂层的极化曲线和电化学阻抗谱。其中,极化曲线测试的扫描速率为0.01 V/s,扫描电位范围为开路电压上下0.15 V,电化学阻抗测试频率范围为10-2~106Hz。
2 结果与讨论
2.1 氨基改性SBA-15介孔分子筛的表征
图1为SBA-15介孔分子筛氨基改性前后的SEM形貌。由图可知,改性前SBA-15介孔分子筛为棒状结构,且团聚成束;氨基改性后,在SBA-15介孔分子筛表面出现微小的颗粒,说明部分氨基成功嫁接到SBA-15分子筛上。

(a) 改性前

(b) 改性后图1 氨基改性前后SBA-15介孔分子筛的SEM形貌Fig. 1 SEM morphology of SBA-15 mesoporous molecular sieves before (a) and after (b) amino modifying
图2为SBA-15介孔分子筛氨基改性前后的XRD谱。由图可见,在2θ为0.8°附近出现尖锐且较强的晶面衍射峰,对应衍射晶面为(100),虽改性后峰强稍有减弱,但接枝的有机官能团并未改变其孔道结构;在2θ为1.5°和1.7°附近出现较弱的晶面衍射峰,对应衍射晶面为(110)和(200),这是二维六方结构典型的特征衍射峰,说明合成的SBA-15分子筛具有介孔结构。接枝有机官能团后,虽然孔道的结构没有明显的变化,但孔道组成更加丰富从而导致材料的有序性降低,因此氨基改性SBA-15分子筛的特征峰强度有所下降。以上分析说明氨基成功嫁接到了SBA-15介孔分子筛上。
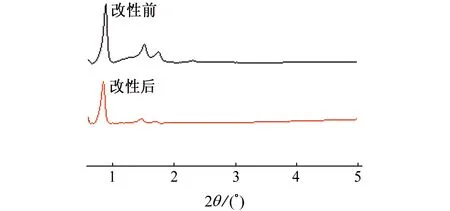
图2 氨基改性前后SBA-15介孔分子筛的XRD谱Fig. 2 XRD patterns of SBA-15 mesoporous molecular sieves before and after amino modifying
图3为SBA-15介孔分子筛氨基改性前后的红外光谱图。可以看出,在波数为3 450 cm-1附近有一个较宽的吸收峰,为Si-OH伸缩振动峰;波数为1 640 cm-1处,为水中-OH伸缩振动峰;在460、789、1 083 cm-1附近的吸收峰,分别为Si-O-Si的弯曲振动、对称伸缩振动和不对称伸缩振动峰[15]。通过对比可知,氨基改性SBA-15分子筛在1 561 cm-1附近出现了-NH2吸收振动峰,说明氨基成功嫁接到了SBA-15分子筛上。

图3 氨基改性前后SBA-15介孔分子筛的FT-IR谱Fig. 3 FT-IR spectra of SBA-15 mesoporous molecular sieves before and after amino modifying
图4是SBA-15介孔分子筛氨基改性前后的N2吸附-脱附曲线和孔径分布图。由图4可以看出,氨基改性前后SBA-15分子筛的吸附等温曲线都属于典型的IV型[16],这说明氨基改性后SBA-15分子筛的孔道结构没有被破坏,仍是介孔结构。由于介孔材料的毛细凝聚现象,在低压力段吸附量较为平缓,当p/p0提高至0.6~0.8时,出现了明显的吸附突越,出现了H1型滞后环。SBA-15介孔分子筛和氨基改性SBA-15分子筛的孔径分布曲线为单峰,同时半峰宽较窄,其平均孔径由9.42 nm降到7.85nm,比表面积由689.91m2/g降到574.75m2/g,这可能是SBA-15分子筛经过氨基改性后氨基进入孔道内造成的。

(a) 改性前
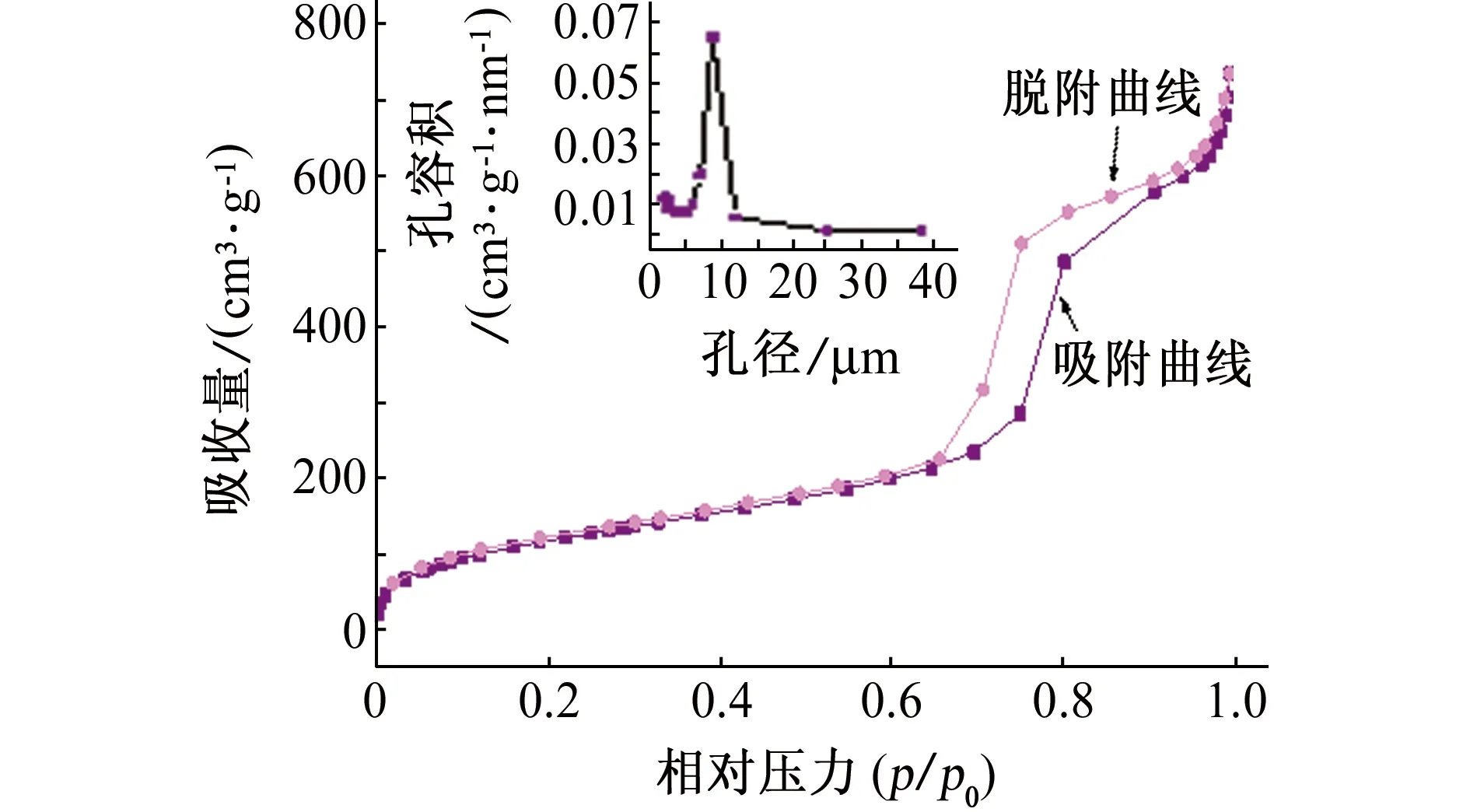
(b) 改性后图4 氨基改性前后SBA-15介孔分子筛的N2吸附-脱附曲线和孔径分布Fig .4 N2 adsorption and desorption curves and pore size distribution of SBA-15 mesoporous molecular sieves before (a) and after (b) amino modifying
2.2 固定化单酶条件优化
2.2.1 给酶量优化
由图5可知,随着给酶量的增加,固定化溶菌酶和固定化脂肪酶的相对酶活均先增大后减小,当给酶量为0.4 g/L时,固定化溶菌酶和固定化脂肪酶均具有最大的相对酶活。给酶量越大,氨基改性SBA-15分子筛上偶联的酶蛋白质越多,相应的固定化酶的相对酶活也越大;载体上酶分子的结合位点是有限的,当给酶量大于0.4 g/L时,结合位点达到饱和,且随着给酶量的增大,酶分子可能会聚集成团,使酶的活性中心互相掩盖,影响了酶分子和氨基改性SBA-15分子筛的相互结合,造成相对酶活的降低。因此,随着给酶量的增加相对酶活会提高,但超过一定值后,相对酶活会降低,固定化溶菌酶和固定化脂肪酶的最佳给酶量均为0.4 g/L。
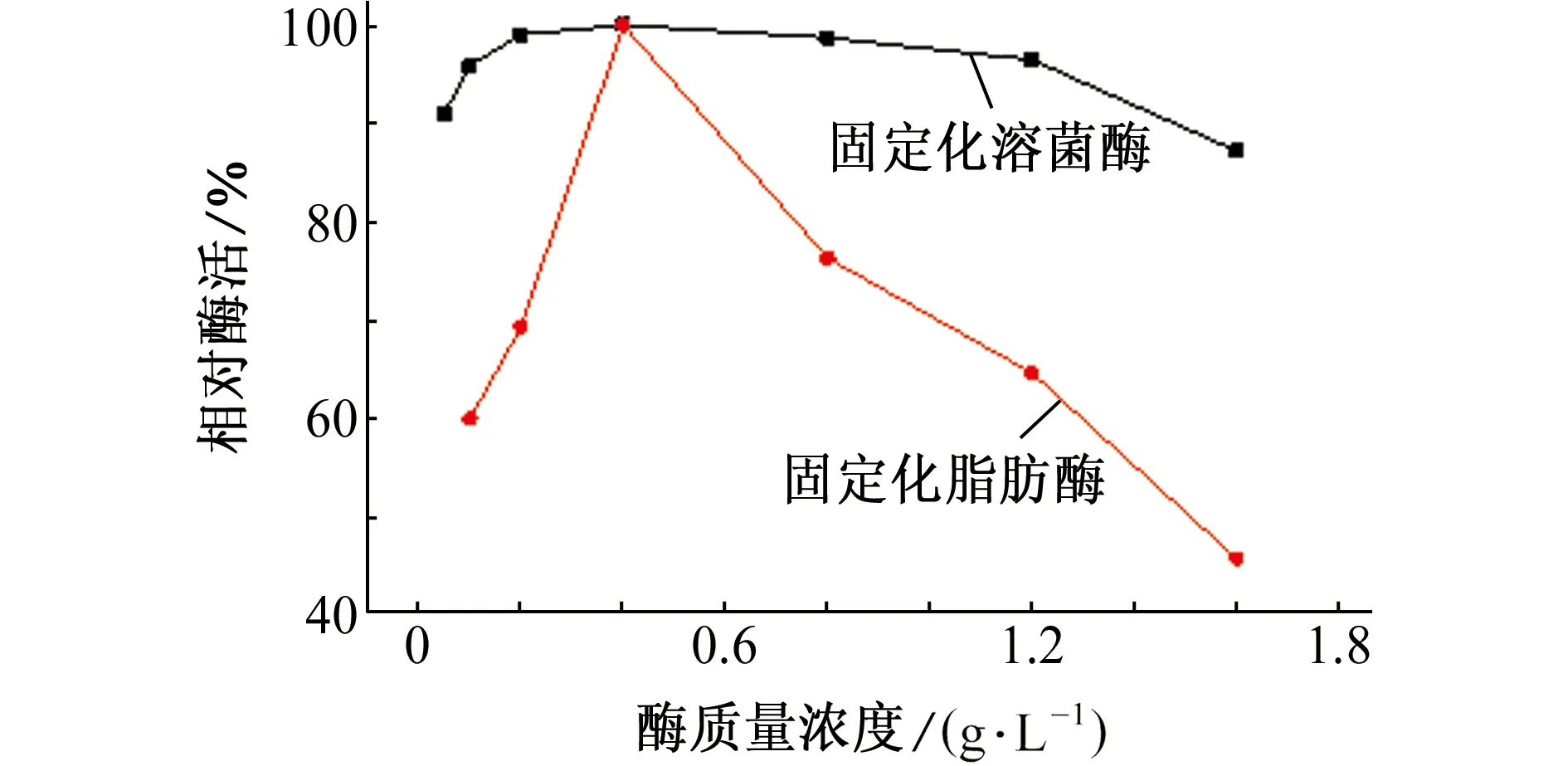
图5 给酶量对固定化酶相对酶活的影响Fig. 5 Effect of enzyme concentration on relative activity of immobilized enzyme
2.2.2 固定化时间优化
取一定量氨基改性SBA-15介孔分子筛,加入到质量浓度均为0.4 g/L溶菌酶和脂肪酶的Na2HPO4-NaH2PO4缓冲液(50 mmol/L,pH 7)中,在25 ℃下考察固定时间对固定化溶菌酶和固定化脂肪酶相对酶活的影响,结果见图6。由图6可知,随着固定化时间的延长,固定化溶菌酶和固定化脂肪酶的相对酶活均先升高后降低,在固定化时间为6 h时,相对酶活达到最大值。当固定化时间较短时,交联反应不充分,酶和氨基改性SBA-15分子筛的结合受到限制。当固定化时间超过6 h后,由于交联时间的延长,过多的活性醛基与载体间形成多点结合,产生空间位阻,使酶分子的活性中心不易和底物分子结合。同时,随着固定时间的延长,酶分子可能形成团聚现象,使酶分子的活性中心相互掩蔽,造成了酶活性的降低,固定化时间过长,也可能导致部分酶分子失活。因此,超过一定的时间后固定化溶菌酶和固定化脂肪酶的活性,均会下降。故制备固定化溶菌酶和固定化脂肪酶的最佳固定时间均为6 h。

图6 固定化时间对固定化酶相对酶活的影响Fig. 6 Effect of immobilization time on relative activity of immobilized enzyme
2.2.3 缓冲液pH优化
取一定量氨基改性的SBA-15介孔分子筛,分别加入到质量浓度均为0.4 g/L的溶菌酶和脂肪酶的缓冲液(50 mmol/L)中,在25 ℃固定化6 h后,考察缓冲液pH对固定化溶菌酶和固定化脂肪酶相对酶活的影响,结果如图7所示。由图7可知,随着缓冲液pH的增大,固定化溶菌酶和固定化脂肪酶的相对酶活均先增大后减小,分别在缓冲液pH为6.5和7.0时固定化溶菌酶和固定化脂肪酶相对酶活达到最大值。缓冲液pH过高或过低,都会对酶产生一定的损坏,导致酶活性降低。缓冲液pH的变化能够改变氨基改性SBA-15分子筛与酶接触的微环境。由于溶菌酶和脂肪酶都是具有生物活性的蛋白质,pH对其构象和带电状态会有一定的影响,酶构象的变化会引起酶活性的丧失[17]。因此,固定化溶菌酶和固定化脂肪酶的最佳pH条件分别为6.5和7.0。
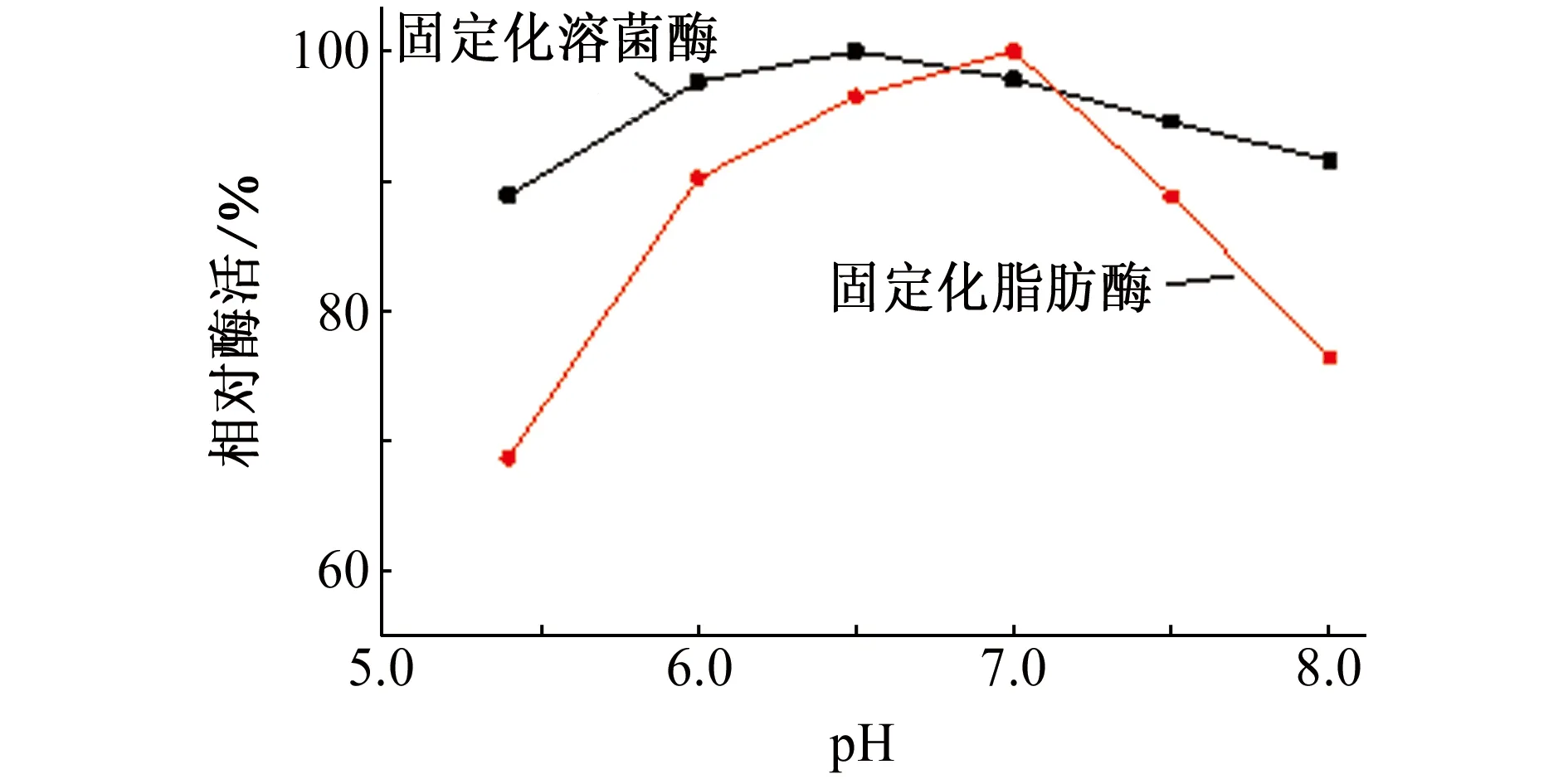
图7 缓冲液pH对固定化酶相对酶活的影响Fig. 7 Effect of pH value of buffer solution on relative activity of immobilized enzyme
2.2.4 缓冲液离子强度优化
取一定量氨基改性SBA-15介孔分子筛,加入到质量浓度均为0.4 g/L,pH分别为6.5和7.0的溶菌酶和脂肪酶的缓冲液中,在25 ℃固定化6 h,考察缓冲液离子强度对固定化溶菌酶和固定化脂肪酶相对酶活的影响,结果见图8。由图8可知,缓冲液离子强度为50 mmol/L时,固定化溶菌酶和固定化脂肪酶的相对酶活最高,当缓冲液离子强度高于或低于50 mmol/L时,固定化溶菌酶和固定化脂肪酶的相对酶活均有降低。缓冲液离子强度较低时,缓冲作用较弱,无法提供一个稳定的作用环境。而当缓冲液离子强度较高时,酶分子周围的电荷屏蔽效应显著,使酶的活性基团无法与底物有效结合。同时,缓冲液离子强度较高时,还可能会造成酶分子活性的降低。因此,缓冲液离子强度过高或过低都会造成相对酶活的降低,固定化溶菌酶和固定化脂肪酶的最佳缓冲液离子强度为50 mmol/L。
综上所述,溶菌酶的最佳固定条件为:给酶量0.4 g/L,固定时间6 h,缓冲液离子强度50 mmol/L,缓冲液pH 6.5;脂肪酶的最佳固定条件为:给酶量0.4 g/L,固定时间6 h,缓冲液离子强度50 mmol/L,缓冲液pH 7.0。

图8 缓冲液离子强度对固定化酶相对酶活的影响Fig. 8 Effect of ionic strength of buffer solution on relative activity of immobilized enzyme
2.3 共固定化双酶条件优化
在先固定溶菌酶后固定脂肪酶(方法1)、先固定脂肪酶后固定溶菌酶(方法2)、脂肪酶和溶菌酶同时在缓冲液pH为6.5时固定(方法3)、脂肪酶和溶菌酶同时在缓冲液pH为7.0时固定(方法4)4种共固定化方式中,方法1获得的固定化溶菌酶和固定化脂肪酶的相对酶活均较高,故采用先固定溶菌酶再固定脂肪酶的方式,以氨基改性SBA-15分子筛为载体对溶菌酶和脂肪酶进行共固定化。
共固定化双酶正交试验结果如表2所示。由表2可知,各因素对双酶共固定化效果影响的顺序为溶菌酶质量浓度>脂肪酶固定化时间>溶菌酶固定化时间>脂肪酶质量浓度,共固定化双酶最佳条件组合为:溶菌酶质量浓度0.2 g/L、溶菌酶固定化时间6 h、脂肪酶质量浓度0.8 g/L、脂肪酶固定化时间10 h。以该最佳条件组合进行验证试验,测得缓蚀率为93.43%。
2.4 复合涂层的缓蚀性能
添加不同量共固定化双酶的复合涂层的极化曲线如图9所示,其拟合电化学参数见表3。根据自腐蚀电流密度按式(3)计算缓蚀率ηp,结果也列于表3中。
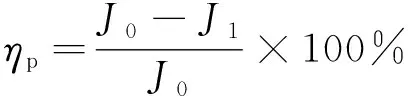
(3)
式中:J0、J1分别为裸碳钢及带复合涂层碳钢的腐蚀电流密度。
自腐蚀电位Ecorr反映了复合涂层发生腐蚀的难易程度,腐蚀电流密度Jcorr反映了复合涂层的腐蚀速率。由表3可知,带复合涂层碳钢的腐蚀电流密度比裸碳钢的明显减小,同时裸碳钢的自腐蚀电位也远低于带复合涂层碳钢的,这表明复合涂层使碳钢的耐腐蚀性能增强。另外,复合涂层的耐腐蚀性能均优于纯环氧树脂涂层的,纯环氧树脂涂层的缓蚀率为93.34%。随着共固定化双酶添加量的增加,复合涂层的缓蚀率先增大后减小,最大值出现在添加量为1.5%时。共固定化双酶添加到环氧树脂后,增加了腐蚀性物质扩散到金属表面的曲折度,因此涂层的耐腐蚀性能提高。当共固定化双酶添加量过少时,环氧树脂中溶剂挥发留下的孔隙未能被充分填充,导致水、氧气和其他腐蚀性物质可以通过孔隙接触基体表面;添加量过多时,纳米颗粒可能会发生团聚和堆积现象,腐蚀性介质可以通过堆积界面接触到基体。因此,复合涂层中共固定化双酶的最佳添加量为1.5%,此时其缓蚀率为96.61%。
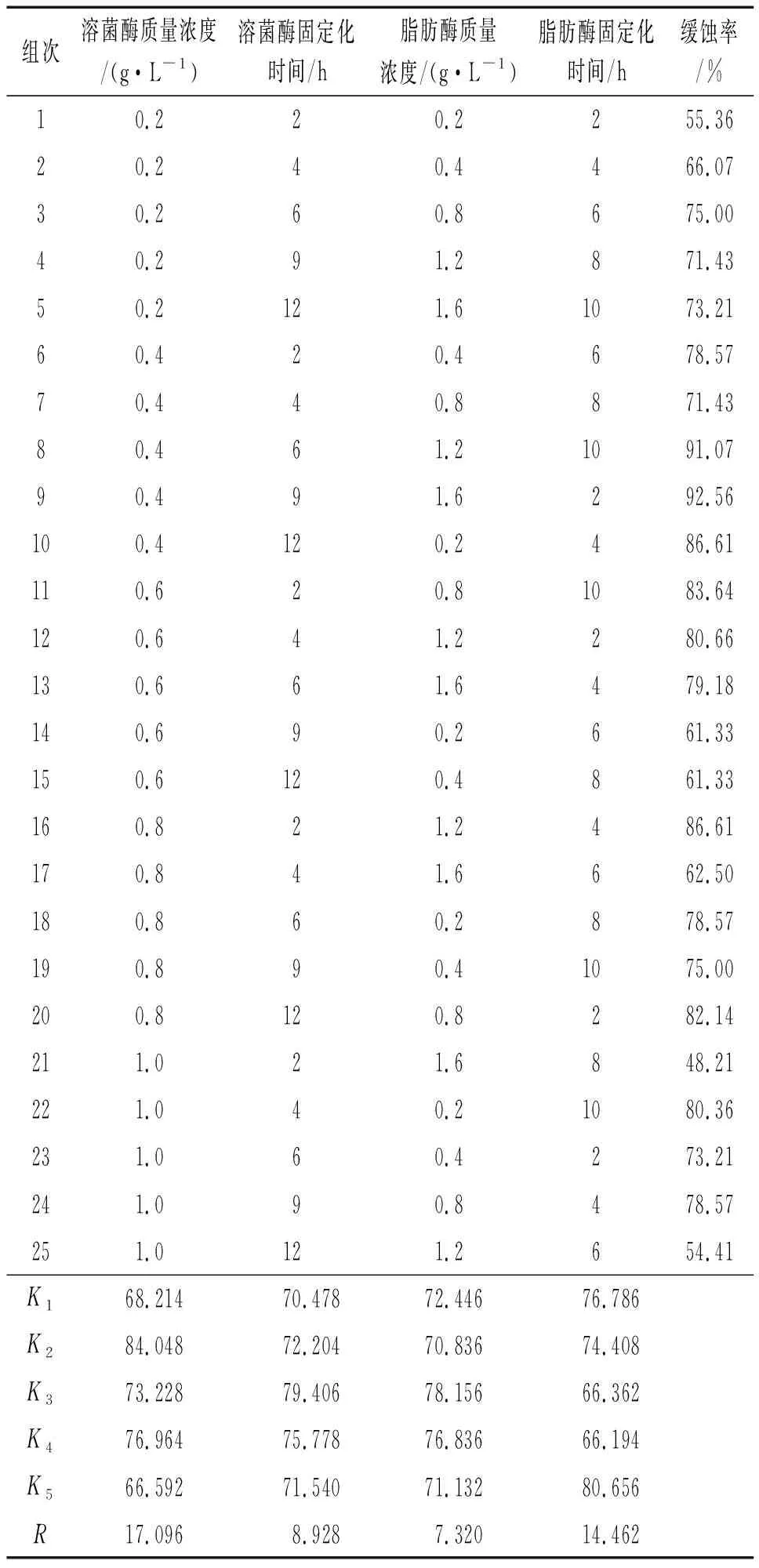
表2 共固定化双酶正交试验结果Tab. 2 Orthogonal test results of co-immobilized double enzyme
图10为添加不同量共固定化双酶的复合涂层的电化学阻抗谱,根据图11所示等效电路对电化学阻抗谱进行拟合,得到的电化学参数见表4。其中,Rs为溶液电阻;Rc为涂层电阻,反应涂层阻挡电解质穿透涂层的能力;Cc为涂层电容,由于电解质渗透到涂层时,可能会改变介电常数,使涂层的电容变化,故Cc反应涂层的抗渗透性能[18]。根据拟合得到涂层电阻计算缓蚀率ηR,结果也列于表4中。
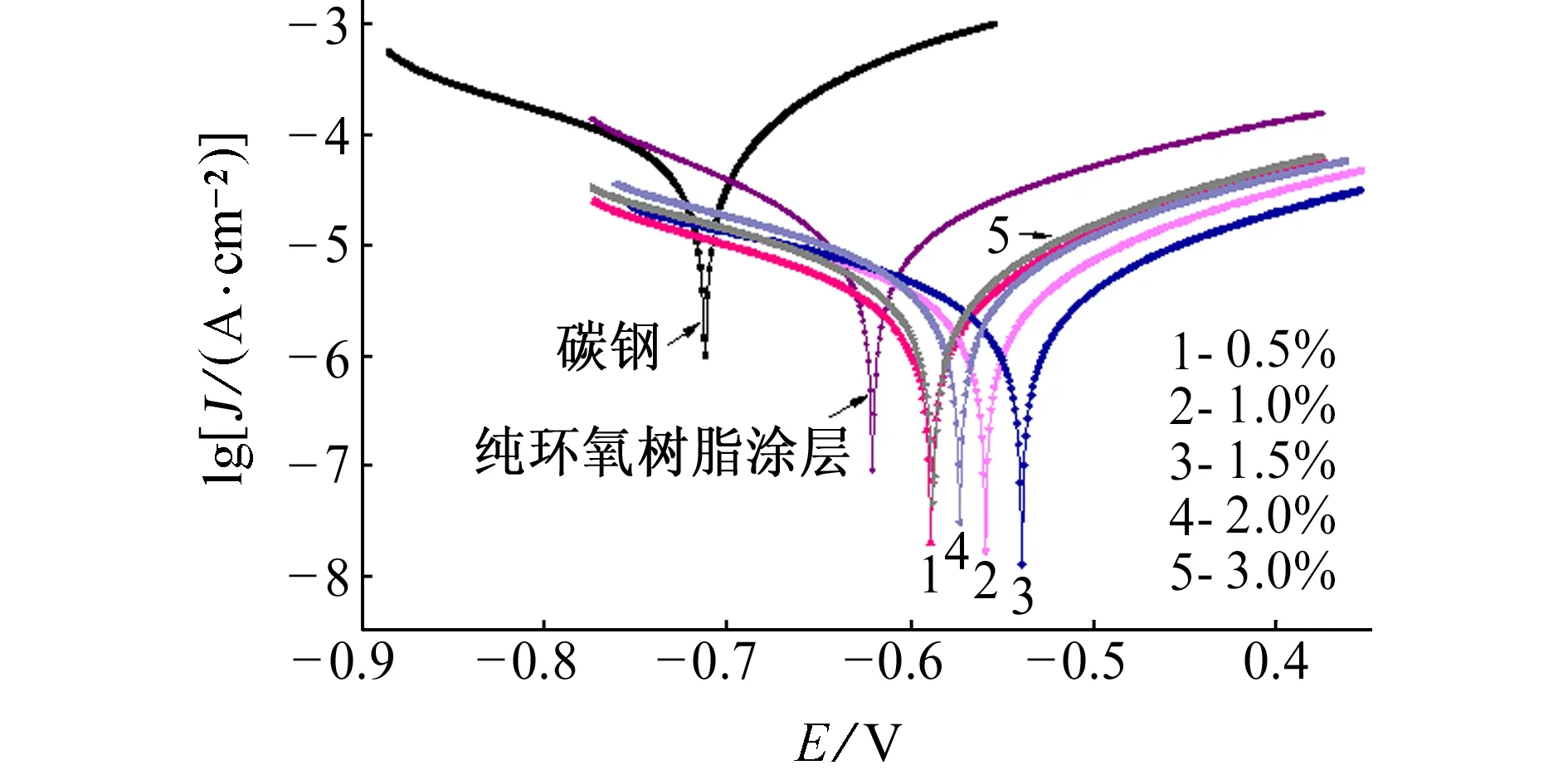
图9 添加不同量共固定化双酶的复合涂层的极化曲线Fig. 9 Polarzation curves of composite coatings added with different amounts of co-immobilized double enzymes

表3 添加不同量的共固定化双酶复合涂层极化曲线的拟合电化学参数Tab. 3 Electrochemical parameters fitted from polarzation curves of composite coatings added with different amounts of co-immobilized double enzymes
在Nyquist图的高频端出现了一个半圆弧,半圆弧的直径越大,说明电荷转移的电阻越大,复合涂层具有较高的电阻和较低的容抗,其耐腐蚀性越强,可以阻止NaCl溶液渗透到基体和涂层的界面使基体免遭腐蚀[19]。复合涂层的Nyquist曲线均存在单容抗弧和一个时间常数,说明基体未发生电化学腐蚀。电化学阻抗谱分析结果表明,共固定化双酶添加量为1.5%时复合涂层的耐腐蚀性能最好,纯环氧树脂涂层的最差。溶剂挥发导致环氧树脂涂层中存在大量孔隙,腐蚀性物质可以通过孔隙与基体表面接触,造成腐蚀[20]。共固定化双酶添加量为1.5%时,共固定化双酶既可充分填充孔隙,又不会因添加量过多导致团聚,因此该涂层具有最好的耐腐蚀性能。这与Tafel曲线和Nyquist曲线的测定结果一致。

(a) Nyquist图

(b) Bode图图10 加不同量共固定化双酶的复合涂层的电化学阻抗谱Fig. 10 Nyquist plots (a) and Bode plots (b) of composite coatings added with different amounts of co-immobilized double enzymes

图11 电化学阻抗谱对应的等效电路图Fig. 11 Equivalent circuit corresponding to EIS
3 结论
(1) 成功制备氨基改性SBA-15介孔分子筛,孔径为7.85 nm,比表面积为574.75 m2/g。
(2) 采用单因素试验优化溶菌酶和脂肪酶固定化条件。溶菌酶的最佳固定条件为:给酶量0.4 g/L,固定时间6 h,缓冲液离子强度50 mmol/L,缓冲液pH 6.5;脂肪酶的最佳固定条件为:给酶量0.4 g/L,固定时间6 h,缓冲液离子强度50 mmol/L,缓冲液pH 7.0。共固定化双酶的方法是先固定溶菌酶后固定脂肪酶。在确定固定化双酶顺序的基础上,采用正交试验得共固定化双酶的最优条件为溶菌酶质量浓度0.2 g/L,溶菌酶固定化时间6 h,脂肪酶质量浓度0.8 g/L,脂肪酶固定化时间10 h。最优条件下制得的共固定化双酶的缓蚀率为93.43%。
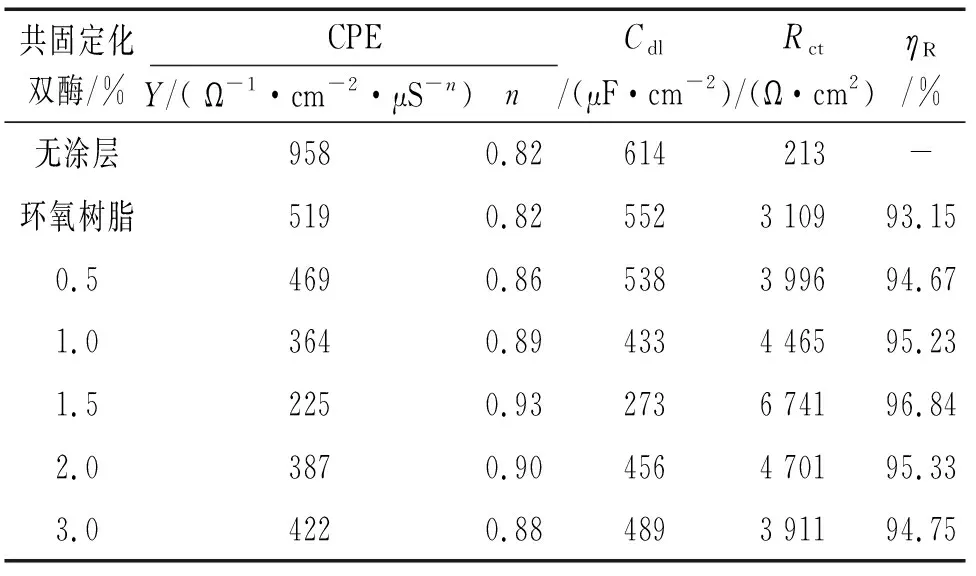
表4 添加不同量共固定化双酶复合涂层EIS的拟合参数Tab. 4 Fitted parameters of EIS of composite coatings added with different amounts of co-immobilized double enzymes
(3) 在环氧树脂中添加氨基改性SBA-15介孔分子筛共固定化双酶可改善其耐腐蚀性能。当共固定化双酶的添加量为1.5%时,复合涂层具有最佳的耐腐蚀性,其缓蚀率达96.61%。

