碱性电解水提取灵芝子实体多糖的工艺优化*
苗雨欣,刘 旭,宁慧娟,葛鑫会,张京声,孙君社,张秀清
(中国农业大学食品科学与营养工程学院,北京100083)
灵芝 (Ganoderma lucidum) 属担子菌纲 (Basidiomycetes) 多孔菌目 (Aphyllophorales) 多孔菌科(Polyporaceae)灵芝属(Ganoderma Karst.)真菌,在我国已有2 000多年药用历史。灵芝含有多种活性物质如三萜、多糖、生物碱和甾醇等[1-2],其中灵芝多糖具有抗氧化、抗肿瘤、降血糖及免疫调节等作用[3-9]。灵芝子实体主要由纤维素、半纤维素和木质素组成,质地坚硬,结构复杂,导致灵芝多糖难以溶出,常规的水提醇沉法得率相对较低[10],超声波法、微波法、酶提取法可以提高多糖得率[11-13],但提取成本高,操作复杂;碱提法或酸提法提取多糖,如赵琪[14]采用强酸性电解水提取灵芝多糖,结合挤压膨化技术预处理,灵芝多糖的得率可达6.90%,但多糖易发生降解,且操作易腐蚀设备、污染环境;而电解水作为提取溶剂则可避免上述方法的缺点。由于电解水具有较高的溶解性、较小分子簇等特点[15-16],与碱提法相比具有成本低廉、不污染环境、不腐蚀设备等优点,因此,试验通过碱性电解水提取灵芝子实体多糖,以探讨碱性电解水提取灵芝多糖的最佳工艺条件。
1 材料与方法
1.1 材料与仪器
选用来源于陕西汉中栽培基地的大段木赤灵芝。葡萄糖、木糖购于Sigma公司;浓硫酸、苯酚、无水乙醇等均为国产分析纯试剂。
试验所用电解槽为自制常规双槽隔膜式电解槽(40 cm×20 cm×20 cm),隔膜选用阳离子交换膜;极板为涂钌钛网,极板距离固定10 cm;外界变压调节器(0~220 V);纯钛板:北京中北钛业有限公司;异相离子交换膜:上海化工厂;Agilent 1200高效液相色谱仪:Agilent科技有限公司;TU-1901双光束紫外分光光度计:北京普析通用仪器厂;CypherS原子力显微镜:Asylum Reaserch公司。
1.2 试验方法
1.2.1 灵芝粗多糖的提取
将灵芝子实体粉碎后过40目筛,以5∶1(mL∶g)比例加入一定体积的石油醚,60℃水浴3 h脱脂,以1∶5(g∶mL) 比例加入95%的乙醇水浴3 h,并调节所得提取液pH,4 000 r·min-1离心15 min,取上清液加入4倍体积无水乙醇,4℃保存过夜;8 000 r·min-1离心10 min弃上清液,沉淀则为粗多糖。粗多糖60℃烘干后溶于蒸馏水,定容至50 mL,准确吸取灵芝多糖提取液1 mL制备待测样液。使用苯酚-硫酸法测定多糖含量[17]。多糖得率(w,%) 测定公式为:
式中:m0为多糖含量(g);m 为样品质量(g)。
1.2.2 电解水的制备
在电解槽阳极加入NaCl溶液(10 g·L-1),阴极加少量NaCl(0.01 g·L-1),电压维持在20 V左右,电解15 min~150 min得到不同pH的电解水。
1.2.3 灵芝子实体多糖含量及得率测定
准确称取105℃干燥至恒重的葡萄糖1.0 g,用去离子水定容至100 mL,取1 mL该溶液定容至100 mL,配成 0.1 mg·mL-1的葡萄糖标准溶液。准确吸取标准溶液 0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL,分别置于试管中加去离子水补充体积至2.0 mL;再各加入 5%的苯酚 1.0 mL,摇匀,迅速滴加浓硫酸5.0 mL;静置10 min后,摇匀,待反应液完全冷却,于波长490 nm条件下测定其吸光度值,水为空白对照。以葡萄糖含量为横坐标,吸光度值为纵坐标,绘制葡萄糖标准曲线见图1。
由图1所示,根据葡萄糖对照品含量与吸光度值的线性关系得回归方程 y=7.801 2x+0.001 8,R2=0.999 9,说明葡萄糖含量与吸光值的线性关系良好。
1.3 灵芝子实体多糖碱性电解水提取工艺的单因素试验
经多次预试验,选取料液比、电解水pH、提取温度和水浴提取时间4个因素,考察单因素对灵芝子实体多糖提取率的影响。按照灵芝子实体多糖提取流程 1.2.1 操作,料液比 (g∶mL) 选取 1 ∶15、1∶25、1∶35、1∶45、1∶55、1∶65、1∶75,电解水溶液 pH 选取 8.5、9.5、10.5、11.5、12.5,提取温度选取60℃、70℃、80℃、90℃、100℃,以上3个单因素试验时,水浴提取时间设置为60 min。水浴提取时间选取 15 min、35 min、55 min、75 min、95 min、115 min、135 min和155 min,确定最佳提取条件。
1.4 响应面试验设计
根据Box-Behnken的中心组合试验设计原理,综合单因素试验结果,选取料液比(A)、电解水pH(B)、水浴提取时间(C) 3个因素,以灵芝多糖的含量为响应值(Y),在单因素试验的基础上,采用3因素3水平的响应面分析方法。
1.5 原子力显微镜观察
原子力显微镜是在扫描隧道电子显微镜基础上发展起来的物质结构分析方法,已成为验证高分子结构的一种重要工具[18]。以试验1.2.1水提法提取的灵芝多糖为对照,将水提和最优条件电解水提取的灵芝多糖固体样品用去离子水溶解至0.01 mg·mL-1,再吸取5 μL~10 μL于云母片上晾干后固定,进行AFM测定。
2 结果与分析
2.1 不同单因素对灵芝子实体多糖得率的影响
不同单因素对多糖提取率的影响见图2。
如图2所示,料液比对灵芝多糖的提取有一定影响,灵芝多糖的含量随料液比的增大呈现先增加后降低的趋势。在电解水pH12.5、提取温度100℃、提取时间60 min条件下,当料液比达到 1∶45(g∶mL) 时,灵芝多糖得率较高,达2.89%,继续增加溶剂用量效果不显著,会造成溶剂损耗。
料液比确定的条件下,灵芝多糖得率随电解水pH的增加而增加,碱性电解水对灵芝多糖的得率有显著提高(P<0.05)。在料液比为1∶45、提取温度为100℃、提取时间为60 min条件下,当电解水pH为12.5时,多糖得率最高,为pH 8.5所获得多糖含量的1.65倍。推测在碱性电解水的作用下,随着电解水pH的逐渐升高,灵芝子实体中木质素溶出增加、细胞壁结构的破坏程度也逐渐加大,使得电解水可更充分地进入灵芝子实体的细胞壁结构中,从而提高灵芝多糖提取率。但是由于电解水制备pH极限为12.5,综合实际因素,选择pH 12.5电解水作为下一步提取方法优化溶剂。
在料液比为 1∶45(g∶mL),电解水 pH 12.5,浸提时间60 min条件下,随着提取温度的升高,灵芝多糖含量不断增加,100℃时含量最高。
当提取时间达到95 min时,灵芝多糖得率较高,为3.09%;当提取时间达135 min时,多糖得率显著下降,可能是由于多糖在溶液中浸提时间过长,造成多糖结构被破坏[19]。
2.2 子实体多糖碱性电解水提取工艺响应面优化
2.2.1 响应面试验结果分析
在单因素试验的基础上,基于降低提取温度后显著降低了多糖提取率,后续工艺优化中直接选100℃即沸水浴作为提取温度。选取料液比、电解水pH、沸水浴提取时间3因素进行响应面分析法优化灵芝子实体多糖的提取工艺。试验因素与水平设计见表1,试验方案设计及结果见表2。

表1 灵芝多糖碱性电解水提工艺响应面分析因素与水平Tab.1 Levels and factors used in the response surface design
用Design-expert 8.0对响应面试验结果进行分析,建立料液比(A)、电解水pH(B)、沸水浴提取时间(C)3因素数字回归模型为:
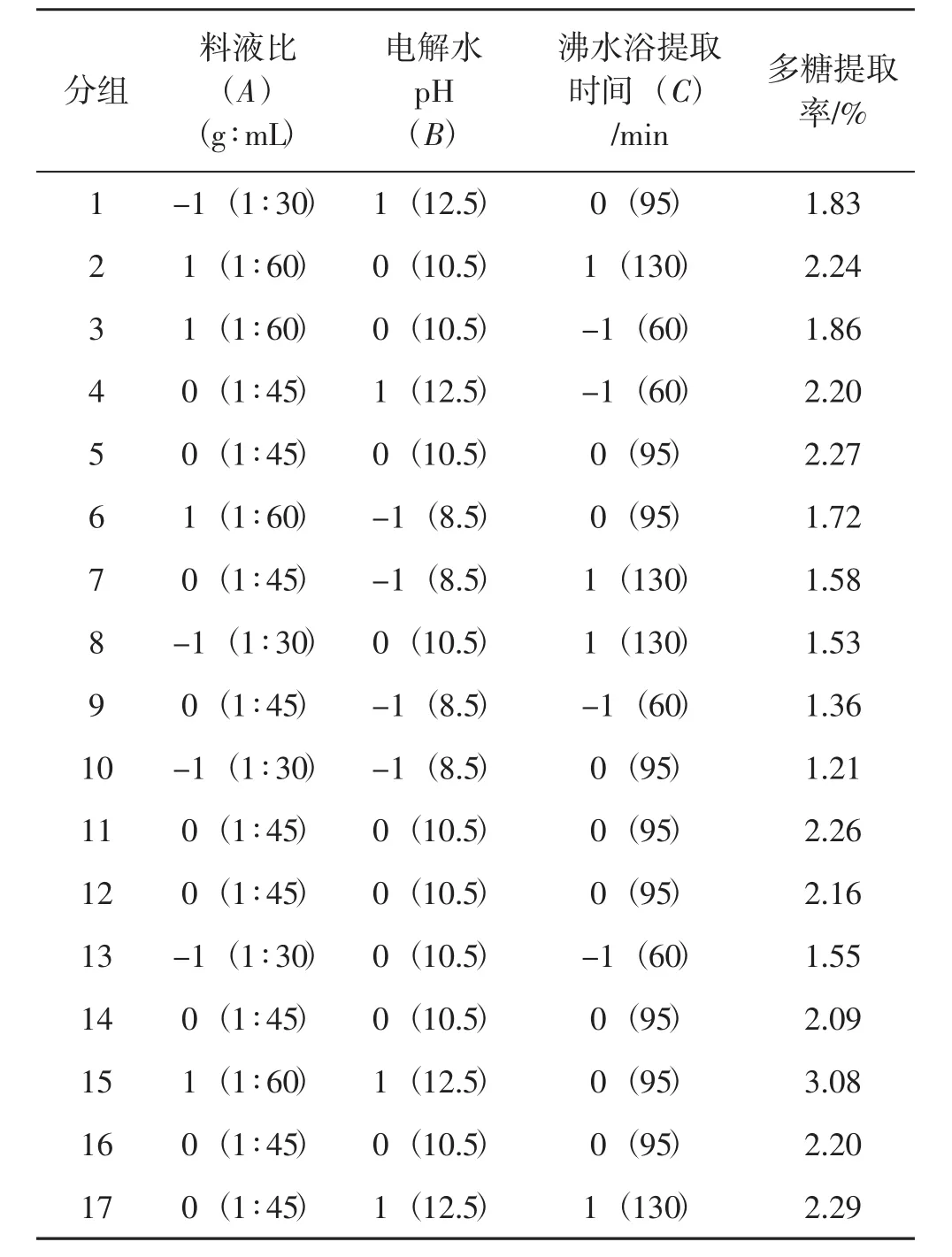
表2 灵芝多糖提取工艺优化响应面试验结果与分析Tab.2 The results for response surface methodology of alkaline electrolysed water extraction Ganoderma lucidum polysaccharides
其回归方差分析结果见表3。由表3可以看出,一次项中,A(料液比)和B(电解水的pH)对多糖得率的线性效应极显著(P<0.01),C(提取时间)对多糖含量的线性效应不显著(P>0.05),二次项中,C2影响极显著 (P<0.01),AB、A2影响显著 (P<0.05),AC、BC、B2、C2影响不显著。此模型显著性检测P值为0.000 3,模型极显著。失拟项P值0.062 8>0.05,差异不显著,校正模型的相关系数R2值为0.965 6,决定系数R2Adj值为0.921 4,表明所选用的二次回归模型与实际情况拟合较好,误差小,能较好反应各因素与灵芝多糖得率之间关系。由F值可知,在试验范围内各因素对灵芝多糖得率的影响大小依次为B(电解水pH) >A(料液比)>C(提取时间)。
2.2.2 灵芝子实体提取工艺的响应面优化与分析
采用Design-Expert 8.0软件处理得到响应面分析结果见图3。如图3所示,响应面曲线梯度反映各因素对灵芝多糖提取率的影响大小,曲线越陡则表示该因素对灵芝多糖提取率影响越明显。图3A为固定沸水浴提取时间得到交互作用显著的料液比和电解水pH响应面图,图形的走势极其陡峭,表明料液比和电解水pH交互作用显著,这也与方差分析结果一致。图3B为固定料液比得到的电解水pH和沸水浴提取时间交互作用响应面图,灵芝多糖提取率随着电解水pH的增加而上升,当电解水pH为12.5时,多糖得率最高。由此推测,较高pH的电解水提取有助于减轻细胞壁聚合物分子间的物理和化学作用,使不溶性纤维素、木质素、半纤维素与果胶多糖之间的化学键断裂,从而提高多糖提取率,但过高的碱浓度反而会引起多糖结构的破坏。图3C为固定电解水pH得到的沸水浴提取时间与料液比交互作用的响应面图,随着沸水浴提取时间的增加,多糖提取率增大,当提取时间增加到约95 min后,继续延长沸水浴提取时间,多糖提取率反而下降,这可能是由于提取时间过长,造成多糖分解。
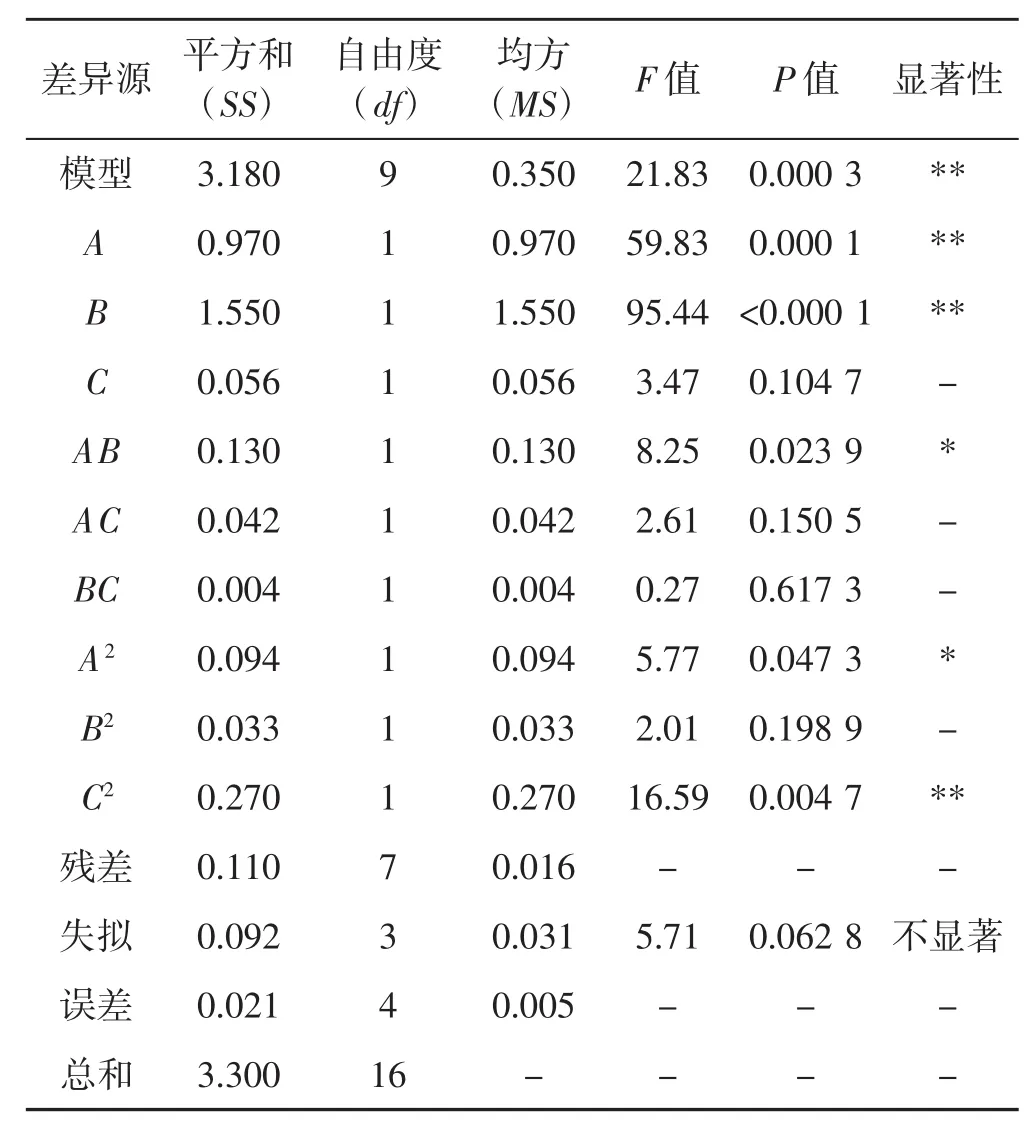
表3 响应面回归模型的方差分析Tab.3 Analysis of variance for the fitted regression model
2.2.3 验证试验结果
通过回归模型的分析,确定灵芝子实体多糖碱性电解水提工艺的参数为:料液比1∶60(g∶mL),电解水pH 12.5,沸水浴提取时间 105.63 min。在此条件下模型预测灵芝子实体多糖的提取率为3.0%。为方便实际操作,将工艺条件调整为:料液比1∶60(g∶mL),电解水 pH 12.5,沸水提取时间 105 min,最终测得灵芝多糖的提取率为(3.11±0.10)%,与理论预测值的误差为0.11%。与水提法(提取率为1.78%)相比,碱性电解水提灵芝多糖的提取率提高了74.72%。说明采用响应面法优化得到的多糖提取工艺参数可靠,具有一定的应用参考价值。
2.3 灵芝子实体多糖AFM分析
通过对分散在云母片上的2种灵芝多糖进行观察和检测,见图4。由图4可知,灵芝多糖均呈现球形或棒状结构,这些大颗粒被认为是多糖分子聚集形成,推测多糖可能呈紧凑的卷曲构象。水提灵芝多糖分子长度为225 nm~255 nm(图4A),高度2.1 nm~3.7 nm (图4C),而碱性电解水提取得到的多糖分子长度为314 nm~372 nm(图4B),高度为2.8 nm~4.3 nm (图 4D),二者形态相似,后者分子略大。羊肚菌多糖的原子力显微镜观察显示其为链状与带有裂纹球形体,链高0.53 nm~1.34 nm,宽度为40 nm,球形体直径约为50 nm~100 nm[20]。这显示食用菌类多糖的分子大小和形态具有一定的规律。
3 结论
通过单因素和响应面优化试验,确定了灵芝多糖的最佳提取条件为电解水pH 12.5,料液比1∶60(g∶mL),沸水浴提取时间105 min。在此工艺下,与传统水提法相比,碱性电解水提取灵芝多糖的得率提高了74.72%。水提灵芝多糖分子长度为225 nm~255 nm,高度 2.1 nm~3.7 nm,而碱性电解水提取得到的多糖分子长度为314 nm~372 nm,高度为2.8 nm~4.3 nm。碱性电解水提取得到的多糖分子略大,其具体结构组成和生理活性有待进一步分析。

