叶酸干预奥氮平所致的精神分裂症患者血脂代谢异常的疗效观察
杨世涛,黄 锦
(建德市第四人民医院 1.精神科;2.老年心身科,浙江 杭州 311612)
精神分裂症是一种病因未明、精神活动与环境不协调为主要表现形式的精神疾病[1],可造成患者思维、情感、行为等多方面的障碍,部分患者出现认知功能损害。发病后患者生理功能有慢性化和衰退的倾向,但部分患者可通过积极治疗保持基本痊愈状态。目前以氯氮平和奥氮平为首的第二代抗精神病药物(second generation antipsychotic drugs,SGA)为该病的主要治疗药物,但研究发现SGA会引起精神分裂症患者的脂代谢参数异常[2]。叶酸属B族维生素,能改善由胆汁淤积造成的血脂异常[3],能通过恢复小鼠肝内腺苷酸活化蛋白激酶(AMPK)活性而改善胆固醇和血糖的代谢[4]。本研究观察奥氮平联合叶酸对首发精神分裂症患者的疗效,探讨叶酸干预奥氮平致精神分裂症患者血脂代谢异常的作用。
1 资料与方法
1.1 病例来源 选取2017年1月—2019年1月于建德市第四人民医院精神科就诊的首发精神分裂症患者80例,纳入标准:①符合国际疾病分类第10版精神分裂症的诊断标准;②年龄18~45岁,性别不限;③病程不超过1年;④既往未服过任何抗精神病药物;⑤患者及家属自愿配合本研究且签署知情同意书。排除标准:①治疗过程中出现病情恶化或严重并发症;②发生严重药物不良事件;③患者自行使用其他抗精神分裂症药物;④破盲;⑤患有高血压、心脏病、糖尿病及肝肾功能不全等重大躯体疾病者;⑥孕妇或哺乳期妇女;⑦药物及酒精依赖者。本研究经医院伦理学研究委员会批准。
1.2 一般资料 80例患者按照随机数字表法分为A组与B组各40例。A组年龄18~40岁,平均(25.53±3.74)岁;病程0~3月,平均(1.73±0.42)月。B组年龄19~40岁,平均(26.10±3.92)岁,病程0~3月,平均(1.69±0.37)月。2组一般资料差异无统计学意义(P<0.05)。
1.3 治疗方案 2组治疗均以奥氮平(江苏豪森药业股份有限公司,国药准字:H20010709)2.5 mg初始剂量开始,每晚口服一次,根据患者的临床表现酌情增加药量,单次增加2.5 mg/d,以15 mg/d为最大给药量。A组给予奥氮平联合安慰剂治疗方案,B组给予奥氮平联合叶酸治疗方案。叶酸服用方法:每次0.4 mg,每日3次,安慰剂为外观与叶酸药片同样的淀粉片剂,由本院制剂室提供,用法同叶酸。两组均治疗12周。
1.4 观察指标
1.4.1 临床症状与不良反应 主治医师评估治疗前后患者阳性和阴性症状量表(PANSS)得分、副反应量表(TESS)得分,PANSS评分分为阳性、阴性症状评分和一般病理评分,共30个条目,按照严重程度分为1~7级,得分越高表示患者精神分裂症症状越严重。副反应量表(TESS)适用于各种精神药物引起副作用的成年患者,包括病情严重程度、症状与药物的关系及采取的措施。观察患者用药后出现的不良反应,包括恶心、呕吐、乏力、头痛及椎体外系反应(肌肉震颤、静坐不能)等,统计不良反应发生例数。
1.4.2 相关生化指标 统计治疗前后患者血清胆固醇(cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、载脂蛋白A1(apolipoprotein A1,Apo A1)、载脂蛋白B(apolipoprotein B,Apo B)、空腹血糖(fasting blood glucose,Fasting Glu)、同型半胱氨酸(homocysteine,Hcy)、血尿酸(blood uric acid,UA)水平以及体质量指数(body mass Index,BMI)。生化指标由全自动生化分析仪(江苏南京东软威特曼公司提供)检测。
1.5 统计学方法 采用SPSS19.0软件处理数据,计量资料2组间比较用t检验,计数资料行χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 量表评分 治疗前后量表统计结果显示:治疗后,2组PANSS量表、TESS量表得分均低于治疗前,且B组PANSS量表得分低于A组,差异均有统计学意义(P<0.05);见表1。
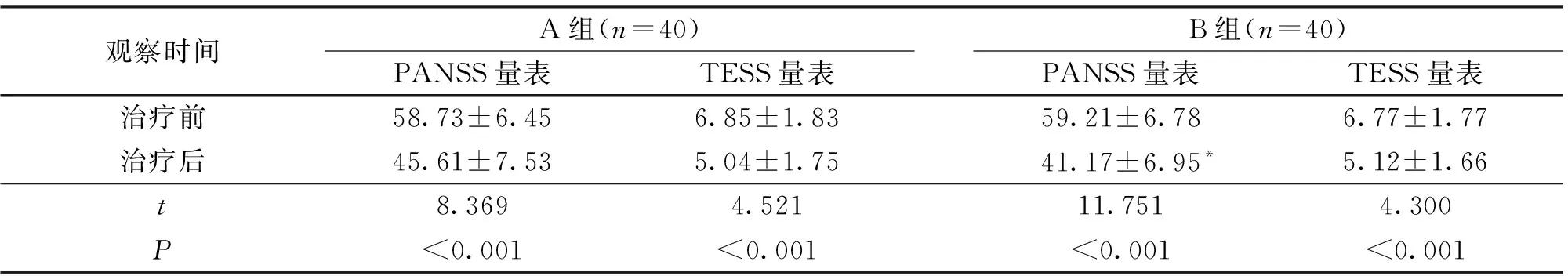
表1 治疗前后2组患者的量表评分结果比较(分)
2.2 不良反应 治疗期间,A组共13例患者出现不良反应,其中6例为恶心、呕吐,4例乏力、头痛,3例椎体外系反应,具体表现为肌肉震颤、静坐不能,不良反应发生率为32.50%。B组共9例患者出现不良反应,其中6例为恶心、呕吐,2例嗜睡、乏力、头痛,1例椎体外系反应,不良反应发生率为22.50%。2组不良反应差异无统计学意义(χ2=1.003,P=0.317)。
2.3 治疗前后各指标检测结果 治疗前,2组各指标结果差异均无统计学意义(P>0.05);治疗后,除TG、UA 外,其余各指标结果2组间差异均有统计学意义(P<0.05)。治疗后,A组TC、TG、HDL-C、Apo A1、Glu、BMI和B组TC、TG、HDL-C、Apo B、Hcy均与本组治疗前差异有统计学意义(P<0.05),详见表2。
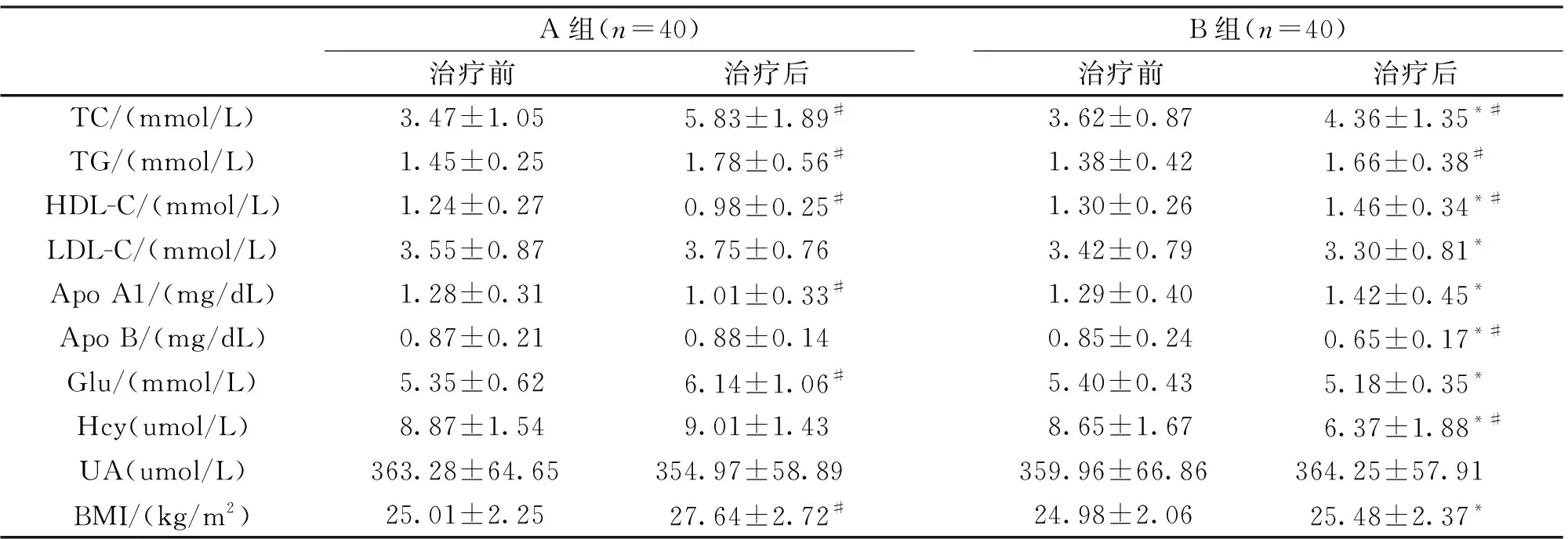
表2 治疗前后2组各生化指标和BMI检测结果比较(Mean±SD)
3 讨论
流行病学调查结果显示,在过去十年中,以奥氮平、氯氮平为代表的第二代抗精神病药物的使用量显著增加[5],因此,研究这些药物可能对其使用者的机体产生的影响至关重要。临床研究发现,服用第二代抗精神病药物的患者,其体重增加、血脂异常、代谢异常的发生率较使用利培酮的患者高[6]。王冬雪等[7]研究发现,服用奥氮平精神分裂症患者脂肪肝检出率和血脂增高检出率均高于正常人。体重增加、血脂异常、代谢异常等因素均为高血压、高血糖等代谢疾病的易感因素,长期用药增加患者继发中风、急性心肌梗死等心脑血管疾病风险[8]。故观察长期使用奥氮平的不良反应及其对患者血脂代谢的影响尤为重要。
第二代抗精神病药物多为D2、D4家族的多巴胺能拮抗剂和一些受体拮抗剂。多巴胺受体主要分布于肾脏,在血脂、血压调节中发挥作用。药理学研究显示多巴胺通过与细胞表面的G蛋白(GPCR)偶联的BP受体家族发挥其作用,分为D1样(D1和D5)和D2样(D2,D3和D4),这些受体可与肾素-血管紧张素-醛固酮系统(RAAS)相互作用[9]。同时多巴胺还参与Na+的肾小管转运和调节肠道运输。奥氮平主要作用机制是对D4受体的拮抗作用,但它阻断D2和5-HT2A,长期服用氯氮平导致血脂代谢紊乱。李艳[10]曾报道服用奥氮平4周,患者即表现出血酯代谢异常,而适量增补叶酸可以避免脂质代谢紊乱[11]。基于此,本研究给予首发精神分裂症患者长达12周的奥氮平联合叶酸治疗方案,探讨叶酸干预奥氮平致精神分裂症患者血脂代谢异常的作用。结果显示,2组治疗后PANSS量表、TESS量表均与治疗前呈显著差异,B组治疗后PANSS量表得分显著低于A组,而组间不良反应无明显差异。说明奥氮平联合叶酸给药方案可改善患者临床症状且安全有效。
本研究中,生化指标检测结果显示奥氮平联合安慰剂给药方案引起TC、TG、HDL-C、Apo A1、Glu、BMI异常,而奥氮平联合叶酸给药方案可改善由奥氮平引起的TC、HDL-C、Apo A1、Glu、BMI异常。推测可能与加入叶酸有关。当机体服用奥氮平后可引起血脂代谢异常,表现为Hcy含量下降,机体的胰岛素抵抗或胰岛素敏感性上调,载脂蛋白结合转运脂类能力增强,同时Apo A1含量增加,促进HDL-C成熟,成熟的HDL-C与肝细胞膜的HDL受体结合,将大部分胆固醇从肝外逆向运转至肝内,在肝脏的代谢下转变为胆汁酸。叶酸的含量与Hcy含量呈负相关[12],Hcy含量下降,叶酸含量上升,其修饰脂质体、抑制氧化应激的作用进一步增强[13],从而能够改善患者血脂异常状况,与仓沈元[14]的研究结果一致。另外补充叶酸后,机体胰岛素生成增加,胰岛素具有降低血糖的作用,故B组Glu水平低于A组。
综上所述,本研究发现叶酸联合奥氮平治疗精神分裂症的给药方案不良反应少,并可改善患者因服用奥氮平引起的血脂代谢异常,从而增加服药依从性,具有重要临床意义。

