尿素氮联合肥胖相关状态模型评估急性胰腺炎预后的价值
金雨舟, 马 娜
(南京医科大学附属常州市第二人民医院, 1. 消化内科, 2. 急诊内科, 江苏 常州, 213000)
约20%的急性胰腺炎(AP)患者会发展为中重度胰腺炎, 同时伴有胰腺及胰周组织坏死、多器官功能障碍综合征(MODS), 甚至可导致死亡[1]。既往AP的治疗多根据个体化的评估结果选择药物治疗、内窥镜和外科治疗等方案[2]。早期评估预后不良风险因素对救治重症胰腺炎患者至关重要,而临床上常用指标为血淀粉酶(AMS)、尿淀粉酶(UAMY)等,但与AP的严重程度及预后无显著相关性。研究[3]发现,尿素氮(BUN)、C反应蛋白(CRP)、D-二聚体(D-D)、纤维蛋白原(Fib)、空腹血糖(FBG)和血钙等可反映疾病的严重程度和患者的预后情况。研究[4-5]发现,肥胖是成人严重AP的重要危险因素,肥胖患者更易出现严重的炎症反应,发病率和死亡率均较高。本研究回顾性分析了300例AP患者BUN联合肥胖相关状态(ORS)模型与预后不良的相关性,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2017年12月—2019年12月本院收治的300例AP患者为研究对象, AP的临床诊断符合《中国急性胰腺炎诊疗指南》中相关标准。AP的分级参考国际通用的Ranson评分、急性生理与慢性健康评分(APACHE Ⅱ)相关标准。轻症急性胰腺炎(MAP): Ranson评分<3分, APACHE Ⅱ评分<8分; 重症急性胰腺炎(SAP): Ranson评分≥3分, APACHE Ⅱ评分≥8分,出现持续性的全身炎症反应综合征(SIRS)和MODS。AP入组标准: ① 初次发病者; ② 非手术治疗者; ③ 排除合并免疫功能障碍、肝肾功能障碍及胰腺发育不良等患者。300例患者中,病因方面以胆源性因素为主,高于高脂血症及其他; 病情程度方面以MAP为主, SAP及MAP进展为SAP(M-S)占少数; 胸膜渗出45例,意识障碍23例,急性呼吸窘迫综合征(ARDS)17例, SIRS 15例; 34例M-S; 治愈285例,死亡15例,死亡患者大多数出现胸膜渗出及意识障碍,且全部合并ARDS和SIRS。见表1。
1.2 相关指标及预后因素分析
本研究患者在入院24 h内进行BUN、体质量指数(BMI)、总胆固醇(TG)、FBG和糖化血红蛋白(HbA1c)检测,若患者处于疾病进展期,则再次检测BUN、TG、FBG。AP的诊断及预后指标包括平均动脉压、AMS、胸膜渗出、意识障碍、ARDS和SIRS等。BUN正常值为3.2~6.0 mmol/L, BMI正常值为18.5~24.0 kg/m2, TG正常值为0.4~1.7 mmol/L, FBG正常值为3.9~6.1 mmol/L, HbA1c正常值为4.0%~6.0%, 平均动脉压正常值为70.0~105.0 mmHg, AMS正常值为25.0~125.0 U/L。本研究以BMI>24.0 kg/m2合并TG或FBG或HbA1c高于正常值定义为ORS, 即采用ORS评估模型[4]。

表1 300例AP患者的一般资料
1.3 统计学方法

2 结 果
2.1 相关指标与AP病情程度及转归的关系
按照病情程度将300例患者分为MAP组、SAP组和M-S组,对BUN及肥胖相关指标BMI、TG、FBG、HbA1c进行单因素分析,结果显示, SAP相较于MAP, BUN升高, FBG升高, BMI升高, HbA1c升高。在MAP进展为SAP的34例中,进展时与首次检测相比, BUN升高, FBG升高。在AP患者的转归分析中,死亡患者相较治愈患者, BUN升高, FBG升高。见表2。上述结果提示, BUN和FBG对AP病情、进展及转归都存在显著的提示作用,而BMI和HbA1c对疾病分级存在提示作用。
2.2 BUN联合ORS评估模型与并发症、病情程度及转归的关系
联合BUN及ORS对AP患者的并发症情况、病情程度及转归进行相关性分析, BUN高于正常值记为BUN+, 其余记为BUN-; 患者达到ORS标准记为ORS+, 未达标准记为ORS-。将患者按照BUN、ORS情况分为BUN+ORS+、BUN-ORS+、BUN+ORS-、BUN-ORS-共4种组合。本研究结果显示,在AP并发症如胸膜渗出、意识障碍、ARDS及SIRS中, BUN+ORS+患者比率高于其他类型患者比率,差异有统计学意义(P<0.05); 在病情程度分级方面,4种组合的MAP比率差异无统计学意义(P>0.05), SAP、M-S中BUN+ORS+患者比率高于其他3种组合的患者比率,差异有统计学意义(P<0.05); 在AP死亡患者中,BUN+ORS+患者比率高于其他3种组合患者比率,差异有统计学意义(P<0.05)。见图1。上述结果提示BUN升高合并ORS时, AP患者的并发症发生率、重症比率及死亡风险显著增高。收集300例患者的BUN、ORS及相关指标,与AP预后风险进行相关性分析,结果显示, BUN联合ORS模型的评价效果优于单指标模型。见图2。

表2 相关指标与AP病情程度及转归的关系
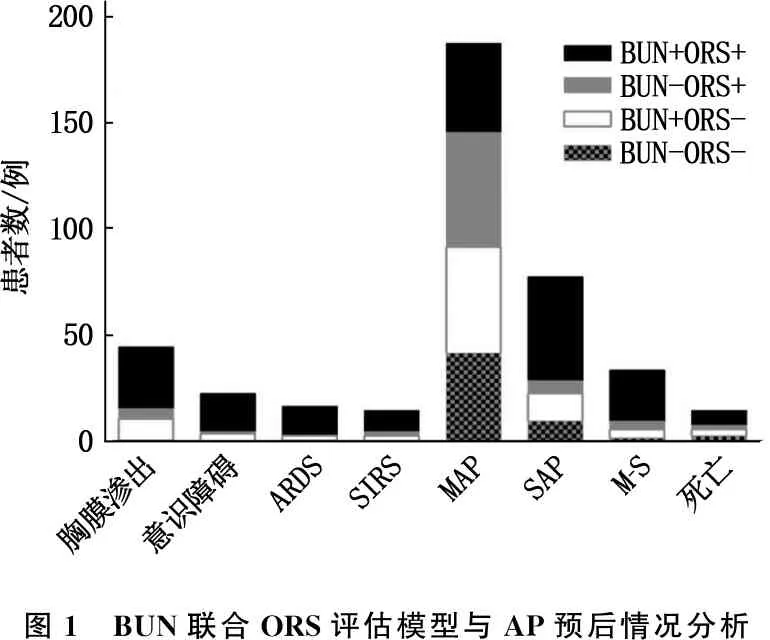
图1 BUN联合ORS评估模型与AP预后情况分析

图2 BUN、ORS及相关指标预测AP预后风险的效果
3 讨 论
AP属消化道危重症疾病,病情发展迅速,短期内可由MAP进展为SAP, 患者常因全身“细胞因子风暴”和多器官功能衰竭导致死亡[6-7]。研究[8]认为, 48 h内完成对患者诊断和病情评估,并及时控制原发症状,预防并发症发生,给予生命支持,可有效减缓AP的进展,降低SAP的病死率。AP的治疗常以非手术方案为主,包括禁食、胃肠减压、抑制胰酶及胰腺外分泌、预防感染、解痉止痛及营养支持等。胆源性胰腺炎、胰腺脓肿及胰腺坏死腹膜炎等可以采取手术治疗[2, 9]。
胰腺炎救治的重点是早期诊断和评估,目前临床上评估AP的标准有Ranson评分、APACHE Ⅱ评分、MODS评分、BISAP评分、Balthazar CT评分等。Ranson评分是重症胰腺炎早期较为完整的评分标准,其缺点为不能动态地观察患者病情变化并评估严重程度,且评分不包含患者既往健康情况对比。APACHE Ⅱ评分可评估疾病全身性影响的严重程度,其不受时间限制,可以在患者在院期间多次实施。根据中华医学会制定的AP评价标准[10-13], 全身评分采用APACHE Ⅱ,8分或以上; 局部症状评分采用Balthazar CT影像学分级, Ⅱ级或以上; MODS和BISAP评分可用于评价SAP全身性进展。此外,临床上最常用的AP实验室诊断指标是AMS, 其优势为早期敏感性较高,但精确度一般,部分患者可出现AMS正常。AMS变化的幅度与AP病情程度无显著相关性。研究[14-15]显示, BUN、CRP、D-D、Fib、FBG和血钙等指标可用于AP的病情分析及预后评估。
AP的发生、发展过程中伴随着SIRI的发生。AP产生的炎症反应和胰酶破坏在起初仅局限于胰腺周围器官和腹腔脏器,随着AP的发展,特异性炎症反应由局部随着腹腔向全身扩散,形成“炎症风暴”,最终引发呼吸、循环、体温等改变[16]。肾脏对于SIRS相关的呼吸障碍引起的酸中毒、循环障碍引起的器官灌注下降非常敏感。机体酸中毒改变导致肾小球滤过功能受损,引起肾功能衰竭。早期的全身免疫反应产生的炎症介质对毛细血管产生收缩作用,引起肾脏灌注不足,导致肾前性肾功能衰竭。在肾功能不全失代偿时, BUN将升高。临床上将BUN作为肾功能损伤的早期指标,能快速反映SIRS的发生、发展情况[12-13, 17]。本研究中, BUN在SAP、M-S、死亡、发生并发症的患者中均显著升高,证实BUN对于早期评估AP的进展及预后有一定的价值。
研究[18-19]认为,脂肪组织具有活跃的内分泌功能,不仅能分泌脂联素、瘦素、抵抗素等调节代谢的因子,还能分泌白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、Wnt1通路蛋白-1(WISP-1)等参与炎症反应调控。研究[20-21]认为,除脂肪细胞外,脂肪组织中还充斥着巨噬细胞、内皮细胞和成纤维细胞。巨噬细胞除了具有分泌炎症因子的功能外,还能藉由肥胖导致M2型巨噬细胞向M1型巨噬细胞转换,从而增强脂肪组织的促炎症作用。在AP患者中,作者认为肥胖引发的全身性慢性免疫状态可能为SIRS的发生提供基础。BMI、TG、FBG和HbA1c可反映肥胖的程度。本研究设计了ORS肥胖评估模型,结果提示, BUN升高和ORS同时存在时,提示AP患者的并发症发生率、重症比率及死亡风险显著增高。
综上所述,在BUN联合ORS评估模型分析中, BUN+ORS+对AP的并发症增多、病情进展及转归不良均具有显著的预测意义,且在MAP患者中并无显著差异。

