前列腺大细胞神经内分泌癌个案报告
章 顺,王 成 ,钱苏波,丁 煜,王 晨,段黄琪,夏维敏,沈海波
1.上海交通大学医学院新华临床医学院,上海200092;2.上海交通大学医学院附属新华医院泌尿外科,上海200092
前列腺大细胞神经内分泌癌(large cell neuroendocrine carcinoma,LCNEC)十分罕见,只有少数案例报道。大部分前列腺LCNEC 发生于长期的雄激素剥夺治疗(androgen deprivation therapy,ADT)之后,极少部分始发即为前列腺LCNEC。我们报道最近诊断的1 例前列腺LCNEC 患者,并结合文献报道的前列腺LCNEC 案例,对其特征、诊断、治疗、未来展望等进行讨论。
1 临床资料
67 岁男性因“进行性排尿困难伴排便困难7 月余”于2018 年8 月至上海交通大学医学院附属新华医院泌尿外科门诊就诊。血清总前列腺特异性抗原(total prostate specific antigen,tPSA) 为24.50 ng/mL。MRI 提示“前列腺癌,膀胱底壁受侵”。穿刺病理提示“前列腺癌,Gleason 评分9 分(5+4)”。全身骨显像未提示骨转移。患者既往有高血压、糖尿病病史5 年余。TNM 分期:cT4N0M0。根据2019 年欧洲泌尿外科协会(European Association of Urology,EAU)指南,考虑诊断为高危局部晚期前列腺癌。MDT 讨论后遂于2018 年8—10 月行新辅助治疗:内分泌治疗[最大限度去势治疗(戈舍瑞林+比卡鲁胺) ]联合多西他赛化疗(75 mg/m2,3 周方案)。治疗后复查血清tPSA 降至0.05 ng/mL,排尿排便困难症状明显缓解。2018 年11 月19 日行耻骨后前列腺癌根治术。术后病理(图1)提示“前列腺腺癌(Gleason 分级5+4),pT4N0M0,膀胱颈活检提示癌细胞浸润,故术后给予局部放射治疗(35 次)+继续维持最大限度去势治疗(戈舍瑞林+比卡鲁胺)。
2019 年5 月26 日患者因气促于呼吸内科就诊,收入RICU 治疗,行胸部CT 增强发现“纵隔、肺门多发淋巴结肿大,心包积液、胸腔积液”(图2A、B),给予吸氧、抗感染(抗生素+强的松龙)、双侧胸腔引流。2019 年6月4 日 PET/CT(图3)提示“双侧膈脚后、腹膜后、肠系膜、纵隔、两侧锁骨区多发淋巴结转移,多发骨转移”。MDT 讨论后行颈淋巴结穿刺活检,提示“左颈淋巴结穿刺见差分化癌浸润”,免疫组化AE1/AE3(+),CD56(-),CgA(散在+),Syn(+),TTF1(-),结合病史可符合前列腺癌转移,诊断为前列腺大细胞神经内分泌癌(图4)。对之前前列腺癌根治术标本补充神经内分泌免疫组化染色(图5),提示:CD56(+),CgA(+),NSE(-),Syn(散在+),结合细胞形态,提示为始发即为前列腺LCNEC。2019 年6 月起给予阿比特龙治疗,治疗1周后患者开始减少吸氧频率,治疗2 周后复查胸部超声提示双侧胸腔未见明显积液,拔除双侧胸腔引流管。阿比特龙治疗6 周后tPSA 上升至26.2 ng/mL,患者吸氧频率增加,结合基因检测结果提示AR 扩增,遂给予更换成多西他赛60 mg/m2联合顺铂60 mg/m2化疗,3 周一疗程,共6 个周期。复查骨三相扫描提示“考虑肿瘤全身多发性骨转移”(2019 年11 月,图6)。复查胸部CT 显示纵隔、肺门淋巴结明显缩小,心包积液、胸腔积液较前有明显吸收(2019 年11 月,图2C、D)。本例患者随访至2020 年5 月, 仍然存活,ECOG 为0 分(已经存活21 个月)。
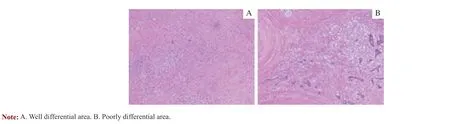
图1 患者前列腺癌根治术后病理(H-E 染色,×100)Fig 1 Pathology after radical resection of prostate cancer (H-E staining, ×100)

图2 患者胸部CT 结果Fig 2 Chest CT of the patient

图4 患者淋巴结穿刺结果(×100)Fig 4 Lymph node puncture of the patient (×100)

图5 患者前列腺癌根治术标本补充免疫组化 Fig 5 Supplemental immunohistochemistry of radical prostatectomy specimen

图6 患者2019 年11 月4 日复查骨三相Fig 6 Three-phase bone scan of the patient (November 4th, 2019)
2 讨论
2.1 前列腺LCNEC 的病因及发病可能机制
正常前列腺导管和腺泡的上皮包括:腔内分泌细胞、基底细胞、神经内分泌细胞(neuroendocrine cell,NE 细胞)。最近的研究显示这3 种细胞共同来源于内胚层多能干细胞,APrikian[1]等发现有些NE 细胞共表达PSA,提示了这3 种细胞的共同来源。NE 细胞具有内分泌和神经的双重特征,广泛分布于正常前列腺腺泡与腺管中。NE细胞的胞质内含有致密核心颗粒,储存肽类激素和前激素,包括CgA、NSE、生长抑素、HCG、促甲状腺激素、甲状旁腺激素相关蛋白、GRP、降钙素基因家族等,这些颗粒可被免疫组化染色识别。NE 细胞释放这些颗粒,通过内分泌、旁分泌、自分泌和神经内分泌的方式调控前列腺生长、分化和分泌[2]。这些正常NE 细胞Ki67(-),AR(-),是完全分化的有丝分裂期后细胞。
神经内分泌分化(neuroendocrine differentiation,NED)是前列腺癌的特征之一,在10%~100%的前列腺癌组织中通过免疫组化染色可以找到恶性的NE 细胞,其内在机制尚不明确。免疫组化研究发现内分泌治疗与前列腺癌神经内分泌分化有关。这些新产生的NE 细胞由非NE 细胞转分化而来。在ADT 的选择压力下,非NE 细胞的克隆进展受到影响,从而发生转分化,形成Bcl-2 阴性的、AR 表达减少的NE 细胞[3]。这与正常前列腺中NE 细胞为终末分化,不能进一步分裂一致。大部分前列腺神经内分泌癌混有腺癌,有些细胞介于“过渡期”,共同表达神经内分泌细胞的marker 和PSA 也证实了这一点[4]。在LNCap 细胞系实验中发现,IL-6 可通过多种通路诱导转分化[5]。最近的研究表明N-Myc 过表达及zeste 同源蛋白2 (EZH2)介导的转录重编程抑制雄激素受体,驱动前列腺癌NED,其中PI3K-AKT-mTOR 通路激活是NED 必需的[6]。RaPa 等[7-8]认为前列腺癌神经内分泌分化是随着雄激素剥夺而变化的一个动态的过程,在这个过程中许多细胞因子、生长因子参与了神经内分泌表型的获得。神经发育转录因子hASH-1(ASCL-1)是调控神经发育、促进中枢和外周神经系统祖细胞形成的关键调控因子,对前列腺中正常NE 细胞的产生是必需的。在LCNEC 中,hASH-1高表达,对于雄激素剥夺时恶性NE 细胞产生也是必需的。这些新形成的恶性NE 细胞具有高Ki67 表达,其分泌的CgA、GRP、5-HT 等可增加肿瘤的侵犯和转移能力[7-8]。 而始发即为前列腺LCNEC 的病因不明,NE 细胞可能为正常前列腺NE 细胞直接恶性转化而成。
2.2 前列腺LCNEC 的特点
神经内分泌细胞>50%并具有NEC 的特定结构才能诊断为前列腺神经内分泌癌[9]。前列腺神经内分泌癌是很少见的,根据2016 世界卫生组织(World Health Organization,WHO)分类,可分为普通型前列腺癌伴神经内分泌分化、腺癌伴潘氏细胞样神经内分泌分化、类癌、小细胞神经内分泌癌、大细胞神经内分泌癌[10]。其中,前列腺大细胞神经内分泌癌更是十分罕见,国外的案例Tu[11]和Evans[4]等已经做过很好的总结,此处另增加遗漏的以及国内的报道,总结如表1 ~4。5 种前列腺神经内分泌癌各有不同特点[12](表5)。
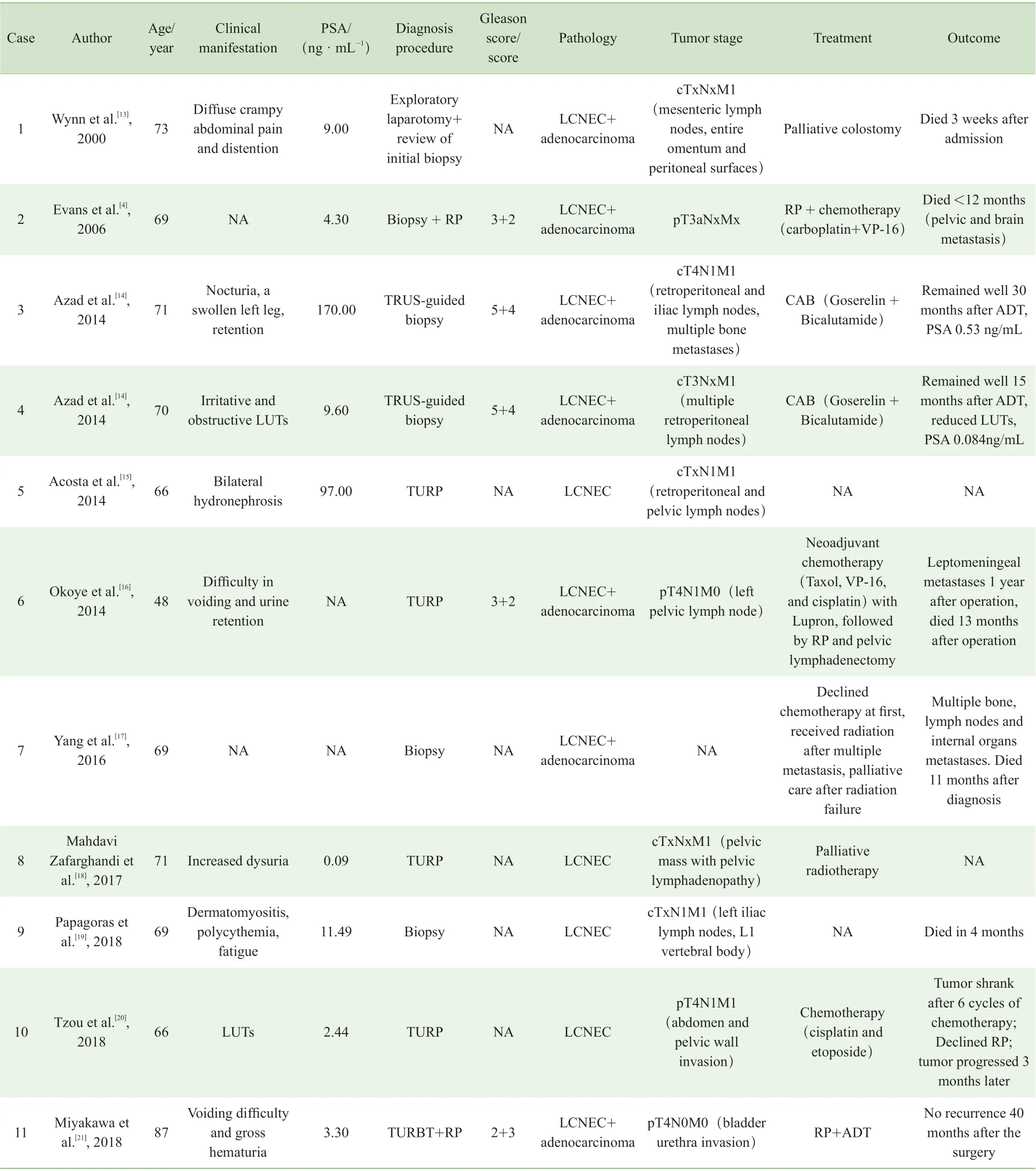
表1 始发即为前列腺LCNEC 患者案例总结Tab 1 Summary of de novo LCNEC of the prostate cases
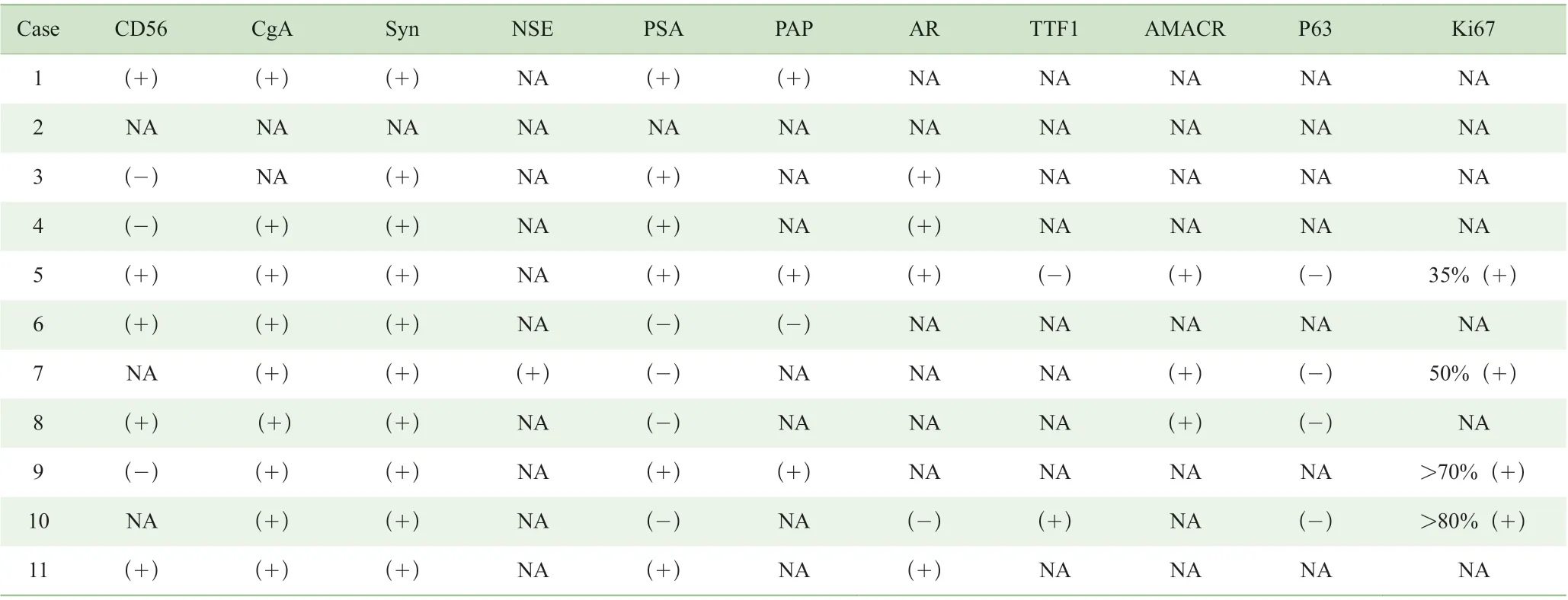
表2 始发即为前列腺LCNEC 患者免疫组化Tab 2 Immunohistochemistry staining of de novo prostate LCNEC cases
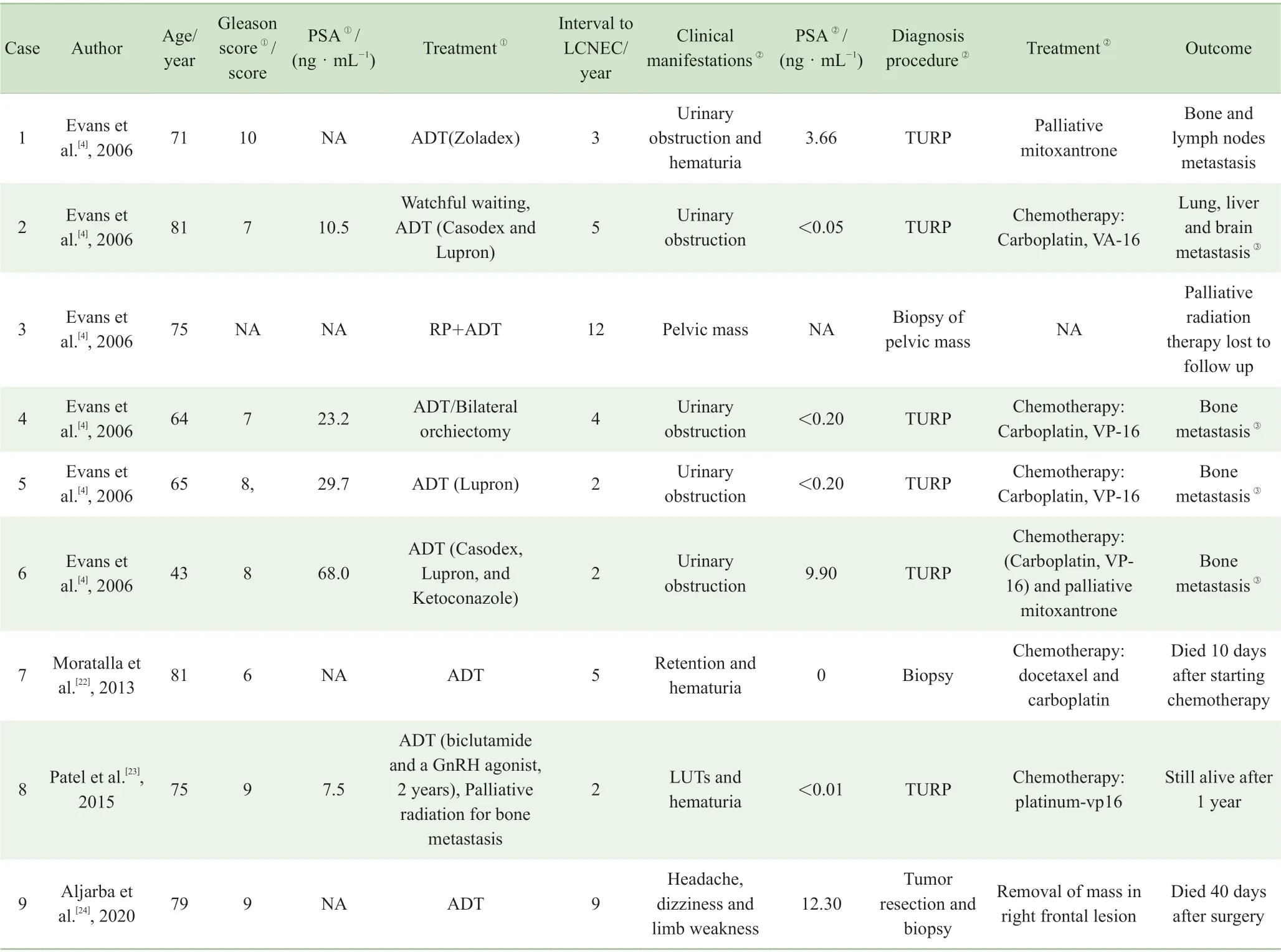
表3 ADT 后前列腺LCNEC 患者案例总结Tab 3 Summary of prostate LCNEC after ADT cases

表4 ADT 后前列腺LCNEC 患者免疫组化Tab 4 Immunohistochemistry staining of prostate LCNEC after ADT cases

表5 前列腺神经内分泌癌比较 Tab 5 Comparison of prostate neuroendocrine carcinoma
前列腺LCNEC 细胞显示出独特的镜下特点:①大细胞特征:肿瘤细胞大(>3 个淋巴细胞大小),胞质丰富,呈嗜酸性,巢状/片状排列。②神经内分泌特征:多形型核,核仁明显,salt and pepper 状染色质。③高级别特征:有丝分裂多(>10/10 HPFs),凋亡小体多,肿瘤坏死常见。免疫组化染色显示大部分病例嗜铬粒蛋白A(CgA)、突触素(Syn)、CD56 阳性,混有腺癌者PSA、PAP 可为部分阳性。本例患者免疫组化提示CgA,Syn 阳性。前列腺LCNEC 临床表现无特异性,可为夜尿增多、尿潴留、排尿困难、肉眼血尿等,部分可合并副肿瘤综合征:如皮肌炎、红细胞增多、库欣综合征等。
2.3 前列腺LCNEC 的诊断
由于PSA 可能不高,无特异性临床表现,患者通常是为解决尿路梗阻症状行TURP 或穿刺时偶然诊断,多数诊断时已为晚期。肿瘤进展快,易转移,常见的转移部位有骨、盆腔内脏器等,还会转移至一些不寻常的地方,如大网膜、软脑膜、声带、腋窝、肾上腺周围软组织等。本例患者出现纵隔等不常见的前列腺癌转移部位转移。
在做出原发前列腺LCNEC 诊断之前,应鉴别是否为其他部位转移性LCNEC,或是其他部位LCNEC 直接侵犯前列腺,如膀胱LCNEC 侵犯前列腺等,还需与弥漫性大B细胞淋巴瘤等鉴别。值得注意的是TTF-1 并不能有效鉴别是否为肺来源LCNEC,需结合病史、影像学、形态学、免疫组化等以区分。本例患者TTF-1 为阴性。
2.4 前列腺LCNEC 的治疗
原发前列腺LCNEC 罕见,在治疗上尚无统一的规范。由于诊断时多已为晚期,参考肺神经内分泌癌治疗方法,主要采用以铂类为基础的全身化疗,有一定疗效但总体效果不佳。从文献回顾来看,由于NE 细胞不表达AR受体,所以单纯性前列腺LCNEC 对内分泌治疗无效,原发为腺癌经过ADT 后转变为LCNEC 患者已成为去势抵抗性前列腺癌,对常规内分泌治疗效果不佳,但始发即为LCNEC 且混有腺癌患者对内分泌治疗可能有效。文献回顾中有3 例始发即为LCNEC 且混有腺癌患者在ADT 后效果好,存活分别超过40 月、30 月、15 月。本例患者随访至2020 年5 月,仍然存活,ECOG 0 分(已经存活21个月)。
2.5 前列腺LCNEC 的诊治展望
前列腺LCNEC 恶性程度高,易进展,易转移,一旦发生预后差,故如何早期诊断、诊断后如何有效治疗,以及如何预防其发生是在未来需要研究的方向。
由于大部分NE 产物可被分泌至血液中,所以可以通过免疫方法检测血清中神经内分泌指标来预测前列腺癌NED 的程度,从而早期诊断前列腺神经内分泌癌[2]。血CgA、血NSE、血GRP 在NED 时会升高,且这些指标越高提示着预后越差。但这些指标不具有特异性,需与其他疾病鉴别。
由于前列腺LCNEC 具有神经内分泌癌特征,所以针对神经内分泌靶向的治疗或许能改善患者的生存。生长抑素类似物可通过与表达于分泌细胞、NE 细胞和基底细胞上的生长抑素受体结合,影响NE 对前列腺癌增殖、进展的调控[16]。NE 细胞分泌的GRP、5-HT 等可促进肿瘤的侵犯、转移能力,故GRP 抑制剂、5-HT 拮抗剂可能可以延缓肿瘤进展。mTOR 通路是NED 必需的通路,所以mTOR 抑制剂或许为前列腺LCNEC 潜在的治疗方法[6]。
如前文所述,神经发育转录因子hASH-1(ASCL-1)是调控神经发育、促进中枢和外周神经系统祖细胞形成的关键调控因子。一方面,hASH-1 可引起神经内分泌分化增加,另一方面,hASH-1 对于维持雄激素剥夺时神经内分泌分化是必需的,且hASH-1 会导致肿瘤细胞生存能力、分裂能力增强,故针对hASH-1 的治疗方案可以成为一个新的方向。
Komiya 等[2]发现在ADT 治疗时血清NE 指标升高明显,且雄激素剥夺越快,NE 指标升高越快,而服药的间歇期NE 指标不升高。故在对PCa 患者进行ADT 治疗前,需通过血清指标、免疫组化评估患者的NED 情况,尤其是那些病理提示高级别,却伴有低PSA 的患者。若提示强NED,则需更温和的ADT;如间歇ADT 或单药ADT,不要快速最大限度去势,以预防腺癌向LCNEC 转变。
综上所述,前列腺LCNEC 为罕见类型的前列腺癌,恶性程度极高,易早期转移,预后极差。出现PSA 低,疾病进展较快以及非常规部位的转移时需要考虑该病的可能,诊断依赖于形态学及免疫组化染色。含铂类药物化疗是前列腺LCNEC 的主要治疗方式。
参·考·文·献
[1] Aprikian AG, Cordon-Cardo C, Fair WR, et al. Characterization of neuroendocrine differentiation in human benign prostate and prostatic adenocarcinoma[J]. Cancer, 1993, 71(12): 3952-3965.
[2] Komiya A, Suzuki H, Imamoto T, et al. Neuroendocrine differentiation in the progression of prostate cancer[J]. Int J Urol, 2009, 16(1): 37-44.
[3] Santoni M, Aurilio G, Maccioni A, et al. Key players of neuroendocrine differentiation in prostate cancer[J]. Ann Transl Med, 2019, 7(S3): S112.
[4] Evans AJ, Humphrey PA, Belani J, et al. Large cell neuroendocrine carcinoma of prostate: a clinicopathologic summary of 7 cases of a rare manifestation of advanced prostate cancer[J]. Am J Surg Pathol, 2006, 30(6): 684-693.
[5] Lee GT, Kwon SJ, Lee JH, et al. Macrophages induce neuroendocrine differentiation of prostate cancer cells via BMP6-IL6 Loop[J]. Prostate, 2011, 71(14): 1525-1537.
[6] Gupta K, Gupta S. Neuroendocrine differentiation in prostate cancer: key epigenetic players[J]. Transl Cancer Res, 2017, 6(Suppl 1): S104-S108.
[7] Rapa I, Ceppi P, Bollito E, et al. Human ASH1expression in prostate cancer with neuroendocrine differentiation[J]. Mod Pathol, 2008, 21(6): 700-707.
[8] Rapa I, Volante M, Migliore C, et al. Human ASH-1 promotes neuroendocrine differentiation in androgen deprivation conditions and interferes with androgen responsiveness in prostate cancer cells[J]. Prostate, 2013, 73(11): 1241- 1249.
[9] 李曾, 廖洪, 毛顿, 等. 原发性前列腺大细胞神经内分泌癌的临床病理特征和诊治分析[J]. 现代泌尿生殖肿瘤杂志, 2018, 10(3): 153-158.
[10] Priemer DS, Montironi R, Wang LS, et al. Neuroendocrine tumors of the prostate: emerging insights from molecular data and updates to the 2016 world health organization classification[J]. Endocr Pathol, 2016, 27(2): 123-135.
[11] Tu X, Chang TC, Nie L, et al. Large cell neuroendocrine carcinoma of the prostate: a systematic review and pooled analysis[J]. Urol Int, 2019, 103(4): 383-390.
[12] Epstein JI, Amin MB, Beltran H, et al. Proposed morphologic classification of prostate cancer with neuroendocrine differentiation[J]. Am J Surg Pathol, 2014, 38(6): 756-767.
[13] Wynn SS, Nagabundi S, Koo J, et al. Recurrent prostate carcinoma presenting as omental large cell carcinoma with neuroendocrine differentiation and resulting in bowel obstruction[J]. Arch Pathol Lab Med, 2000, 124(7): 1074-1076.
[14] Azad AA, Jones EC, Chi KN. Metastatic large-cell neuroendocrine prostate carcinoma: successful treatment with androgen deprivation therapy[J]. Clin Genitourin Cancer, 2014, 12(4): e151-e153.
[15] Acosta-Gonzalez G, Qin J, Wieczorek R, et al. De novo large cell neuroendocrine carcinoma of the prostate, case report and literature review[J]. Am J Clin Exp Urol, 2014, 2(4): 337-342.
[16] Okoye E, Choi EK, Divatia M, et al. De novo large cell neuroendocrine carcinoma of the prostate gland with pelvic lymph node metastasis: a case report with review of literature[J]. Int J Clin Exp Pathol, 2014, 7(12): 9061-9066.
[17] Yang XJ. Large cell neuroendocrine carcinoma[EB/OL]. Michigan: PathologyOutlines.com website, 2016(2019-02-27)[2019-12-07]. http: //www.pathologyoutlines.com/topic/prostatelargecellNEcarc.html.
[18] Mahdavi Zafarghandi R, Kalantari MR, Akhavan Rezayat A, et al. Large cell neuroendocrine carcinoma of prostate: a rare interesting case and literature review[J]. Nephrourol Mon, 2017, 9 (3): e45086. DOI: 10.5812/numonthly.45086.
[19] Papagoras C, Arelaki S, Botis I, et al. Co-occurrence of dermatomyositis and polycythemia unveiling rare de novo neuroendocrine prostate tumor[J]. Front Oncol, 2018, 8: 534. DOI: 10.3389/fonc.2018.00534.
[20] Tzou KY, Cheng WH, Lee WH, et al. Primary large cell neuroendocrine carcinoma of the prostate in a hormone naive patient: a case report from Taiwan[J]. J Cancer Res Ther, 2018, 14(Supplement): S785-S788.
[21] Miyakawa J, Suzuki M, Endo K, et al. A rare case of de novo large cell neuroendocrine carcinoma of the prostate with long-term survival after cystoprostatectomy and androgen deprivation[J]. Urol Case Rep, 2018, 21: 95-97.
[22] Moratalla Charcos LM, Pastor Navarro T, Cortes Vizcaino V, et al. Large-cell neuroendocrine carcinoma of prostate. Case report[J]. Arch Esp Urol. 2013, 66(4): 368-71.
[23] Patel R, Faiena I, Geltzeiler J. Large cell differentiation of metastatic prostate cancer after androgen deprivation therapy[J]. Can J Urol, 2015, 22(2): 7752-7754.
[24] Aljarba SI, Murad M, Bafaquh M, et al. Brain metastasis from large cell neuroendocrine carcinoma of the prostate: a case report and literature review[J]. Int J Surg Case Rep, 2020, 67: 245-249.

