基于SEER 数据库的老年肺癌术后患者预后模型构建与内部验证
何春明,尹 航,唐 健,丁一宗,傅于捷,赵晓菁
上海交通大学医学院附属仁济医院胸外科,上海200127
肺癌是全世界范围最常见的恶性肿瘤之一。2018 年,全球约有210 万肺癌新病例和159 万人因为肺癌死亡。肺癌是男性癌症患者最常见的癌症诊断,也是其死亡的主要原因[1]。肺癌主要组织类型为鳞状细胞癌和腺癌,约占全部原发性肺癌的80%,其他少见类型原发性肺癌以小细胞癌与大细胞癌居多[2]。中国于21 世纪初进入老龄化社会,步入加速老龄化阶段,据预测,在2032 年进入人口负增长时代之时老年人口规模将增至2.68 亿人[3]。肺癌是我国30 年来发生率增长最快的恶性肿瘤[4],而老年肺癌患者术后的管理与治疗给我国公共卫生系统发展带来了巨大的挑战。因此,了解术后老年肺癌患者的预后危险因素与临床特征,对于临床工作具有重要的意义。以往研究对于术后老年肺癌患者的预后因素分析聚焦于患者手术方式、淋巴结清扫数目、术前或术后的放射治疗(放疗) /化学治疗(化疗)以及肿瘤病理类型。但近年来,患者术后的心理状态也引起了人们的关注,其中婚姻状态对患者预后的影响也被越来越多提及。本研究基于美国癌症监测、流行病学和结果(Surveillance,Epidemiology and End Results,SEER)数据库中术后老年肺癌患者的临床信息、病理特征及预后,分析患者的独立风险与保护因素,并建立预后预测模型,旨在对于术后老年肺癌患者精准医疗提供参考和帮助。
1 资料与方法
1.1 资料获取
在获得美国癌症研究所对于SEER 数据库的使用许可后,收集数据库中2010 年1 月—2016 年12 月术后老年肺癌患者的数据并整理,纳入标准为:①患者年龄≥65岁。②患者临床信息完整,可供分析。③患者生存时间与生存状况明确。④患者组织病理诊断为依据国际肿瘤疾病分类第3 版(International Classification of Diseases for Oncology Third Edition,ICD-O-3)分类[5]的肺鳞状细胞癌(8 070/3)、腺癌(8 140/3)、小细胞肺癌(8 041/3)、大细胞肺癌(8 012/3)。⑤患者术中淋巴结清扫信息完整。⑥ 从手术到死亡的时间均大于1 个月(用以排除手术导致的并发症对于患者预后的影响)。⑦纳入患者婚姻状况信息完整。排除标准为:①数据中含量较少(占比小于总体1%)的指标。② 未行肺癌切除术。肿瘤原发位置根据数据库分类原则分为左侧、右侧两个大类与上叶、中叶、下叶、覆盖两叶或以上4 个小类。肿瘤病理根据常见肿瘤类型分为腺癌、鳞癌、大细胞肺癌和小细胞肺癌。肿瘤分期依据2010 年第7 版美国癌症联合委员会(American Joint Committee on Cancer,AJCC)的TNM 分期标准[6]。婚姻状况分为已婚、未婚、离异与丧偶。患者随访起点为肺癌确诊时间,随访终点为出现死亡或到达2016 年底最后一次随访。
1.2 统计学分析
采用SPSS 22.0 统计软件对数据进行处理,使用Kaplan-Meier 法计算总体生存率(overall survival,OS)和肺癌特异性生存率(lung cancer-specific survival,LCSS);采用R 4.0.0 软件对各变量进行单因素与多因素Cox 分析并绘图,根据多因素Cox 分析结果,生成术后老年肺癌患者生存预测列线图,采用R 软件中“Boot”函数[7-8][自助抽样法(Bootstrap) ]对列线图预测性能进行内部验证。列线图的预测效能结果用一致性指数(concordance index,C-index)、接受者操作特征曲线(receiver operating characteristic curve,ROC)和校准图评价,其评价标准为:①当C-index 越接近1 时,表明模型预测生存结果的区分度越高;一般来说,当其大于0.7 则证明模型比较可靠。②ROC 曲线图是反映敏感性和特异性之间关系的曲线,其曲线下方部分的面积被称为曲线下面积(area under curve,AUC),用来预测准确性,AUC 准确值越高,说明模型预测准确率越高。通常情况下当0.5<AUC<1 时提示优于随机猜测,即模型有预测价值。③当校准图的校准曲线与理想曲线(此时模型预测生存结果与实际生存结果完全一致)比较贴合时,证明模型比较可靠[7-8]。P<0.05 为差异有统计学意义。
2 结果
2.1 患者基本资料
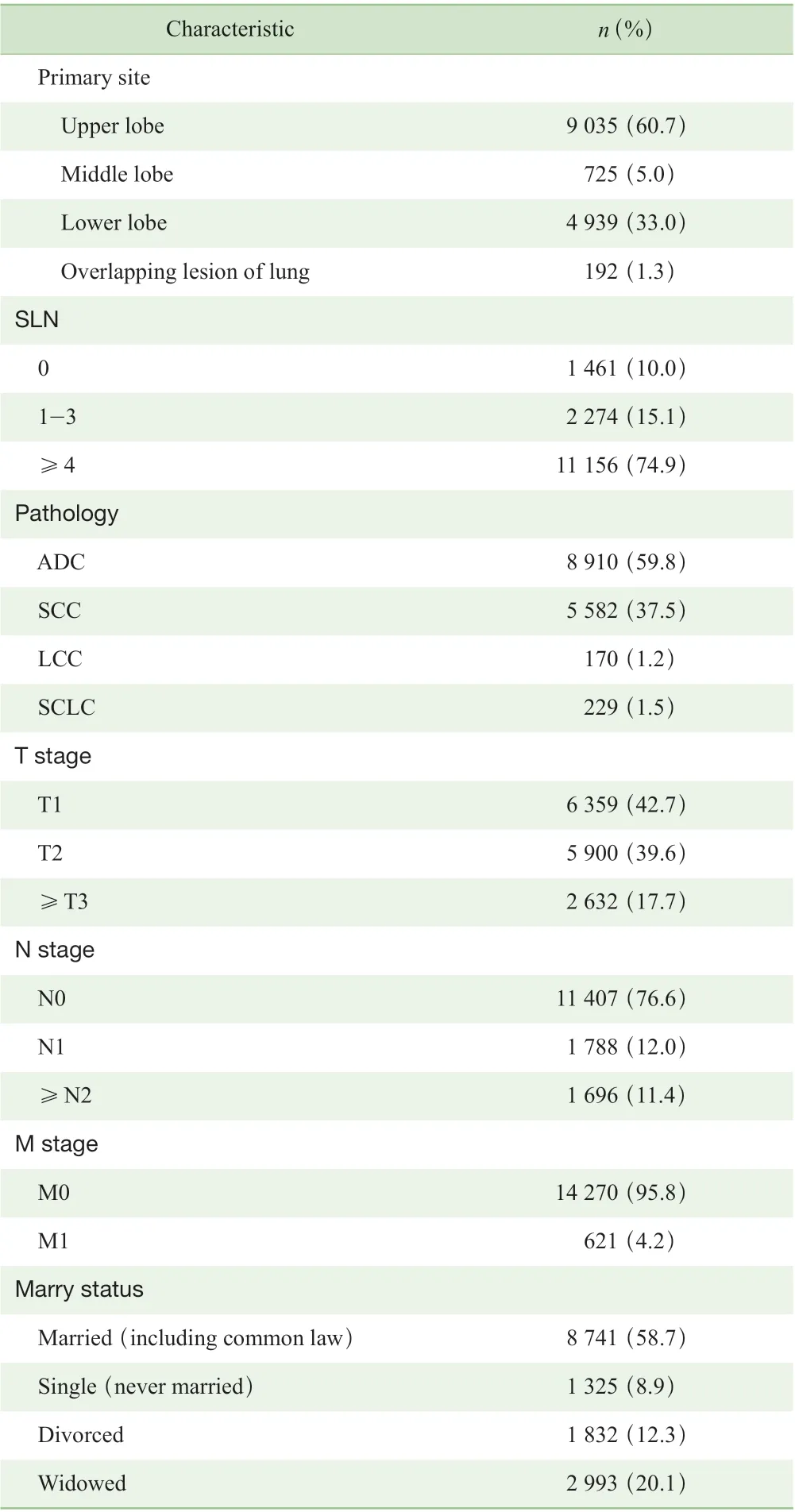
本研究检索SEER 数据库中2010 年1 月—2016 年12月确诊并登记的肺癌患者共360 912 例,最终,本研究纳入14 891 例患者进入后续研究,约占4.13%。其中男性患者7 429 人,女性患者7 462 人,男女比例接近1:1;患者具体基线资料见表1。

表1 14 891 例术后老年肺癌患者的基线资料Tab 1 Baseline data of 14 891 elderly patients after lung cancer surgery
Continued Tab
2.2 OS 与LCSS 独立预后因素
截止到2016 年12 月末,共有5 891 例(39.6%)患者死亡,其中4 125 例(27.7%)死于肺癌,1 766 例(11.9%)死于其他原因。14 891 例患者3 年生存率(3-OS)为65.2%,5 年生存率(5-OS)为51.5%;肺癌特异性3 年生存率(3-LCSS)为71.1%,特异性5 年生存率(5-LCSS)为60.8%。Cox 单因素与多因素回归分析结果表明,患者高龄(≥75 岁)、男性患者、原发肿瘤在下叶或覆盖两叶及以上、肿瘤病理非腺癌、≥T2 期肿瘤、淋巴结有转移(≥N1 期)、出现远处转移(M1)均为老年肺癌术后患者预后不良的独立危险因素;而手术中区域淋巴结清扫的数量是LCSS 的独立保护因素(表2)。
2.3 预后模型列线图的建立与内部验证
将得到的独立预测因素通过R 软件“rms”程序包[9]集合生成具有预测预后意义的列线图,如图1 所示,以列线图的“Total points”为界线,其上为各亚组对与术后老年肺癌患者预后的影响及所占比分,其下为各亚组所得评分之和对应的3 年及5 年LCSS 生存率。在使用列线图时,单个患者的值位于每个变量轴上,由该患者临床和病理相关信息估计对应亚组位置,对应“point”上位置以估算大体分值,将各亚组所得评分相加,得分总和的值对应“Total points”上数值的位置,由此,我们可以得知患者3、5 年LCSS 生存率情况。列线图中各变量的长度反映它们对于患者生存结局影响所占的比重,患者年龄、病理、TNM 分期以及术中区域淋巴结清扫的数目对于患者预后具有较大的影响。
运用R 语言的“Boot”函数采用Bootstrap 方法进行内部验证,设定通过在模型开发队列中进行1 000 次有放回抽样,构造一个相同样本量大小的Bootstrap 重抽样样本,并将此样本作为训练集[8],验证结果表明模型具有较好的区分度(C-index=0.720,95%CI 0.712 ~0.728),且其区分度较TNM 分期系统(C-index=0.686,95%CI 0.678 ~0.693)相比具有优势。ROC 曲线结果(图2A)显示,3、5 年LCSS 曲线下面积AUC 分别为0.745 和0.721,提示列线图模型在预测3、5 年LCSS 时模型较稳定,模型效能较好。另外,如图2B 显示,3、5 年LCSS校准曲线较理想较为贴合,提示列线图模型具有较好的预测能力。
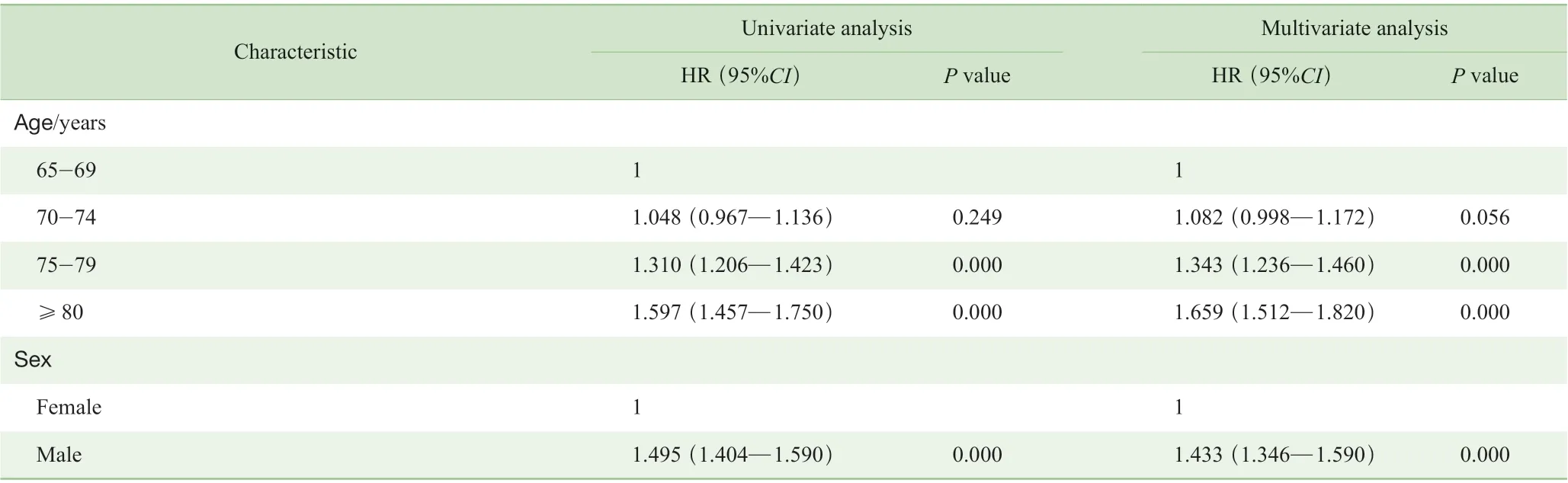
表2 术后老年肺癌患者预后的Cox 单因素及多因素分析Tab 2 Cox univariate and multivariate analysis of postoperative prognosis of elderly patients with lung cancer
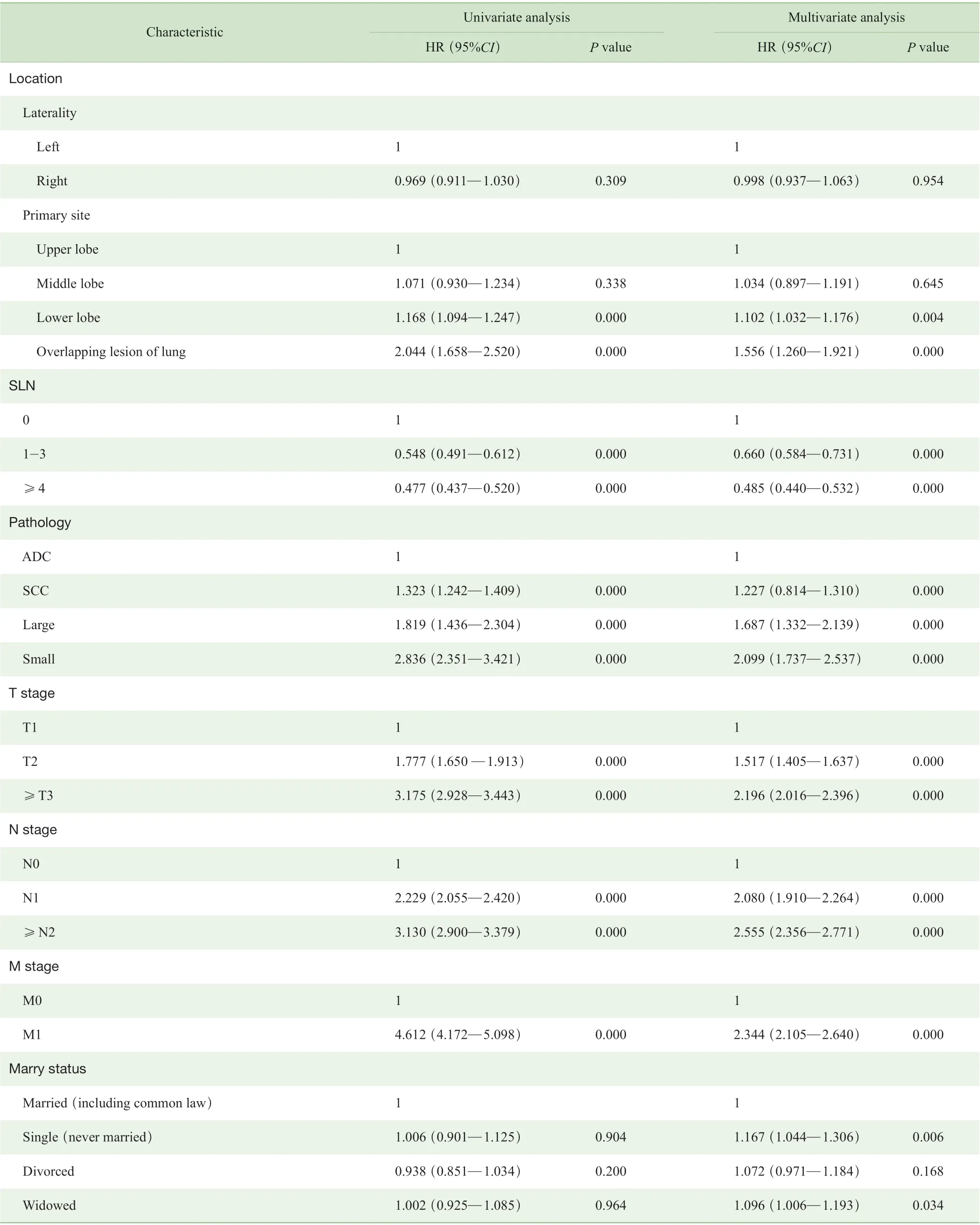
Continued Tab
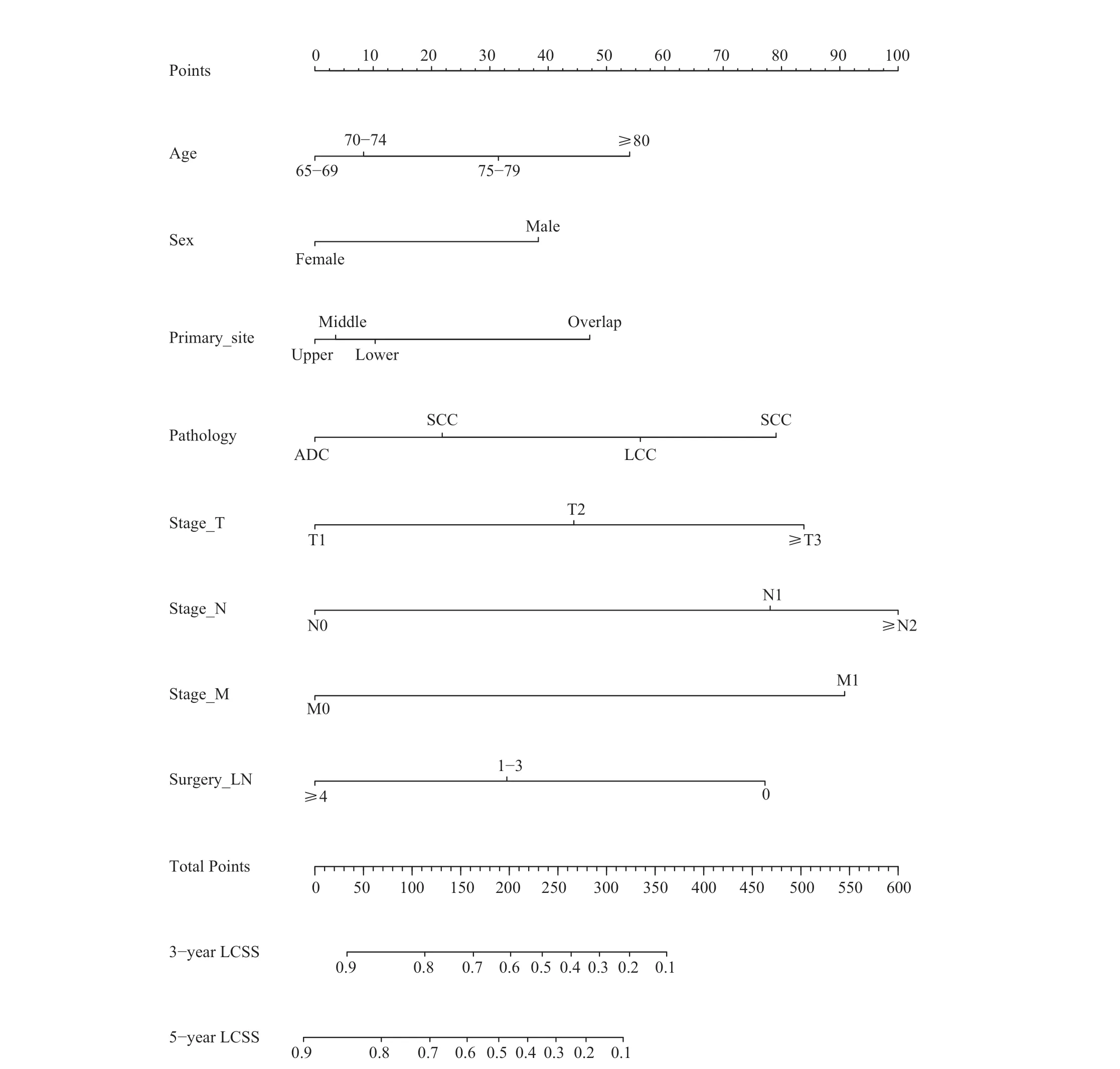
图1 老年肺癌术后患者3、5 年LCSS 的列线图模型Fig 1 Nomogram model of 3 - and 5-year LCSS
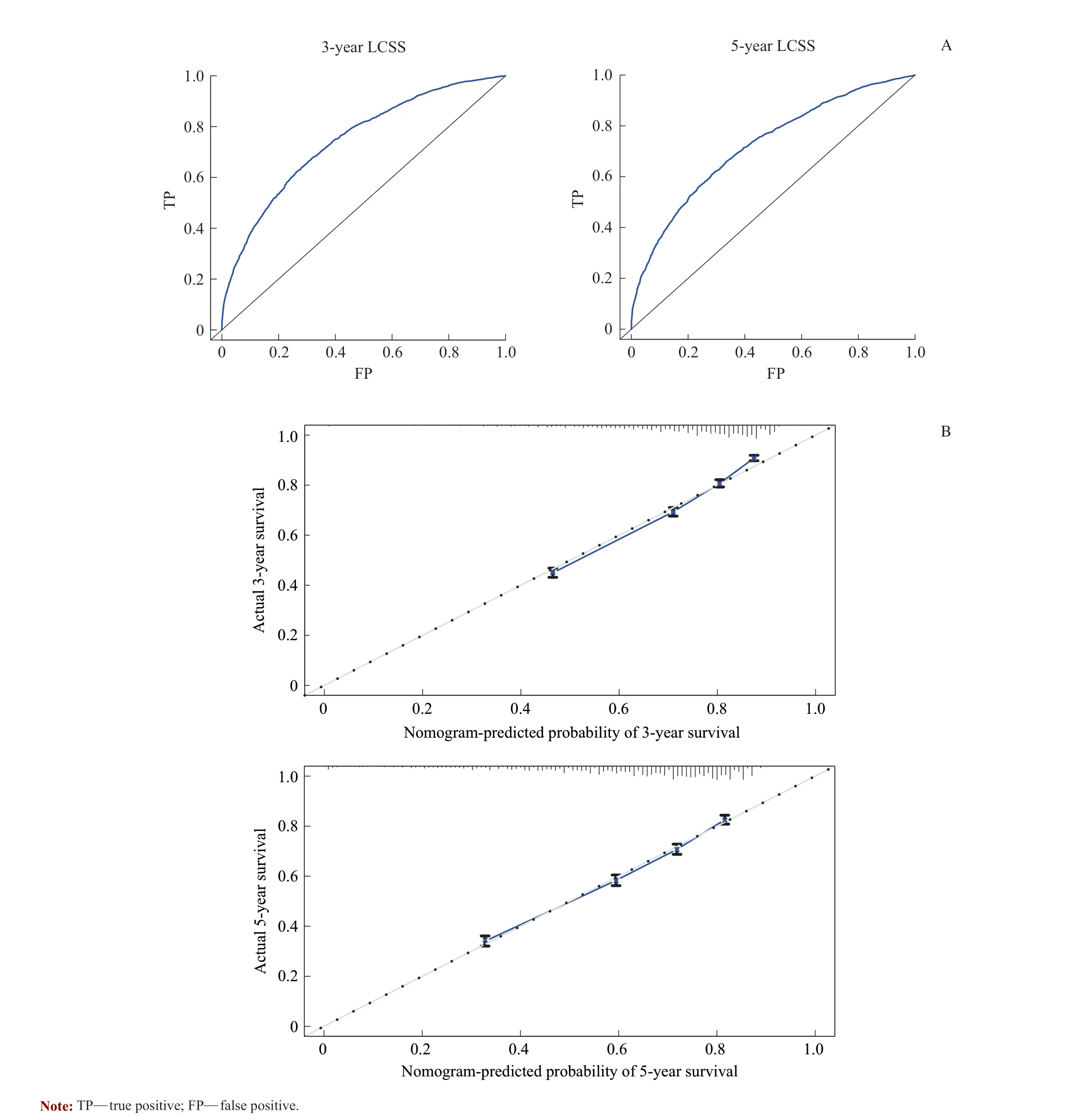
图2 预测术后老年肺癌患者3、5 年LCSS 列线图模型的ROC 曲线(A)和校准曲线(B)Fig 2 ROC curve (A) and Calibration curve (B) for nomogram model of 3 - and 5-year LCSS
3 讨论
近年来对于肺癌的诊断技术与治疗手段在不断进步,包括低剂量计算机断层扫描(low-dose CT)[10]和微创手术方法的普及、特异性血液肿瘤标志物如循环肿瘤DNA(circulating tumor DNA,ctDNA)概念的加入、化疗和靶向治疗的进步以及免疫治疗的初步应用等,但这些进步对于早期可切除的肺癌患者的生存获益并不明显[11-12]。 另外,在可切除肺癌的患者中,有约30%的高危人群存在复发可能,而对于如何鉴定高危人群,并没有切实可行的标准[11]。肺癌分为非小细胞肺癌与小细胞肺癌,非小细胞肺癌主要包括腺癌、鳞状细胞癌和大细胞癌,主要占新发肺癌患者总数的85%,剩下的15%主要为小细胞肺癌[2]。由于小细胞肺癌具有早期播散的倾向,预后较差,所以大部分小细胞肺癌不适合手术治疗,在肺癌术后患者中所占比重较少[13]。在一项随访期间肿瘤体积倍增时间的研究[14]中发现,鳞状细胞癌的体积倍增时间明显短于腺癌,表明早期SCC 病变生长较快,术后复发可能性更高。这可能是鳞癌危险程度大于腺癌的原因之一。
本研究结果显示,高龄、男性为术后老年肺癌患者的独立危险因素,与以往研究[4]一致,主要与男性不良嗜好如吸烟等相关。另外,本研究证实了肿瘤不同原发部位影响术后老年肺癌患者预后,其危险程度排序为:覆盖两叶或以上>下叶>中叶>上叶。这一结果与Li 等[15]的研究基本一致,这可能与解剖部位的不同、手术部位的难度、淋巴结清扫程度以及周围组织毗邻相关,如Nakanishi 等[16]和Lee 等[17]分别研究认为手术部位发生在上叶的肿瘤预后相对较好。有趣的是,虽然左右两侧肺脏解剖构造不同,肺癌原发于左侧或右侧对于预后并没有影响,这一结果也与Puri 等[18]的研究相同。此外,TNM 分期提示≥T2、≥N1 和M1 为患者预后不良的独立危险因素,说明了早期诊断和治疗对于患者的预后意义。
目前肺癌的标准术式为肺癌的完全切除术,其标准包括病灶在内的肺叶切除或解剖性的肺叶切除和6 组及以上的淋巴结清扫(包括3 组肺内和肺门淋巴结及3 组纵隔内淋巴结)[4]。通过我们的研究可知,区域淋巴结清扫的数量与患者生存预后直接相关,提示外科医师对于肺癌手术时应注意淋巴结的清扫程度。此外,患者的婚姻状况同样引起了我们的注意。虽然单因素分析提示婚姻状态与患者预后无关,但多因素分析结果却提示我们老年肺癌术后患者中未婚或丧偶是患者预后的危险因素。这一争议的结果也出现在以往的研究中。张倩等[19]报道的婚姻状况异常与肺癌患者较差的预后独立相关,这可能是由于婚姻状况异常的患者相对缺少配偶对其心理上的安慰和对其治疗的支持,老年患者的生活起居可能更需要伴侣的支持。然而,Siddiqui 等[20]的研究认为,尽管婚姻状态中,婚姻较满意的肺癌患者似乎具有较好的预后,但婚姻状态与患者的整体生存并不独立相关。这一研究结果与我们大致相仿,可能需要更进一步的亚组分析得出更准确的结论。
对于肺癌术后患者并没有关于后续方案的一致意见,目前的建议没有根据组织学检查结果进行调整。欧洲肿瘤医学协会(European Society for Medical Oncology,ESMO)的指南[21]建议每6 个月监测1 次、持续2 年,包括在12 个月和24 个月进行1 次胸部CT 检查,之后每年进行1 次复查,包括病史、体格检查和胸部CT 扫描。根据美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)的指导方针[22],完成明确治疗后的监测被调整到3 个阶段:第1 阶段和第2 阶段的后续工作类似于ESMO 指南;第3 阶段,建议更频繁地监测,但没有提到严格的随访时间表。根据目前的情况和我们的研究结果,毫无疑问,应该定期进行病史和体格检查,以帮助评估患者的病情和肿瘤状态。
本研究有一些局限性值得注意。首先,这是一项来自SEER 数据库的回顾性研究,它可能导致我们的结果质量较低。其次,一些关于手术和放化疗的信息,如不同手术术式(肺的叶切、段切或楔切,开放式手术或胸腔镜手术等),放化疗的时机与剂量(新辅助放化疗还是术后放化疗,放化疗同步治疗、序贯疗法还是单纯放疗或化疗等)可能对非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的预后有一定的影响。但由于SEER 数据库的限制,我们无法获得具体的信息。再次,由于缺乏我国的术后老年肺癌患者的临床信息,该研究无法从外部验证模型的风险性。这些问题启发我们应当构建符合中国实际情况的肺癌患者数据库,以获得更加详实的老年肺癌术后患者的生存信息。
总的来说,本研究结合我国国情,运用大型数据库信息构建的预后模型具有实用性。结果可能有助于临床医师选择最合适的治疗策略和预后评估。这一领域还需要进一步的大规模前瞻性临床研究,以确定是否存在其他潜在影响NSCLC 预后的因素,如吸烟史、基因表达等。
参·考·文·献
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424.
[2] Gridelli C, Rossi A, Carbone DP, et al. Non-small-cell lung cancer[J]. Nat Rev Dis Primers, 2015, 1: 15009.
[3] Department of Economic and Social Affairs, Population Division, United Nations. World population prospects 2019, online edition[EB/OL]. (2019)[2020-02-20]. https: //population.un.org /wpp/Download/Standard/Population/.
[4] 原发性肺癌诊疗规范(2018 年版)[J]. 肿瘤综合治疗电子杂志, 2019, 5(3): 100-120.
[5] Percy CL, Fritz AG, Jack A, et al. International classification of diseases for oncology (ICD-O)[M]. 3rd ed. Geneva: World Health Organization, 2013.
[6] Goldstraw P, Crowley J, Chansky K, et al. The IASLC lung cancer staging project: proposals for the revision of the TNM stage groupings in the forthcoming (seventh) edition of the TNM classification of malignant tumours[J]. J Thorac Oncol, 2007, 2(8): 706-714.
[7] Wang SD, Yang L, Ci B, et al. Development and validation of a nomogram prognostic model for SCLC patients[J]. J Thorac Oncol, 2018, 13(9): 1338-1348.
[8] 王俊峰, 章仲恒, 周支瑞, 等. 临床预测模型: 模型的验证[J]. 中国循证心血管医学杂志, 2019, 11(2): 141-144.
[9] Frank H. Rms: Regression modeling strategies. R package version 5.1.3[EB/OL]. (2019-01-27) [2020-02-20]. https: //cran.r-project.org/web/packages/rms/.
[10] Team The National Lung Screening Trial Research. Reduced lung-cancer mortality with low-dose computed tomographic screening[J]. N Engl J Med, 2011, 365(5): 395-409.
[11] Pinsky PF, Church TR, Izmirlian G, et al. The National Lung Screening Trial: results stratified by demographics, smoking history, and lung cancer histology[J]. Cancer, 2013, 119(22): 3976-3983.
[12] Pignon JP, Tribodet H, Scagliotti GV, et al. Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE collaborative group[J]. J Clin Oncol, 2008, 26(21): 3552-3559.
[13] Gazdar AF, Bunn PA, Minna JD. Small-cell lung cancer: what we know, what we need to know and the path forward[J]. Nat Rev Cancer, 2017, 17(12): 725-737.
[14] Wilson DO, Ryan A, Fuhrman C, et al. Doubling times and CT screen-detected lung cancers in the Pittsburgh lung screening study[J]. Am J Respir Crit Care Med, 2012, 185(1): 85-89.
[15] Li C, Liu J, Lin JM, et al. Poor survival of non-small-cell lung cancer patients with main bronchus tumor: a large population-based study[J]. Futur Oncol, 2019, 15(24): 2819-2827.
[16] Nakanishi R, Osaki T, Nakanishi K, et al. Treatment strategy for patients with surgically discovered N2stage Ⅲ A non-small cell lung cancer[J]. Ann Thorac Surg, 1997, 64(2): 342-348.
[17] Lee HW, Lee CH, Park YS. Location of stage Ⅰ - Ⅲ non-small cell lung cancer and survival rate: systematic review and meta-analysis[J]. Thorac Cancer, 2018, 9(12): 1614-1622.
[18] Puri V, Garg N, Engelhardt EE, et al. Tumor location is not an independent prognostic factor in early stage non-small cell lung cancer[J]. Ann Thorac Surg, 2010, 89(4): 1053-1059.
[19] 张倩, 曹乾. 婚姻状态对肺癌患者生存预后的影响: 基于SEER 数据库的研究[J]. 肿瘤防治研究, 2019, 46(7): 617-621.
[20] Siddiqui F, Bae K, Langer CJ, et al. The influence of gender, race, and marital status on survival in lung cancer patients: analysis of radiation therapy oncology group trials[J]. J Thorac Oncol, 2010, 5(5): 631-639.
[21] Postmus PE, Kerr KM, Oudkerk M, et al. Early and locally advanced nonsmall-cell lung cancer (NSCLC): esmo clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2017, 28: iv1-iv21.
[22] Ettinger DS, Wood DE, Aisner DL, et al. Non-small cell lung cancer, version 5.2017, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw. 2017, 15(4): 504-535.

