5,10,15,20-四(五氟苯基)氯化铁卟啉催化开链苄醚的仿生氧化研究
韩彤辉,顾承志,马晓伟
(石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室,石河子 832003)
苯甲酸酯衍生物在有机化学、药物化学和材料科学中的重要性已经迫使科学家们开发更有效的制备方法[1-2],传统的这类羧酸酯衍生物都是先来自母体羧酸转化成相应的化学计量的酰卤、酸酐或者活性酯再与醇发生亲核取代反应而制备[3]。近几年来自大自然灵感发展醚的α位直接催化氧化制备酯的方法受到极大关注[4-10],这种催化氧化体系的底物都涉及到环状苄醚,底物范围很少包括开链苄醚。本文研究在前期研究的基础上发展了金属卟啉催化芳烃氧化成醌的方法,原本想在该催化体系下把1,3-二氢苯并异呋喃底物氧化成1,4-醌,但预期的氧化产物未得到,而是得到了3-氢苯并异呋喃-1-酮[11],由此推测该催化体系可能对苄醚底物有效,并开展本文开链苄醚仿生氧化的研究。
1 实验部分
1.1 仪器与试剂
主要如下:IKA 加热磁力搅拌器,IKA 机械搅拌器,Agilent7890 A-5975C气质联用仪,BrukerAvanceⅢ 400 HD核磁共振仪,Thermo Fisher Scientific LTQ FTICR-MS高分辨质谱仪;薄层色谱板为青岛海洋化工厂GF254硅胶板;柱层析硅胶为青岛海洋化工厂生产,300~400目;其它化学试剂均为分析纯,阿达玛斯-泰坦科技有限公司。
1.2 实验方法及产物的结构表征
1.2.1 铁卟啉催化开链苄醚的仿生氧化
依次称取1 mmol不同取代的开链苄醚、2 mg F20TPP FeCl(0.2 mmol%)、16.3 mg NHPI(N-羟基邻苯二甲酰亚胺)(0.1 mmol)加入到10 mL反应管中,向该反应管中加入10 mL乙腈溶解,反应混合物置于35 ℃油浴中搅拌反应6 h。TLC 跟踪监测,反应结束后柱层析分离(石油醚∶乙酸乙酯为10∶1)得到固体或油状液体产物 2a至2 r。
1.2.2 目标化合物的结构表征
Ethyl benzoate (2a)[12]。无色油状液体,1H NMR (400 MHz,CDCl3) δ 8.07~8.04 (m,2H,Ar),7.57~7.53 (m,1H,Ar),7.45~7.42 (m,2H,Ar),4.38 (q,2H,J=7.2 Hz,—CH2—),1.40 (t,3H,J=7.2 Hz,—CH3)。13C NMR (101 MHz,CDCl3) δ 166.58,132.74,130.47,129.48,128.26,60.90,14.30。
Methyl 4-isopropylbenzoate (2b)[13]。无色油状液体,1H NMR (400 MHz,CDCl3) δ 7.96 (d,2H,J=8.4 Hz,Ar),7.29 (d,2H,J=8.4 Hz,Ar),3.90 (s,3H,—OCH3),3.01~2.91 (m,1H,PhCH(CH3)2),1.27 (d,6H,J=6.8 Hz,PhCH(CH3)2)。13C NMR (101 MHz,CDCl3) δ 167.16,154.30,129.72,127.76,126.46,51.94,34.25,23.70。
Methyl p-methoxybenzoate(2c)[12]。无色固体,熔点40~41 ℃,1H NMR (400 MHz,CDCl3) δ 7.99 (d,2H,J=9.2 Hz,Ar),6.91 (d,2H,J=9.2 Hz,Ar),3.88 (s,3H,PhOCH3),3.86 (s,3H,—COCH3)。13C NMR (101 MHz,CDCl3) δ 166.83,163.29,131.55,122.58,113.57,55.39,51.83。
Methyl 2-chloro-3,4-dimethoxybenzoate (2 d)。无色油状液体,1H NMR (400 MHz,CDCl3) δ 7.64 (d,J=8.8 Hz 1H,Ar),6.83 (d,J=8.8 Hz,1H,Ar),3.91 (s,3H,—OCH3),3.88 (s,3H,—OCH3),3.85 (s,3H,—OCH3)。13C NMR (101 MHz,CDCl3) δ 188.75,165.65,156.54,146.07,127.49,122.62,109.53,60.52,56.08,52.15。HRMS (ESI)C10H12ClO4[M+H]+理论计算值为231.041 86,实测值为231.041 75。
Butyl 4-isopropylbenzoate (2e)[12]。无色油状液体,1H NMR (400 MHz,CDCl3) δ 7.97 (d,2H,J=8.4 Hz,Ar),7.29 (d,2H,J=8.0 Hz,Ar),4.31 (t,2H,J=6.6 Hz,—OCH2CH2CH2CH3),3.00~2.93 (m,1H,PhCH(CH3)2),1.78~1.71 (m,2H,—OCH2CH2CH2CH3),1.52~1.43 (m,2H,—OCH2CH2CH2CH3),1.27 (d,6H,J=7.2 Hz,PhCH(CH3)2),0.98 (t,3H,J=7.4 Hz,—OCH2CH2CH2CH3)。13C NMR (101 MHz,CDCl3) δ 166.74,154.16,129.68,128.15,126.41,64.61,34.25,30.82,23.71,19.28,13.76。
n-Butyl p-methoxybenzoate(2f)[12]。无色油状液体,1H NMR (400 MHz,CDCl3) δ 7.99 (d,2H,J=9.2 Hz,Ar),6.91 (d,2H,J=8.8 Hz,Ar),4.29 (t,2H,J=6.6 Hz,—OCH2CH2CH2CH3),3.85 (s,3H,PhOCH3),1.77~1.70 (m,2H,—OCH2CH2CH2CH3),1.52~1.42 (m,2H,—OCH2CH2CH2CH3),0.97 (t,3H,J=7.4 Hz,—OCH2CH2CH2CH3)。13C NMR (101 MHz,CDCl3) δ 166.43,163.20,131.49,122.95,113.51,77.32,55.37,30.81,19.27,13.75。
Methyl 2-methylbenzoate (2 g)[12]。无色油状液体,1H NMR (400 MHz,CDCl3) δ 7.91 (dd,1H,J=1.6 Hz,J=8.0 Hz,Ar),7.40 (td,1H,J=1.6 Hz,J=7.6 Hz,Ar),7.26~7.22 (m,2H,Ar),3.89 (s,3H,—OCH3),2.60 (s,3H,PhCH3)。13C NMR (101 MHz,CDCl3) δ 168.06,140.15,131.92,131.65,130.53,129.54,125.66,51.78,21.70。
Butyl 2-methylbenzoate (2 h)[14]。无色油状液体,1H NMR (400 MHz,CDCl3) δ 7.91 (dd,1H,J=1.2 Hz,J=8.0 Hz,Ar),7.39 (td,1H,J=1.6 Hz,J=7.6 Hz,Ar),7.26~7.22 (m,2H,Ar),4.31 (t,2H,J=6.6 Hz,—OCH2CH2CH2CH3),1.79~1.72(m,2H,—OCH2CH2CH2CH3),1.53~1.46 (m,2H,—OCH2CH2CH2CH3),0.98 (t,3H,J=7.4 Hz,—OCH2CH2CH2CH3)。13C NMR (101 MHz,CDCl3) δ 167.77,139.98,131.77,131.62,130.48,129.98,125.64,64.60,30.78,21.73,19.34,13.75。
Benzyl 2-methylbenzoate (2i)[2]。无色油状液体,1H NMR (400 MHz,CDCl3) δ 7.95 (dd,1H,J=8.4,1.3 Hz,Ar),7.46~7.44 (m,2H,Ar),7.41~7.33 (m,4H,Ar),7.24 (d,2H,J=8.0 Hz,Ar),5.34 (s,2H,PhCH2—),2.61 (s,3H,CH3Ph)。13C NMR (101 MHz,CDCl3) δ 167.31,140.34,136.13,132.03,131.68,130.67,129.44,128.57,128.18,128.17,125.69,66.49,21.80。
2-Methylbenzyl benzoate (2j)[15]。无色油状液体,1H NMR (400 MHz,CDCl3) δ 8.08~8.01 (m,2H,Ar),7.58~7.53 (m,1H,Ar),7.45~7.41 (m,3H,Ar),7.29~7.20 (m,3H,Ar),5.38 (s,2H,o-MePhCH2—),2.42 (s,3H,PhCH3)。13C NMR (101 MHz,CDCl3) δ 166.41,137.06,133.96,132.98,130.38,130.13,129.66,129.24,128.53,128.36,126.02,65.21,19.00。
4-Isopropylbenzyl benzoate (2k)[15]。无色油状液体,1H NMR (400 MHz,CDCl3) δ 8.09~7.99 (m,2H,Ar),7.55~7.23 (m,6H,Ar),5.35 (s,2H,—CH2—),2.99~2.86 (m,1H,—CH(CH3)2),1.25 (d,6H,J=6.8 Hz,—CH(CH3)2)。13C NMR (101 MHz,CDCl3) δ 166.40,154.41,136.21,132.90,129.84,128.51,128.28,128.03,126.44,77.32,34.22,23.66。
2-Bromo-4-fluorobenzyl benzoate (2l)。无色油状液体,1H NMR (400 MHz,CDCl3) δ 8.10~7.88 (m,2H,Ar),7.58~7.35 (m,5H,Ar),7.08~7.04 (m,1H,Ar),5.41 (s,2H,—CH2—)。13C NMR (101 MHz,CDCl3) δ 166.13,164.84,162.18 (d,JC-F=250.1 Hz),133.49 (d,JC-F=9.3 Hz),133.20,131.30 (d,JC-F=8.6 Hz),129.73,128.44,123.90 (d,JC-F=9.7 Hz),120.26 (d,JC-F=24.4 Hz),114.64 (d,JC-F=21.0 Hz),65.57。HRMS (ESI)C14H11BrFO2[M+H]+理论计算值为308.992 10,实测值为308.992 40。
1-Phenylpropyl benzoate (2 m)。无色油状液体,1H NMR (400 MHz,CDCl3) δ 8.10~8.08 (m,2H,Ar),7.57~7.53 (m,1H,Ar),7.45~7.40 (m,4H,Ar),7.36~7.24 (m,3H,Ar),5.92 (t,1H,J=6.6 Hz,PhCH(CH2CH3)—),2.13~1.90 (m,2H,PhCH(CH2CH3)—),0.96 (t,3H,J=7.4 Hz,PhCH(CH2CH3)—)。13C NMR (101 MHz,CDCl3) δ 165.84,140.59,132.85,130.52,129.60,128.39,128.31,127.80,126.44,77.86,29.55,9.94。HRMS (ESI)C16H17O2[M+H]+理论计算值为241.122 31,实测值241.122 10。
1-(4-Fluorophenyl) ethyl benzoate (2n)[14]。黄色油状液体,1H NMR (400 MHz,CDCl3) δ 8.09~8.06 (m,2H,Ar),7.59~7.54 (m,1H,Ar),7.47~7.41 (m,4H,Ar),7.08~7.03 (m,2H,Ar),6.12 (d,J=6.6 Hz,1H,PhCH(CH3)—),1.67 (d,J=6.8 Hz,3H,PhCH(CH3)—)。13C NMR (101 MHz,CDCl3) δ 165.71,162.32 (d,JC-F=247.1 Hz),137.56 (d,JC-F=3.1 Hz),132.97,130.36,129.59,128.34,127.85 (d,JC-F=8.2 Hz),115.39 (d,JC-F=21.5 Hz),72.23,22.34。19F NMR (376 MHz,CDCl3) δ -114.37。
1-(2-Fluorophenyl) ethyl benzoate (2o)[14]。无色油状液体,1H NMR (400 MHz,CDCl3) δ 8.09 (d,J=7.6 Hz,2H,Ar),7.56 (t,J=7.2 Hz,1H,Ar),7.51~7.43 (m,3H,Ar),7.30~7.25 (m,1H,Ar),7.14 (t,J=7.6 Hz,1H,Ar),7.08~7.04 (m,1H,Ar),6.39 (q,J=6.6 Hz,1H,PhCH(CH3)—),1.69 (d,J=6.8 Hz,3H,PhCH(CH3)—)。13C NMR (101 MHz,CDCl3) δ 165.52,159.75 (d,JC-F=248.5 Hz),132.98,130.30,129.64,129.33 (d,JC-F=8.4 Hz),129.02 (d,JC-F=13.5 Hz),128.35,127.12 (d,JC-F=4.1 Hz),124.25 (d,JC-F=3.5 Hz),115.62 (d,JC-F=21.6 Hz),67.45 (d,JC-F=2.9 Hz),21.4 (d,JC-F=8.2 Hz)。19F NMR (376 MHz,CDCl3) δ -118.28。
1-(2-Fluorophenyl) propyl benzoate (2p)。无色油状液体,1H NMR (400 MHz,CDCl3) δ 8.12~8.09 (m,2H,Ar),7.55 (tt,J=1.4 Hz,J=7.2 Hz,1H,Ar),7.46~7.41 (m,3H,Ar),7.26~7.23 (m,1H,Ar),7.11 (td,J=1.2 Hz,J=7.6 Hz,1H,Ar),7.07~7.02 (m,1H,Ar),6.22 (t,J=6.6 Hz,1H,PhCH(CH2CH3)—),2.13~1.96 (m,2H,PhCH(CH2CH3)—),0.99 (t,J=7.4 Hz,3H,PhCH(CH2CH3)—)。13C NMR (101 MHz,CDCl3) δ 165.60,159.90 (d,JC-F=248.2 Hz),132.95,130.28,129.60,129.22 (d,JC-F=8.3 Hz),128.34,127.87 (d,JC-F=13.6 Hz),127.55 (d,JC-F=4.1 Hz),124.12 (d,JC-F=3.6 Hz),115.50 (d,JC-F=21.8 Hz),72.02 (d,JC-F=2.2 Hz),28.58 (d,JC-F=1.4 Hz),9.73。19F NMR (376 MHz,CDCl3) δ -118.04。HRMS (ESI)C16H16FO2[M+H]+理论计算值为259.112 88,实测值259.112 52。
1-(3-Chlorophenyl) ethyl benzoate (2q)。无色油状液体,1H NMR (400 MHz,CDCl3) δ 8.10~8.07 (m,2H),7.57 (tt,J=1.2 Hz,J=7.6 Hz,1H,Ar),7.48~7.43 (m,3H),7.32~7.28 (m,3H),6.09 (d,J=6.8 Hz,1H),1.66 (d,J=6.4 Hz,3H)。13C NMR (101 MHz,CDCl3) δ 165.65,143.83,134.43,133.07,130.20,129.87,129.64,128.39,128.04,126.16,124.24,72.13,22.36。HRMS (ESI)C15H14ClO2[M+H]+理论计算值为261.067 68,实测值261.067 44。
2 结果与讨论
2.1 反应条件优化
以苄基乙醚的氧化为模型反应,反应条件为1 mmol苄基乙醚、溶剂10 mL、反应时间6 h,反应方程式为

,筛选出最佳催化体系,结果如表1所示。
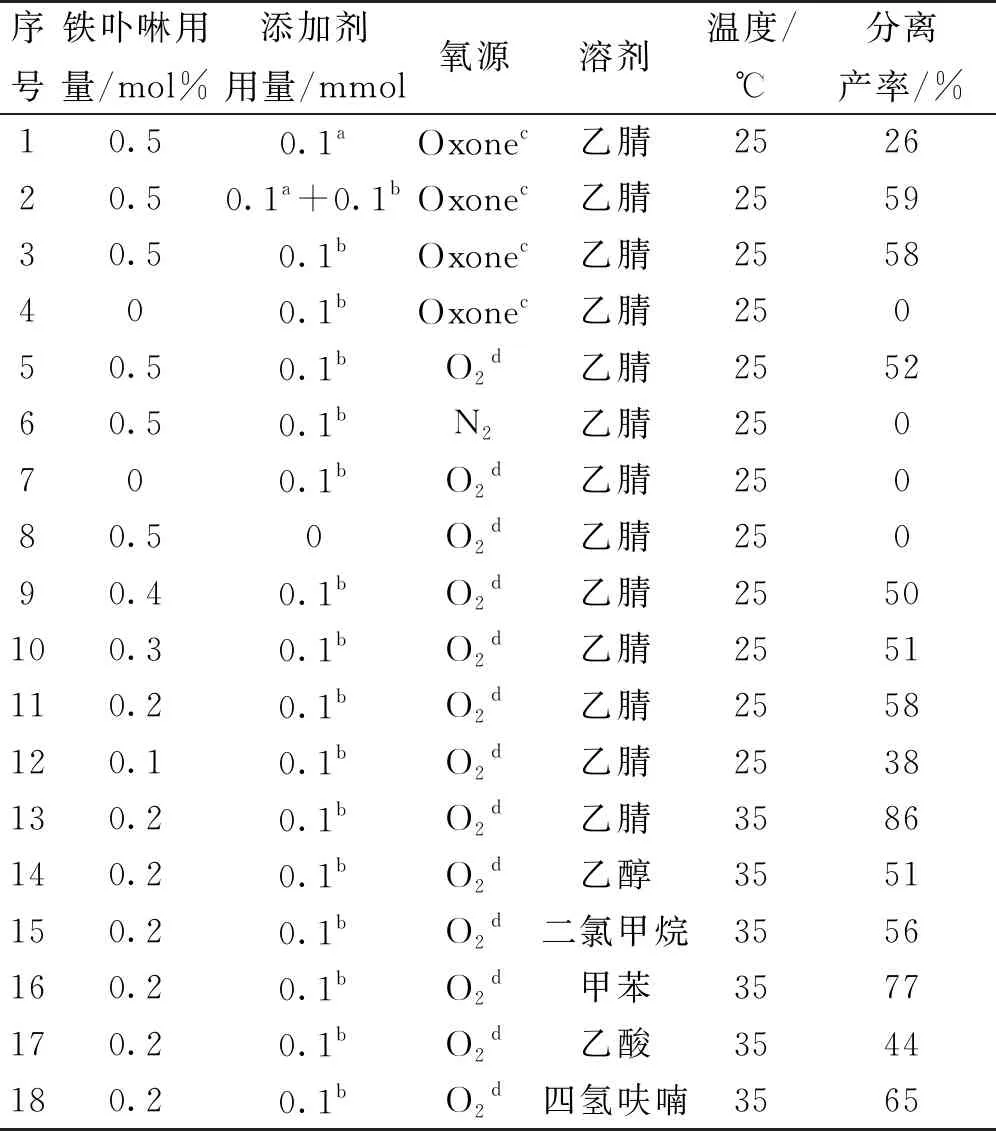
表1 反应条件优化
在本研究以前的反应催化体系中(0.5 mol%的金属卟啉、0.1 mmol四丁基碘化铵、2.1 mmol过硫酸氢钾复合盐(Oxone)),目标氧化产物收率较低,仅为26%(序号1);当添加0.1 mmolNHPI(N-羟基邻苯二甲酰亚胺),目标氧化产物分离产率提高到59%(序号2);不加相转移催化剂对反应影响很小(序号3),氧源为氧气的分离收率为52%,且氧气作为氧化剂显然比过硫酸氢钾更清洁环保。进一步的控制实验表明,金属卟啉、NHPI和氧气至关重要,三者缺一不可(序号6~8)。金属卟啉催化剂的用量实验结果表明(序号9~12),用量为0.2 mmol% 时产率达到58%;当反应温度提高到35 ℃,目标氧化产物的分离产率达到86%;反应溶剂优化(序号14~18)实验结果表明,乙腈是最适合的溶剂。
综上所述,确定最优反应条件如下:底物1 mmol,0.2 mol%铁卟啉为催化剂,NHPI用量为0.1 mmol,氧气为终端氧化剂,溶剂乙腈10 mL,反应温度为35 ℃,反应时间6 h。
2.2 底物拓展
在最优催化条件下对金属卟啉催化开链苄基醚的反应底物进行拓展研究,反应方程式如下:
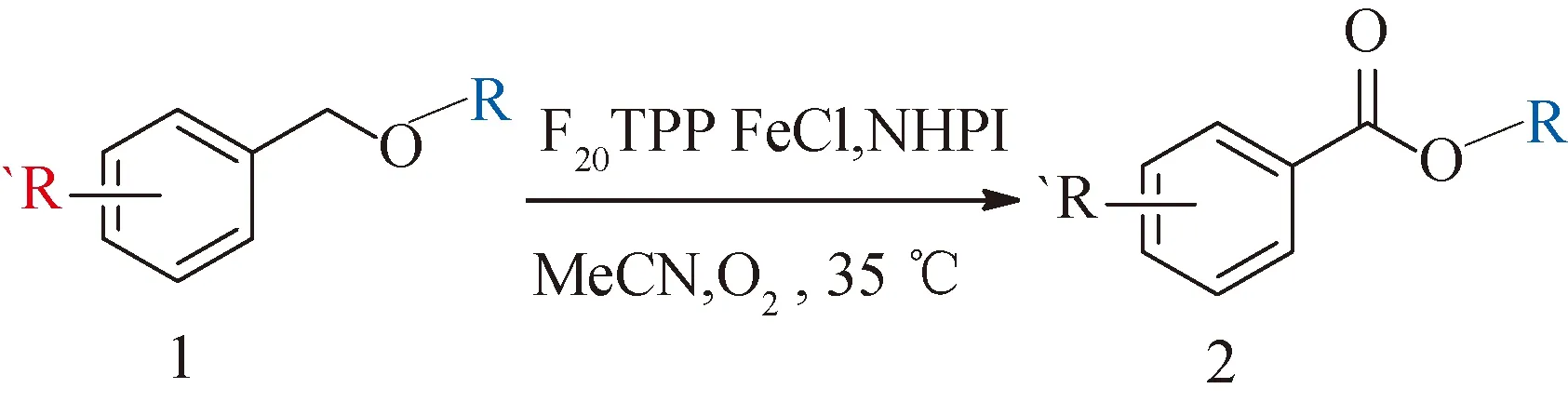
,结果如表2所示。
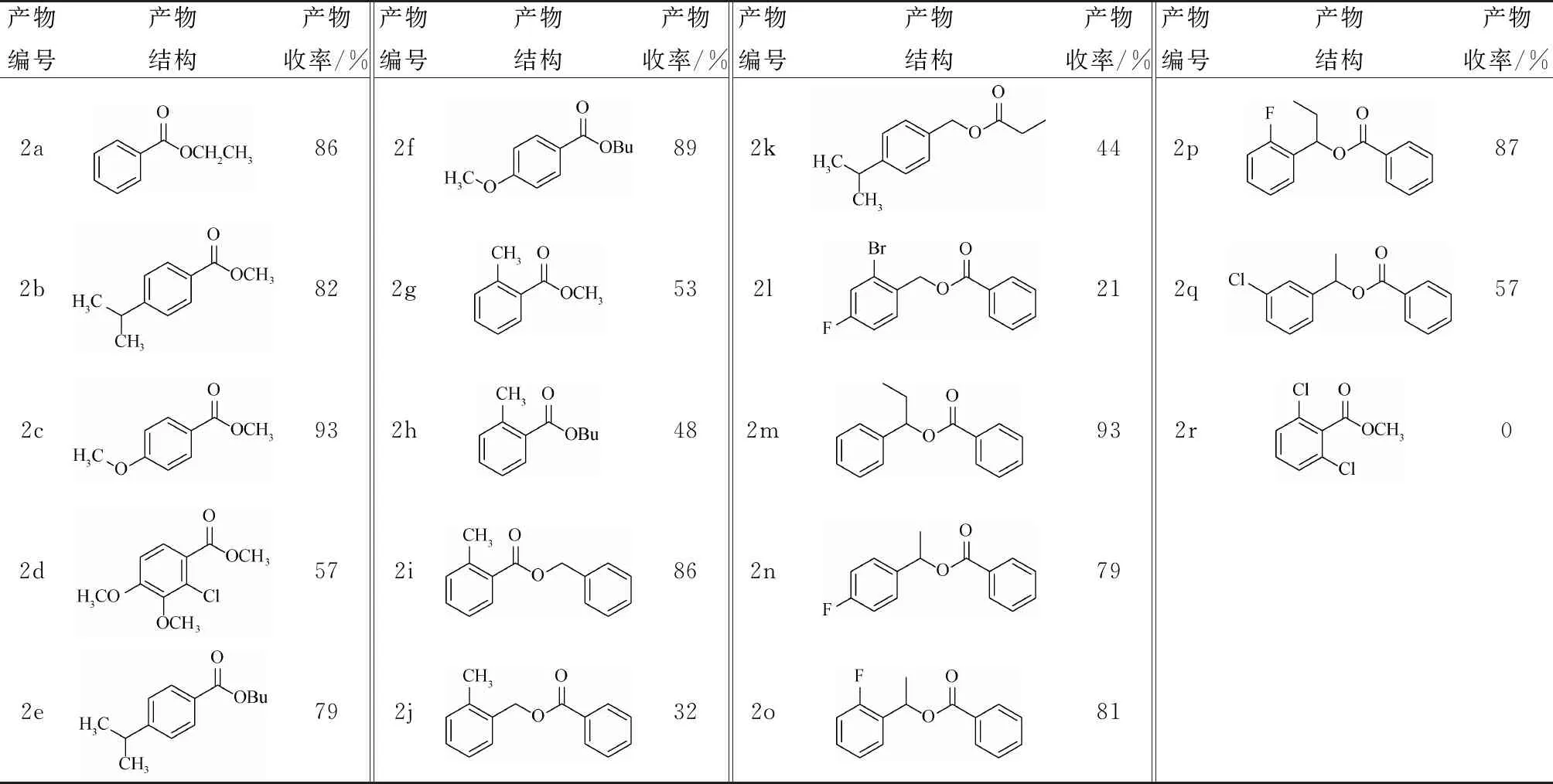
表2 底物普适性调查
从表2可知:大多数的底物都是兼容的,尤其是供电子基团在苯环4位时产率优秀(2b、2c、2e和2f);当苯环的邻位有取代基时,无论供电子还是给电子基,产率中等;尤其是不对称苄醚的空间位阻效应尤其明显,2,6-二氯苄基甲醚不反应,除了邻位取代的底物外,3位或4位无论是供电子还是拉电子基都有相应的活性,最终的氧化产物的收率在57%~93%之间。
3 结论
(1)在铁卟啉和NHPI催化下成功实现了以O2为终端氧化剂、开链苄醚温和氧化成苯甲酸酯衍生物的反应。这一方法不仅适用于间位或对位苄醚底物,也适用于邻位空间位阻基团合适的苄醚底物,产率21%~93%。
(2)反应的最佳催化反应条件为:开链苄醚底物1 mmol,铁卟啉0.2 mol%,NHPI0.1 mmol,氧气为终端氧化剂,溶剂乙腈10 mL,反应温度为35 ℃,反应时间6 h。这一催化体系具有反应条件温和、底物适用范围广、原料廉价易得等优点,在苯甲酸酯的绿色合成方面具有重要的应用前景和实用价值。

