宫颈癌细胞中RNA干扰SNX10基因对细胞增殖和凋亡影响的研究
张春贺,付少伟,王芳,王露月,者湘漪,,李洪涛,李冬妹,潘泽民*
(1 石河子大学医学院生物化学教研室/新疆地方与民族高发病教育部重点实验室,新疆 石河子832002;2 石河子大学医学院人体解剖学与组织胚胎学教研室,新疆 石河子 832002)
宫颈癌在女性最常见的癌症中排名第二,它也是不发达地区女性因癌症死亡的主要原因之一[1]。新疆是宫颈癌的高发地区[2]。流行病学研究已经证实不同类型的HPV显示了不同的致癌潜力和生物活性,也有一定的地区性。地区差异性与宿主的人类白细胞抗原(HLA)的多态性相关[3]。宫颈癌是高度恶性癌症,易于转移和侵袭,并且预后很差。早期通常没有明显的症状和体征,容易忽视和漏诊。即使宫颈癌的诊断技术和治疗策略已经得以提升,但宫颈癌的死亡率依然很高,肿瘤侵袭和转移是导致宫颈癌患者死亡的主要原因[4]。因此,全面了解宫颈癌发生发展的分子机制对宫颈癌的预防和治疗具有重大的意义[5]。持续感染高危型人乳头瘤病毒(HR-HPV)是导致浸润性宫颈癌的主要原因[6]。HPV预防性疫苗虽已在发达地区普及,但尚未有证据表明其终身有效,并且不能逆转宫颈病变等级。
SNX10是分拣连接蛋白家族(sorting nexins,SNXs)中结构最简单的成员之一。它包括一个磷酸结构域(PX),并具有高度保守性。它参与分选和运输内体系统,还涉及到正常组织发育和体内稳态平衡的发展[7]。通过PX结构域,SNX10蛋白靶向内体膜并在多种内体转运途径中发挥作用[8]。研究表明,SNX10基因在肝脏、脑组织、骨髓组织、脾脏、肾脏和肺高水平表达,低水平表达于胰腺、心脏和骨骼肌。目前,对于SNX10基因甚至对SNXs基因家族的功能研究甚少,这促使我们进一步研究探索该基因。
SNX10基因在宫颈癌中的作用还不清楚。Expression Atlas数据库分析显示SNX10基因在正常宫颈组织中低表达,前期通过基因芯片实验发现SNX10基因在宫颈癌组织中相比于正常宫颈组织中异常高表达。通过研究SNX10基因在宫颈癌组织和细胞发生和发展中的作用,对发现宫颈癌生物标志物,宫颈癌的预防和治疗具有非常重要的意义。
1 材料与方法
1.1 标本来源
收集2017年12月—2018年9月通过手术切除或活检获得的77例新疆地区妇女的宫颈组织标本,标本包括30例正常宫颈组织标本(来源为子宫全切除术后样本)及33例宫颈癌标本(来源于原发性宫颈癌切除标本),14例宫颈上皮内瘤变(CIN)组织(来源为子宫全切除后或者原发性宫颈癌切除标本),收集患者病史资料及HC-2检测的HPV感染结果。所有样本均经石河子大学医学院第一附属医院病理部门确认并获得患者及其家属的同意,标本的采集得到“石河子大学医学院第一附属医院伦理委员会的批准”,患者已签署知情同意书。
1.2 组织芯片实验
选取宫颈癌与正常宫颈组织HE染色病理切片及相应的石蜡标本,由病理部门确认正常宫颈上皮组织及癌组织位点并标记,以此方便打孔。组织芯片蜡块在石河子大学医学院病理系协助完成,而后进行切片。使用免疫组织化学(IHC)对组织芯片进行染色,用PBS作为阴性对照组的一抗进行孵育。将一抗(SNX10抗体,博奥森)稀释至1∶100。
1.3 细胞及试剂
实验所用细胞及试剂具体如下(表1)。

表1 细胞及试剂
1.4 ShRNA干扰片段来源
由上海吉玛基因公司设计,具体信息如下 (表2)。

表2 ShRNA干扰片段
1.5 宫颈癌细胞的培养及siRNA干扰
宫颈癌SiHa和HeLa细胞在5%CO2,37 ℃恒温培养箱中常规培养,培养基为DMEM+10%FBS+1%双抗(青-链霉素),待细胞密度85%左右时用含0.25%EDTA的胰酶消化离心。待转染细胞(SiHa和HeLa细胞)铺6孔板,密度控制在2.5×105个细胞/孔,培养箱培养至密度达到60%~80%时,用FuGENE HD转染试剂进行转染。待转染的细胞共分四组:空白组(常规培养的SiHa和HeLa细胞);阴性对照(NC组,转染空载体的SiHa和HeLa细胞);转染Sh-SNX10-303实验组和Sh-SNX10-647的实验组,培养箱中培养用于后续实验。
1.6 Western blot 实验
在细胞转染后48 h裂解提蛋白(RIPA+1%PMSF),通过SDS-PAGE胶电泳分离样品,80 V跑30 min,而后110 V继续跑1 h;转膜条件为湿转80 V 1 h。常温在5%奶粉中封闭2 h。4 ℃冰箱孵育一抗(SNX10抗体稀释比为1∶500,1∶1 000稀释GAPDH抗体,GAPDH为内参)过夜。次日,洗去一抗,常温孵育二抗(SNX10为多克隆兔抗,GAPDH为单克隆鼠抗)2小时,TBST洗膜后曝光检测蛋白质表达。
1.7 实时荧光定量PCR检测SNX10基因表达
收集对照组及实验组细胞,按照RNAiso Plus(Takara)试剂说明书,冰上提取细胞总RNA样品,无酶水溶解RNA沉淀,反转录合成cDNA后用特异引物扩增内参(GAPDH)和目的(SNX10)基因,并进行对比,以GAPDH基因mRNA表达水平为标准。mRNA的表达变化根据计算2-ΔΔCT方法(CT,循环阈值),其中ΔCT=CTSNX10-CTGAPDH,ΔΔCT=ΔCT实验-ΔCT对照。分别记录内参基因GAPDH及SNX10基因mRNA的表达水平,每组设4个复孔,GAPDH作为参照,比较实验组和处理组细胞SNX10基因mRNA的表达,引物序列见表3。实验重复3次。

表3 目的基因引物设计
1.8 CCK-8实验
稳定转染的SiHa和HeLa细胞,将其消化离心后制成细胞悬液,96孔板中每孔加入200 μL培养基,细胞计数后按照1500个细胞每个孔加入对应孔中,加样孔周围加PBS保持湿度。待细胞贴壁后每隔12小时每孔先吸去原培养基,然后用DMEM稀释CCK-8试剂(90 μL DMEM+10 μL CCK-8试剂,混匀)后,每孔100 μL混合液加到96孔板中,继续培养3 h,用酶标仪测定吸光度(450 nm)。
1.9 流式细胞术检测细胞凋亡
取稳定转染SNX10基因干扰质粒组和NC组的SiHa和HeLa细胞。胰酶消化后,吹散细胞至细胞悬液,PBS清洗细胞后离心。采用Annexin-V抗体(FITC) 标记和PI染料双染法,操作步骤严格按照凋亡试剂盒(联科生物科技有限公司)说明书进行。
1.10 统计学分析
使用SPSS 20.0 软件对所得数据进行统计分析,每个实验重复3次,组间比较均采用t检验,计量资料用均数±标准差表示,P<0.05为差异有统计学意义。采用非参数秩和检验分析组织芯片结果,P<0.05为差异有统计学意义。
2 结果
2.1 SNX10在宫颈癌组织中高表达
33例宫颈癌组织及30例正常宫颈组织制成组织芯片并进行免疫组织化学染色,染色结果由石河子大学病理学专家判定(图1)。汇总结果显示,30例正常宫颈组织样本中有4例SNX10蛋白表达为阴性,24例SNX10蛋白弱阳性,2例SNX10蛋白中阳性,无强阳性;而在33例宫颈癌组织样本中,SNX10蛋白表达强阳性的有2例,中阳性15例,弱阳性16例,无阴性病例,经统计学两独立样本的非参数检验分析结果显示SNX10蛋白在宫颈癌组织中高表达,差异显著(表4)。

图1 SNX10蛋白在宫颈癌组织中的表达情况

表4 SNX10免疫组化染色统计结果
2.2 SNX10蛋白表达与HPV感染的相关性

表5 SNX10与HPV感染的相关性
HC-2检测所收集标本中HPV感染情况,分析SNX10组织芯片结果与HPV感染的相关性,结果显示SNX10的表达与HPV感染无明显相关性(P>0.05)。SNX10在宫颈癌组织中高表达可能是受到宫颈癌病变过程中其他因素的调控(表5)。
2.3 SNX10基因在宫颈癌细胞中的表达情况
根据组织芯片实验结果,发现SNX10在宫颈癌组织中较正常宫颈组织表达水平增高;通过实验分析SNX10基因在宫颈癌细胞中的表达情况,实时荧光定量PCR实验结果显示SNX10基因在宫颈癌细胞(SiHa、HeLa和C33A细胞)与HaCaT细胞(一种永生化的角质形成细胞)相比mRNA表达水平增高。Western blot结果显示在宫颈癌细胞中,SNX10蛋白比在HaCaT细胞中表达水平高。由此可知,SNX10基因在宫颈癌发生和发展过程中mRNA和蛋白质表达水平上都增加(图2)。

*:P<0.05,**:P<0.01;***:P<0.001;****:P<0.0001。
2.4 CCK-8增殖实验分析RNA干扰SNX10基因表达后细胞增殖情况
根据上述实验结果,我们已经初步判定宫颈癌发生时,SNX10基因表达水平升高,但未明确其在宫颈癌发生和发展中的作用,通过设计RNA干扰实验,干扰了宫颈癌细胞中SNX10基因的表达。结果显示,RNA干扰SNX10基因后,Sh-SNX10-303组和Sh-SNX10-647组细胞的增殖能力明显低于Sh-NC组(图3)。
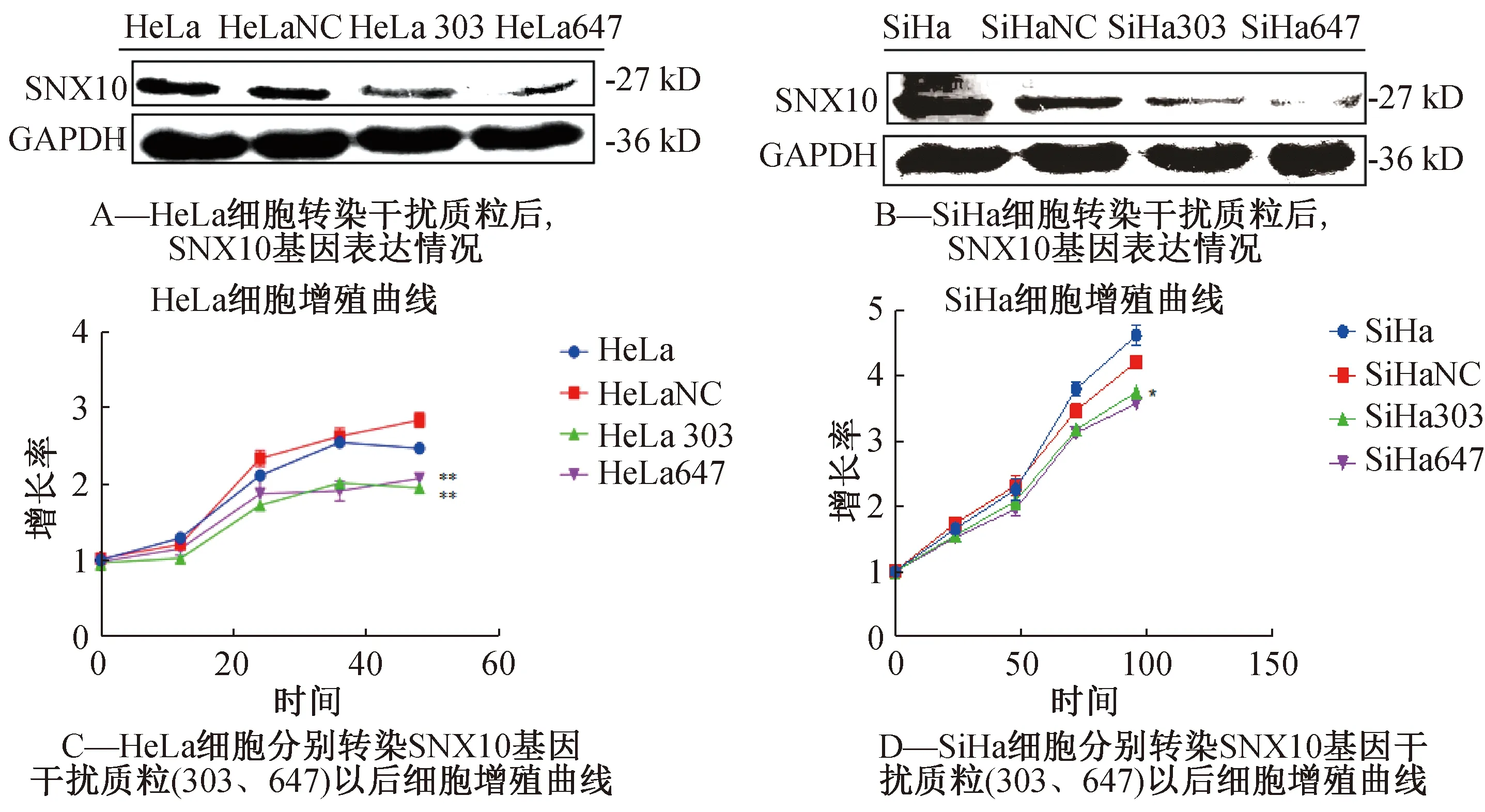
图3 CCK-8实验检测宫颈癌SiHa和HeLa细胞增殖能力
2.5 流式细胞术分析RNA干扰后对宫颈癌细胞凋亡的影响
SiHa和HeLa细胞RNA干扰SNX10基因后,细胞凋亡率较对照组明显增加,表明干扰SNX10基因后,促进了宫颈癌细胞的凋亡(图4)。

图4 SNX10敲低后对宫颈癌细胞凋亡的影响
3 讨论
SNX10是拣选连接蛋白家族的成员,一般来说,根据不同的结构域SNXs分为3种类型,第一种是SNXs包含Bar (Bin,amphiphysin,Rvs)结构域,包括SNX1、2、4、5、6、7、8、9、18、30、32和33。除了PX结构域,还有C-端的Bar结构域,是常被研究的连接蛋白家族成员的一类。第二类是只含PX结构域的SNXs,包括SNX3、10、11、12、16、20、21、22、24和29。它们相对简单结构也提升了研究的难度,只有少数成员曾被研究。除了这两种,其他蛋白家族成员被分为第三种,包括SNX13、14、15、17、19、23、25、26、27、28和31,这些蛋白含有许多不同的结构域,例如FERM域,PDZ域,SH3域等等。不像传统的内体调节蛋白例如Rab,SNXs通常不整体上调内体,只调节其中不同蛋白的运输,这使对SNXs的研究更有意义。
课题组前期基因芯片分析显示SNX10基因在宫颈癌组织中较正常组织高表达,通过KEGG信号通路数据库分析SNX10基因可能参与的信号途径,SNX10基因参与了胞吞作用、WNT配体发生和转运、离子通道传输以及刺激感应通道的作用。SNX10与V-ATPase相互作用,V-ATPase将质子泵入囊泡中以诱导其酸化。含有V-ATP酶的囊泡分布在不同的细胞内区室中,并在内吞作用,胞吐作用,蛋白质降解等过程中发挥关键作用[9]。有研究表明,在结直肠癌中,SNX10基因表达影响其增殖,但其对宫颈癌增殖的影响尚不明确,这促使我们进一步研究。
通过组织芯片实验及Western blot实验发现SNX10蛋白在宫颈癌组织及细胞中高表达,HC-2检测HPV感染结果与SNX10蛋白质表达相关性分析表明SNX10蛋白质表达与HPV感染不相关。RNA干扰SNX10基因表达后,宫颈癌细胞的凋亡率显著增加,增殖也被明显的抑制。肿瘤细胞具有低凋亡率并可以迅速扩散,这种发生和发展的特征是不可控的。早期的肿瘤会在较短的时间内快速增殖为较大肿瘤而不易被发现,对周围组织造成压迫。因此,通过研究影响宫颈癌发生发展过程中增殖相关分子对防治宫颈癌有重要意义。
研究表明SNX10基因可能参与MMP9运输。MMPs(基质金属蛋白酶)是锌依赖性蛋白酶,有助于发育和组织稳态,并通过消化各种各样的底物来调节癌症的进展[10],MMP有降解细胞外基质来提高癌症侵袭生长率和促进血管生成,大量证据表明MMP-9在肿瘤发生和转移中起关键作用。破骨细胞敲除SNX10基因后,明显降低了JNK,p38和ERK3种蛋白的磷酸化水平[11]。SNX10蛋白的高水平表达会下调EGFR的蛋白表达。在肝癌小鼠模型中发现,SNX10的mRNA在肿瘤组织中高表达,并受到miR-30 d的调控,可作为潜在的肝癌标志物[12]。miR-30 d在不同类型癌症中对肿瘤的发展起到的作用不同,其在膀胱癌、乳腺癌、结直肠癌等九种癌症中可以高频率扩增,并通过调节转移,凋亡,增殖和分化而成为重要的发病机制[13]。但其在肾癌和前列腺癌中起到与其他癌症中不同的作用——抑制了癌症发展[14]。SNX10基因在宫颈癌发生发展的作用以及是否受到miR-30 d调控还不十分清楚,其表达调控机制尚不明确。
本研究发现SNX10基因在宫颈癌细胞中表达水平增高,且与癌细胞的增殖和凋亡相关,不受HPV感染的影响。通过RNA干扰实验使SNX10基因表达水平降低,它能够抑制宫颈癌细胞的增殖并能够促进其凋亡。它在宫颈癌细胞中的增殖和凋亡的机制需要进一步地实验证明。本实验揭示了SNX10基因或许会成为宫颈癌的一个潜在的治疗靶标。

