葛根蛋白提取工艺及其体外抗氧化性研究
王苗,张红印,范琳,张荣榕,马馨桐,严铭铭*,邵帅*,赵大庆
(1.长春中医药大学吉林省中药保健食品科技创新中心,吉林 长春 130117;2.吉林省人参科学研究院,吉林 长春 130117)
葛根为豆科植物葛根Pueraria lobata(Willd.)Ohwi的干燥根[1],是我国最常见的中药之一,始载于《神农本草经》[2]。现代医学研究表明,葛根中含有的黄酮类成分葛根素对糖尿病、高血压、高血脂和心脑血管等疾病有一定疗效,葛根中总黄酮对中年妇女和绝经妇女养生保健作用明显。药用价值极高的葛根,素有“亚洲人参”之美誉,2002年被国家原卫生部正式批准为“药食同源”植物,近年来,含葛根的食品及保健食品层出不穷,主要有葛根黄酮类功能食品、葛根低聚糖食品、葛根奶粉、葛根挂面、葛根软糖等营养食品。
研究表明葛根除含有黄酮等功效成分外,还含有丰富的氨基酸,尤其是人体不能合成的必需氨基酸含量更高。氨基酸是蛋白质的基本组成单位,所以对于葛根蛋白的研究十分有意义,但受蛋白提取率低的影响,目前关于葛根蛋白的研究很少。仅有文献报道[3]利用Tris-HCl法提取粉葛蛋白,并没对其功效进行研究。
随着近年来对于植物蛋白研究开发的重视,本研究在前期预试验基础上,以葛根为原料,通过碱提酸沉法提取葛根蛋白,在单因素试验基础上,采用Box-Behnken响应面分析法对葛根蛋白提取工艺进行优选,并对最优条件下提取的葛根蛋白的抗氧化活性进行表征。
1 材料与方法
1.1 材料与仪器
葛根:吉林省长春市同仁堂大药房,产地河北省保定市,批号20190704,经长春中医药大学药学院姜大成教授鉴定为豆科植物葛根Pueraria lobata(Willd.)Ohwi的干燥根;Bradford蛋白浓度测定试剂盒、牛血清蛋白标准溶液:天根生化科技有限公司;硫酸铵、氢氧化钠、98%浓盐酸(均为分析纯):北京化工厂。
SKD-200型凯氏定氮仪:上海沛欧分析仪器有限公司;DT5-2B型低速台式离心机:北京时代北利离心机有限公司;KQ3200B型超声波清洗器:昆山市超声仪器有限公司;UV-1700型紫外分光光度计:岛津(上海)仪器有限公司;FDU-1200型冷冻干燥机:EYELA东京理化器械株式会社。
1.2 方法
1.2.1 葛根提取物中蛋白含量测定
采用考马斯亮蓝Bradfrod法测定葛根提取物中蛋白质含量。标准曲线绘制:分别取 0、10、20、30、40、50、60 μL牛血清蛋白标准溶液(1 mg/mL)加入磷酸盐缓冲溶液(phosphatebufferedsaline,PBS)补足到150μL。向各试管中加入2.85 mL考马斯亮蓝染液,混匀,室温(25℃)放置5 min,采用紫外分光光度计在595 nm处测定吸光度值。以牛血清蛋白质量浓度为横坐标,吸光度值为纵坐标绘制标准曲线,通过标准曲线得到线性回归方程:y=0.013 3x+0.027 9,R2=0.999 7。葛根提取物中蛋白质含量根据上述回归方程求得。
1.2.2 提取率计算公式

1.2.3 葛根蛋白等电点测定
根据预试验结果,称取适量葛根药材,按料液比1∶25(g/mL)加入蒸馏水,调节pH值至10,在水浴温度45℃下浸提2.5 h,4 000 r/min离心,得上清液。上清液分别用1 mol/L HCl调pH值至1 ~7,静置离心,收集沉淀,冷冻干燥后称重,以pH值为横坐标,沉淀质量为纵坐标,绘制标准曲线,沉淀量最大处的pH值[4]即为葛根蛋白的等电点。
1.2.4 不同提取方法比较
通过文献查阅结合预试验结果制定出4种葛根蛋白提取方法,如下:
方法1[5]:葛根药材→蒸馏水40℃浸提→离心(4 000 r/min,20 min)→上清液→硫酸铵分级沉淀→静置→离心取沉淀(4 000 r/min,20 min)→沉淀用蒸馏水透析、浓缩→冷冻干燥→葛根蛋白样品。
方法2:葛根药材→碱液浸提(加入NaOH→调pH值→置于恒温水浴)→离心(4 000 r/min,20 min)→上清液→加HCl调pH值至等电点→离心(4 000 r/min,20 min)→沉淀用蒸馏水透析、浓缩→冷冻干燥→葛根蛋白样品。
方法3[6]:葛根药材→70%乙醇浸提→振荡1 h→离心(4 000 r/min,20 min)→上清液→盐析→静置→离心取沉淀(4 000 r/min,20 min)→沉淀用蒸馏水透析、浓缩→冷冻干燥→葛根蛋白样品。
方法4[7]:葛根药材→加入50 mmol/L三羟甲基氨基甲烷-HCl→50℃浸提0.5h→离心(4000r/min,20min)→透析、浓缩→冷冻干燥→葛根蛋白样品。
针对以上4条工艺路线,以葛根蛋白提取率为评价指标,筛选葛根蛋白最佳提取方法。
1.2.5 单因素试验
以葛根蛋白提取率为评价指标,通过单因素试验考察提取温度(30、35、40、45、50 ℃)、提取时间(1、1.5、2、2.5、3h)、料液比[1 ∶10、1 ∶15、1 ∶20、1 ∶25、1 ∶30(g/mL)]3个因素对葛根蛋白提取效果的影响。
1.2.6 Box-Behnken响应面试验设计
在单因素试验基础上,采用响应面法中Box-Behnken中心组合试验设计原理[8],以提取温度(A)、提取时间(B)、料液比(C)为自变量,提取率(Y)为响应值,试验因素水平见表1。

表1 Box-Behnken响应面试验因素水平表Table 1 Box-Behnken response surface test factor level table
1.2.7 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
分离胶浓度为15%、浓缩胶浓度为5%,样品和Marker上样量均为20 μL。采用垂直板电泳,条件为浓缩胶电压70 mV,分离胶电压140 mV。电泳结束后用考马斯亮蓝R250染色,脱色液脱色至条带清晰[9]。
1.2.8 葛根蛋白体外抗氧化试验
1.2.8.1 DPPH自由基清除能力测定
取不同浓度葛根蛋白溶液1mL于试管中,加入3mL 0.004% DPPH溶液,混匀于暗室反应30 min,在517 nm处测定吸光度值A1;空白组为1mL蒸馏水和3mL0.004% DPPH溶液,测定吸光度值A0;样品对照组用3 mL甲醇代替DPPH溶液,测定吸光度值A2。以甲醇作为空白调零,VC作为阳性对照组[10]。清除率计算公式如下:
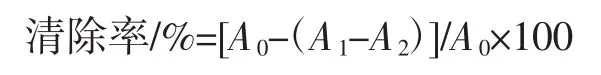
1.2.8.2 羟基自由基清除能力测定
取不同浓度葛根蛋白溶液1 mL于试管中,加入1 mL 0.75 mmol/L邻二氮菲溶液和1.5 mL 0.2 mol/L PBS,混匀,再加入1 mL 0.75 mmol/L FeSO4溶液和1 mL 0.01% H2O2溶液,充分混匀,37℃水浴反应1 h,在536 nm处测定吸光度值A1;正常组以2 mL蒸馏水代替1 mL样品溶液和1 mL 0.01% H2O2溶液,测定吸光度值A0;阴性组以1 mL蒸馏水代替样品,测定吸光度值A2;样品对照组以3mL蒸馏水代替1mL 0.75mmol/L邻二氮菲溶液、1 mL 0.75 mmol/L FeSO4溶液、1 mL 0.01% H2O2溶液,测定吸光度值A3。以蒸馏水作为空白调零,VC作为阳性对照[11]。清除率计算公式如下。
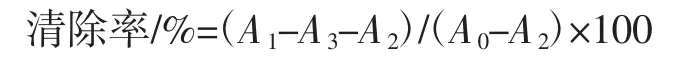
1.2.8.3 总还原能力测定
取1 mL不同浓度葛根蛋白于试管中,分别加入2.5 mL 0.2 mol/L PBS 和 2.5 mL 1% K3Fe(CN)6溶液,50℃水浴反应20min,冷却,加入2.5mL10%三氯乙酸,离心,取上清液2.5mL,依次加入2.5mL蒸馏水和0.5mL 0.1% FeCl3溶液,摇匀,静置,在700nm处测定吸光度值A1;以 2.5mL 蒸馏水代替 2.5mL1% K3Fe(CN)6溶液,其余步骤相同,测定吸光度值A2。以蒸馏水作为空白调零,VC作为阳性对照组[12]。总还原能力计算公式如下。

1.3 统计处理
每个试验重复3次,结果以均值±标准差表示。采用软件Origin 8.0进行图表制作,Design-Expert V8.0.6软件进行响应面试验设计及相应数据处理。
2 结果与分析
2.1 葛根蛋白等电点测定结果
葛根蛋白等电点测定结果见图1。
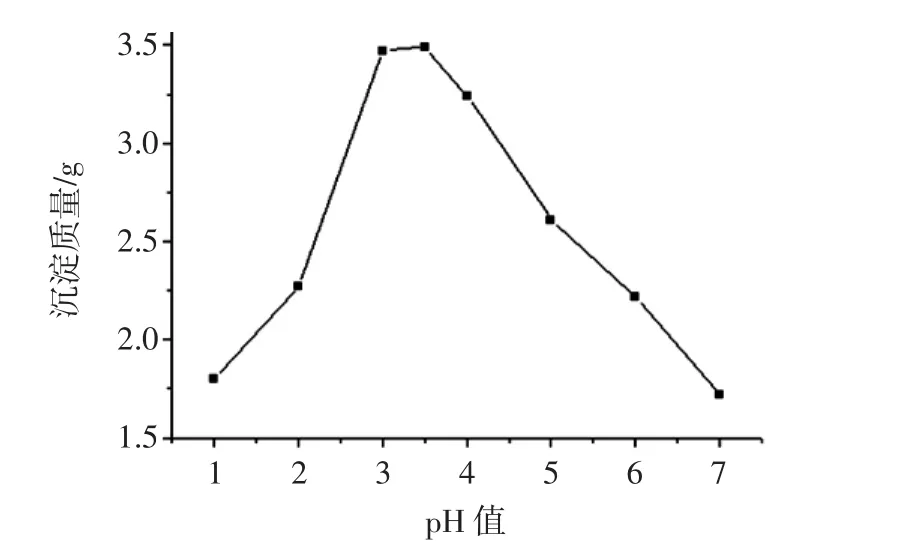
图1 葛根蛋白等电点测定Fig.1 Determination of isoelectric point of Pueraria lobata protein
当pH值为3.5时,沉淀质量最大。这是因为当蛋白质溶液pH值处于等电点时,蛋白质分子表面不带电荷呈电中性,分子间的斥力减弱,容易受静电引力[13]影响聚集而产生沉淀,所以葛根蛋白的等电点为3.5。
2.2 不同提取方法比较结果
以葛根蛋白提取率为评价指标,筛选葛根蛋白4种不同提取方法,结果见表2。
由表2筛选结果可知,方法2葛根蛋白提取率明显高于其它方法,其原因可能是碱提酸沉法重现性好,有机溶剂易使蛋白失活[14],盐析法提取蛋白不充分[15],故选择方法2作为葛根蛋白提取优选工艺。

表2 葛根蛋白不同提取工艺比较研究Table 2 Comparison of different extraction methods of Pueraria lobata protein
2.3 单因素试验结果与分析
2.3.1 温度对提取率的影响
温度对提取率的影响如图2所示。
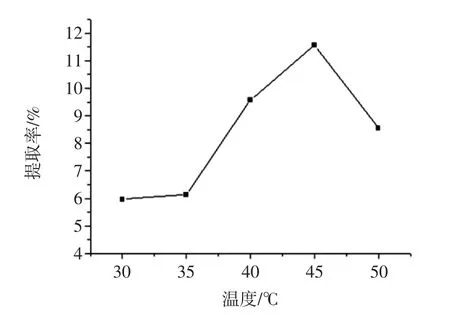
图2 温度对葛根蛋白提取率的影响Fig.2 Effect of extraction temperature on extraction rate of Pueraria lobata protein
随着温度升高,葛根蛋白提取率随之增加,当温度为45℃时,葛根蛋白提取率达到最大值。而温度继续升高,曲线呈下降趋势,主要原因是温度过低时蛋白不能充分溶解在提取溶剂中,而温度过高又极易引起蛋白质的变性[16]。
2.3.2 提取时间对提取率的影响
提取时间对提取率的影响如图3所示。
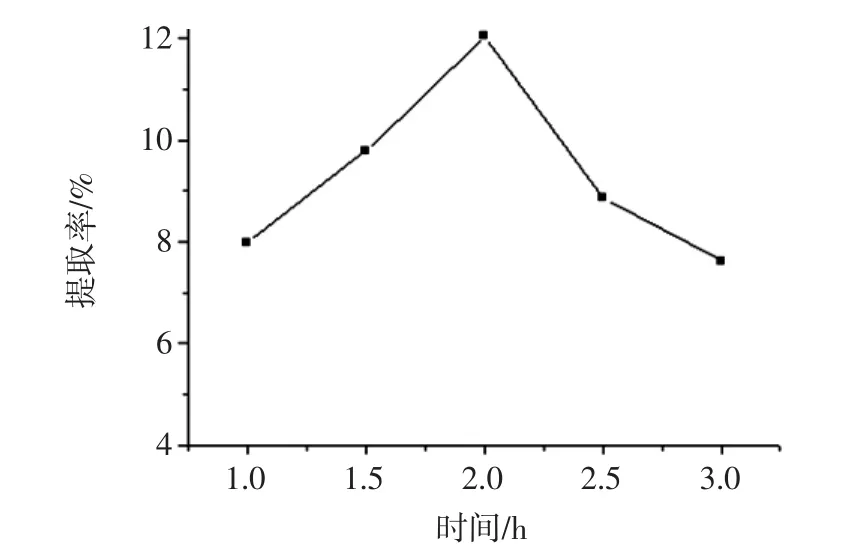
图3 提取时间对葛根蛋白提取率的影响Fig.3 Effect of extraction time on extraction rate of Pueraria lobata protein
葛根蛋白提取率随着提取时间延长,呈先增加后降低的趋势。主要原因是提取时间延长,能促进颗粒胞膜的破裂,有利于蛋白质的析出。
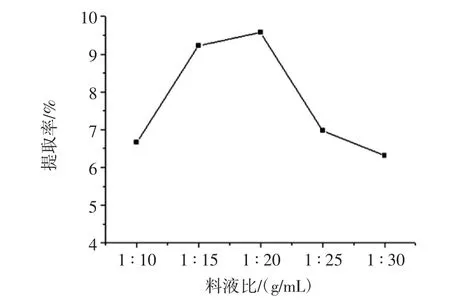
图4 料液比对葛根蛋白提取率的影响Fig.4 Effect of material liquid ratio on extraction rate of Pueraria lobata protein
2.3.3 料液比对提取率的影响
料液比对提取率影响结果如图4。
在溶剂体积较小时,葛根药材提取不完全,导致蛋白提取率低。当料液比为1∶20(g/mL)时,葛根药材能够充分溶解,蛋白提取率达到最大值。
2.4 响应面优化试验结果与分析
2.4.1 回归模型的建立与数据分析
根据单因素试验结果,以葛根蛋白提取率为评价指标,对提取温度(A)、提取时间(B)和液料比(C)进行三因素三水平响应面优化设计,结果见表3。
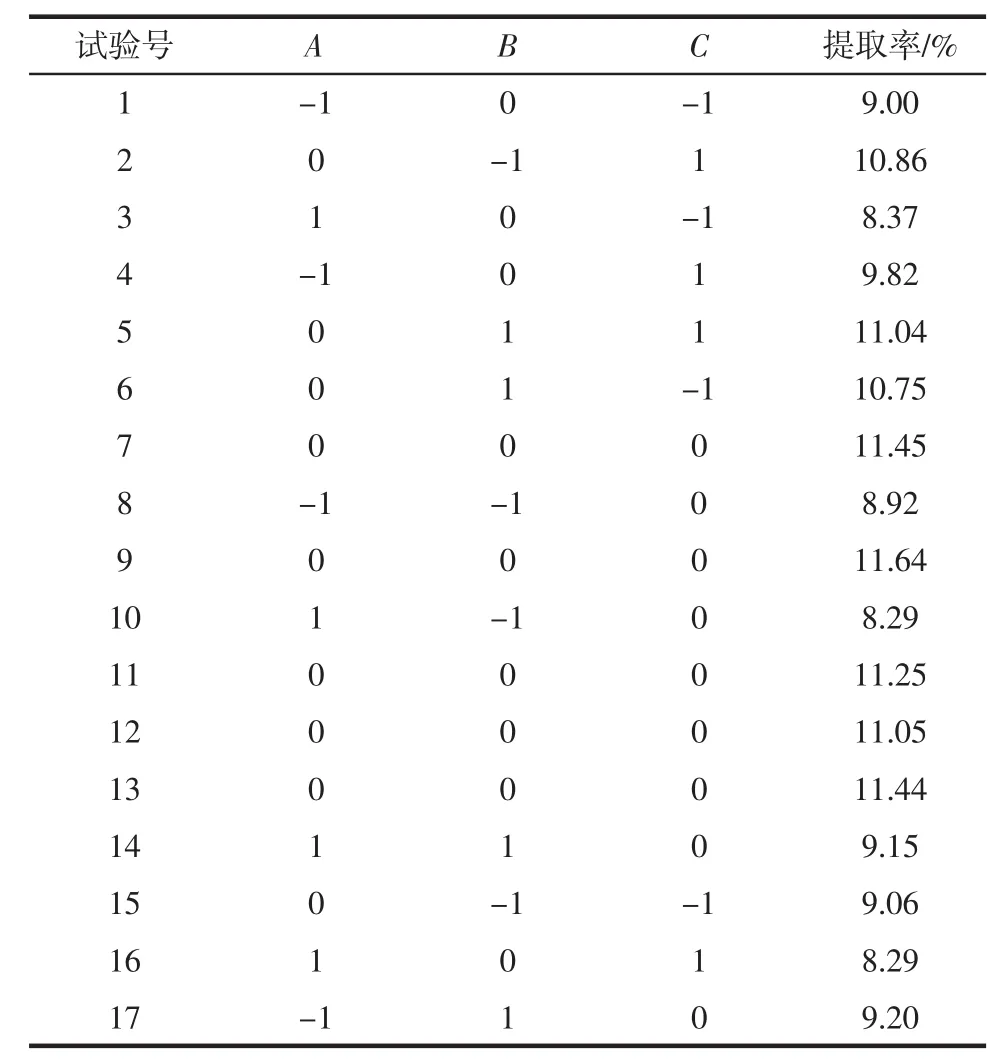
表3 响应面试验设计与结果Table 3 Experimental design and corresponding results for response surface analysis
通过Design-Expert V8.0.6软件对表3数据进行多元回归拟合,得到二次多元回归方程:Y=-172.65+7.03A+9.26B+1.59C+0.06AB-6.68AC-0.17BC-0.08A2-1.92B2-0.02C2。对试验数据模型进行方差分析,结果见表4。
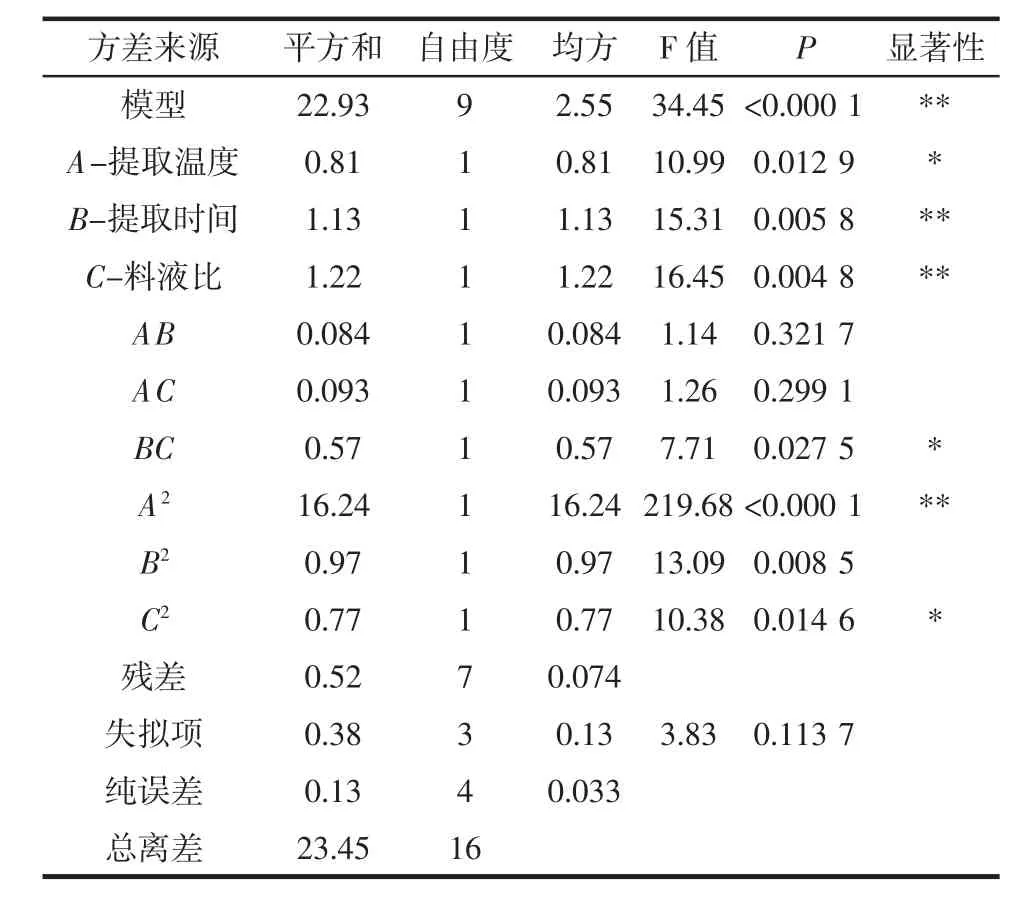
表4 响应面二次回归方程模型方差分析结果Table 4 The results of quadratic regression model for response surface
由方差分析结果可知,模型F值为34.45,P<0.000 1,表明该模型差异极显著;失拟项P=0.113 7>0.05,表明失拟项不显著,即模型与试验的差异较小,可以说明其它因素对试验结果的干扰较小,残差是由随机误差引起的,能充分反映各因素和响应值之间的关系;模型的相关系数R2=0.999 7,说明试验数据与回归模型拟合度良好,因此该模型可用来分析葛根蛋白提取工艺条件。
对模型进行回归方程系数显著性检验,A、BC、C2对提取率的作用显著(P<0.05),B、C、A2对提取率作用极显著(P<0.01)。比较F值大小可知影响提取率的主次顺序为:料液比>提取时间>提取温度。
2.4.2 响应面各因素交互作用分析
运用Design-Expert V8.0.6软件,分析响应面优化试验结果,得到响应面曲面图,该图形能直观地反映各因素及其交互作用对响应值的影响。试验结果见图5。
由图5可知,提取温度和提取时间的等高线呈椭圆形,响应面较陡,随着提取温度和提取时间的增加,提取率逐渐增高并达到极值,之后缓慢下降,表明二者交互作用较为显著;提取时间与料液比的等高线密集,响应面曲线陡峭,随着提取时间与溶剂体积的增加,提取率越来越高,达到极值后逐渐下降,表明两者之间交互作用显著;提取温度与溶剂体积的等高线密集,响应面曲线陡峭,随着提取温度与溶剂体积的增加,提取率越来越高,达到极值后逐渐下降,表明两者之间交互作用极显著。
通过对回归模型方程求解,得出葛根蛋白最佳提取工艺为:提取温度47.06℃,提取时间2.18 h,料液比1∶21.50(g/mL),提取率为 11.99%。
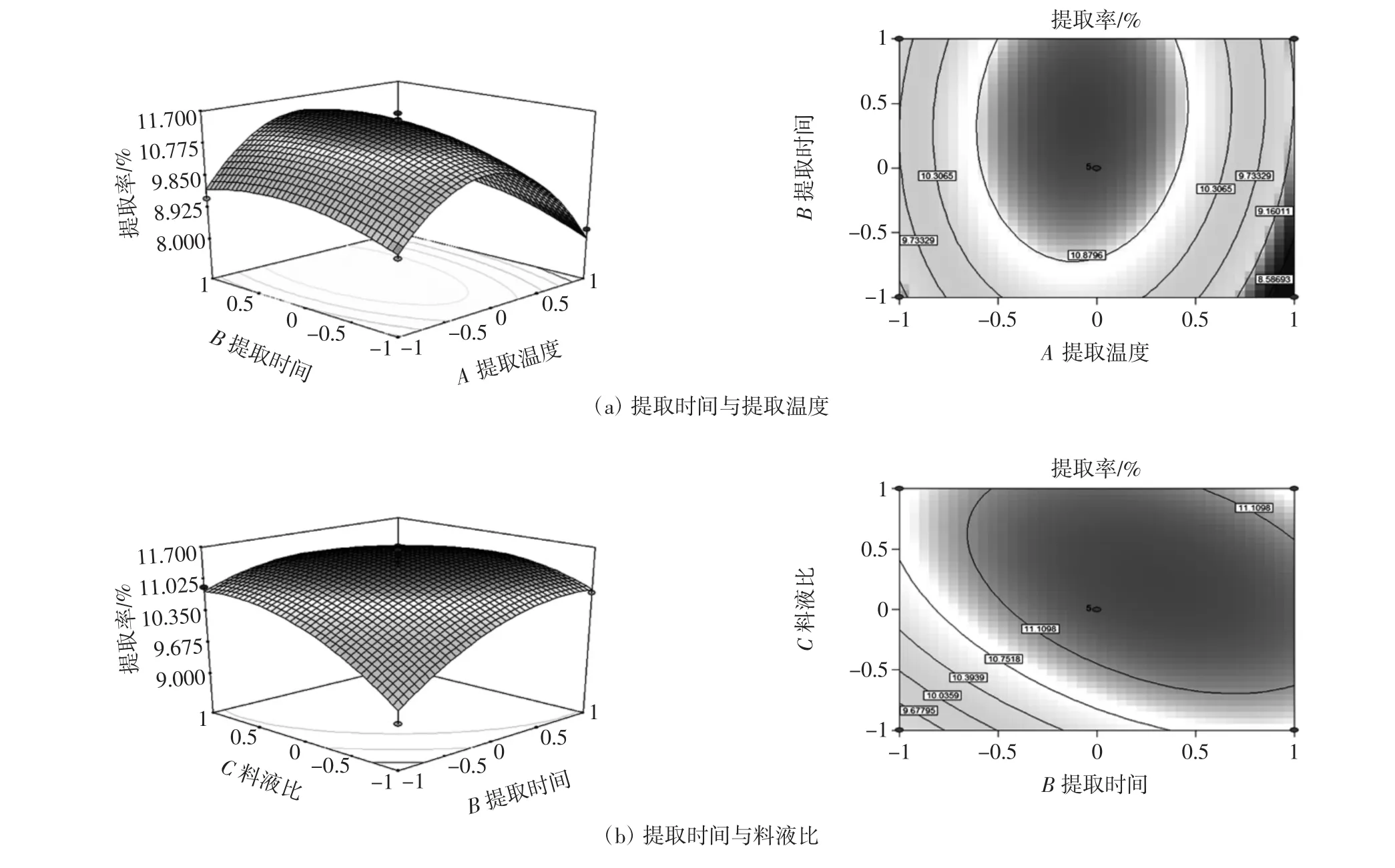
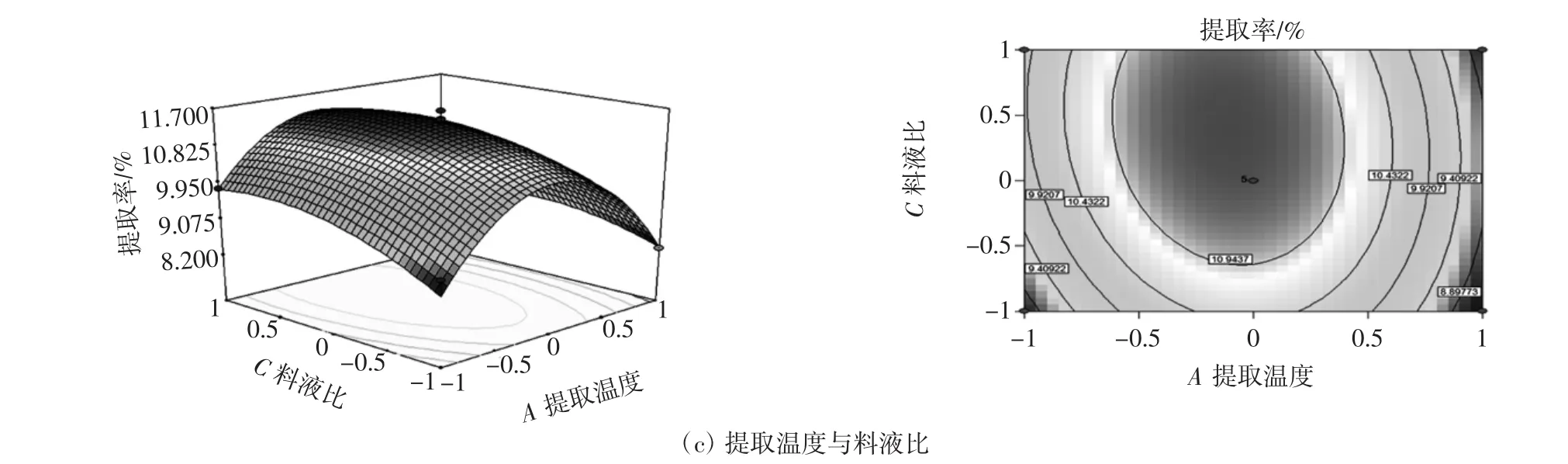
图5 响应面与等高线分析图Fig.5 Response surface and contour analysis diagram
2.4.3 验证试验
考虑实际情况,将响应面法优化的最佳提取工艺条件参数修正为:提取温度45℃,提取时间2 h,料液比为1∶20(g/mL)。并对修正后的工艺参数进行3次验证试验,得到葛根蛋白平均提取率为11.73%,与预测值相近。在此条件下,葛根蛋白含量可达到60.18%。说明模型能较好地预测葛根蛋白的提取率,优化得到的工艺参数准确可靠。
2.5 SDS-PAGE结果
通过优选工艺得到的葛根蛋白的SDS-PAGE结果见图6。
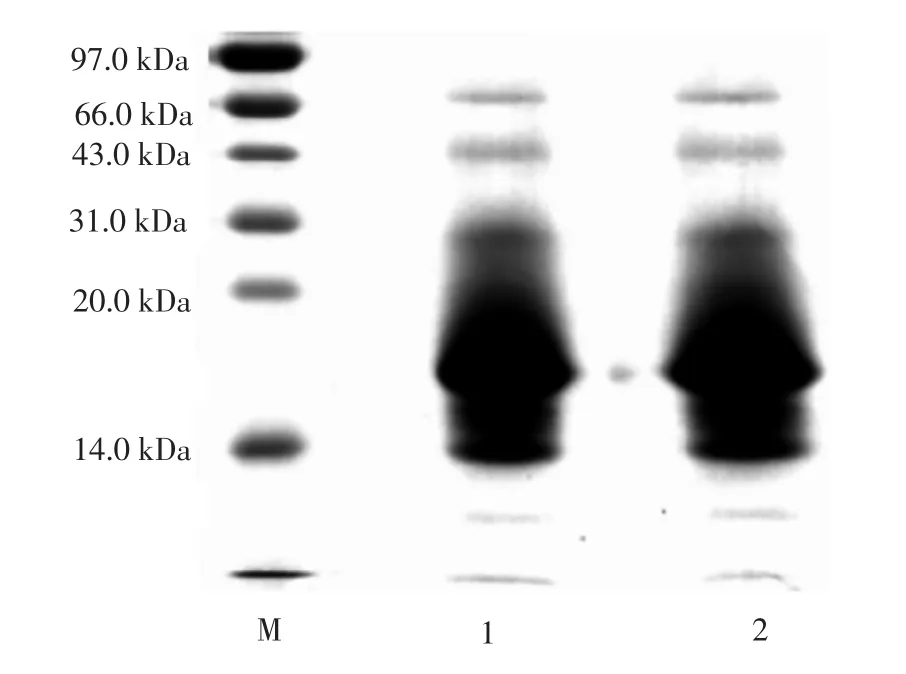
图6 葛根蛋白SDS-PAGE图Fig.6 SDS-PAGE of Pueraria lobata protein
由图6可知,通过碱提酸沉法提取的两批葛根蛋白样品分子量主要集中在14.0 kDa ~43.0 kDa。
2.6 葛根蛋白体外抗氧化试验结果
葛根蛋白的体外抗氧化活性结果见图7。
由图7(a)可知,在0.02 mg/mL ~0.8 mg/mL范围内,葛根蛋白DPPH自由基清除能力随着浓度的增大而增强,当其浓度达到0.8 mg/mL时,DPPH自由基清除率高达51.15%,但清除效果弱于阳性对照组VC,计算得到葛根蛋白清除DPPH自由基的IC50值为0.78 mg/mL。
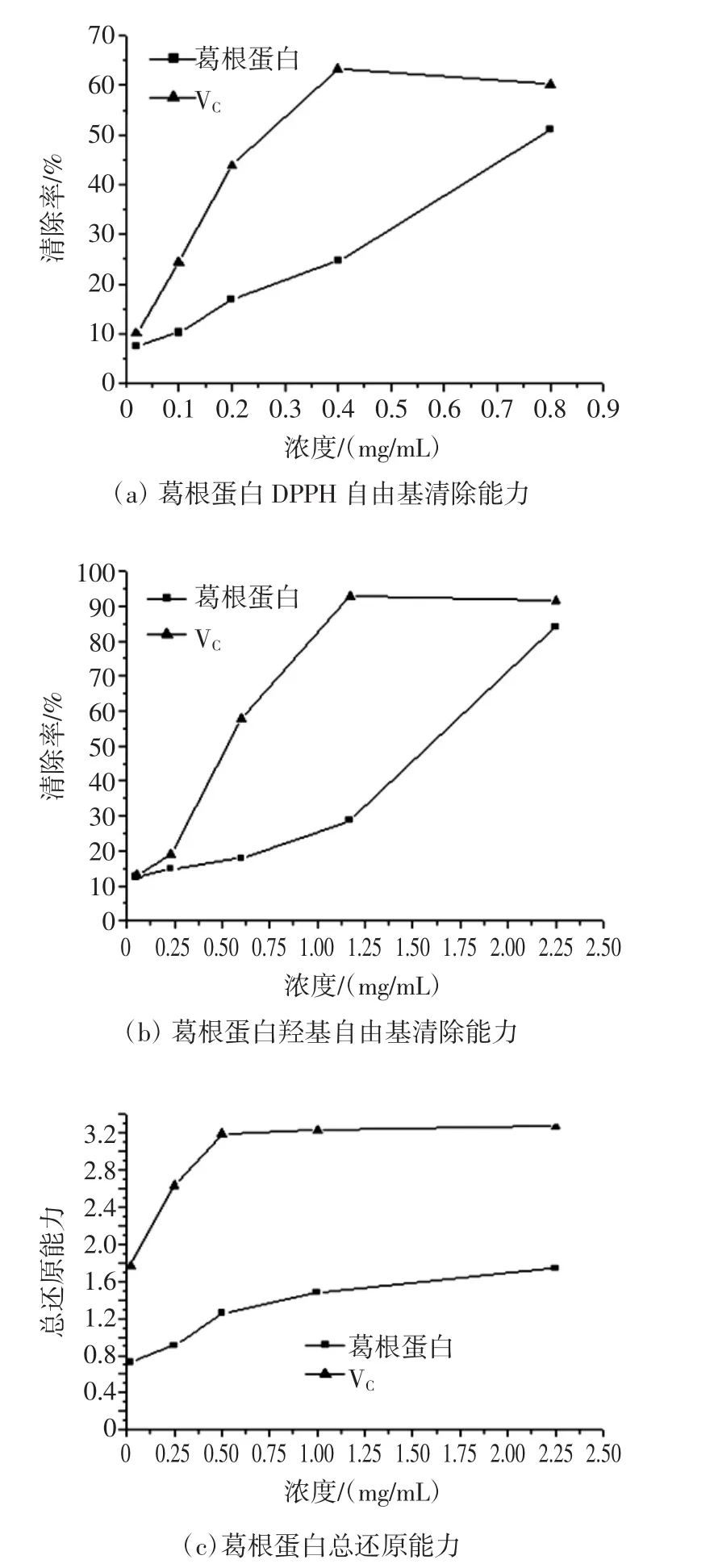
图7 不同评价方法测定葛根蛋白抗氧化活性Fig.7 Determination of antioxidant activity of Pueraria lobata protein by different evaluation methods
由图7(b)可知,葛根蛋白对羟基自由基的清除能力在0.05 mg/mL至2.25 mg/mL的浓度范围内随着浓度的增大而增强,呈现较为明显的量效关系,当其浓度达到2.25 mg/mL时,羟基自由基清除率达到88.62%,清除能力与2.25 mg/mL VC相当。通过计算可知葛根蛋白清除羟基自由基的IC50值为1.89 mg/mL。
亚铁氰化钾在酸性条件下与铁离子反应生成有色物质,在700 nm处总还原能力随着溶液浓度变大,其吸光度值变大,则总还原能力越强。由图7(c)可知,葛根蛋白的总还原能力虽然也随着浓度的增大而增加,表明葛根蛋白具有一定还原能力,并呈现一定的量效关系,但与阳性对照组VC相比,其还原能力较弱。
3 结论
本文在单因素试验的基础上,通过Box-Behnken响应面试验设计,得到葛根蛋白最佳提取工艺为:提取温度 45℃,提取时间 2 h,料液比 1∶20(g/mL)。在此条件下进行验证试验,葛根蛋白提取率为11.73%。葛根蛋白的SDS-PAGE结果表明,葛根蛋白分子量主要分布在14.0 kDa ~43.0 kDa。此外,通过体外抗氧化试验充分证明了葛根蛋白具有较强的DPPH自由基和羟基自由基清除能力,同时葛根蛋白还具有一定的还原能力。本研究可为葛根蛋白的深度开发提供一定的理论依据。

