Xpert MTB/RIF检测结核分枝杆菌和利福平耐药的临床应用
张建平 李红燕 王大望 刘莎莉 马艳侠
结核分枝杆菌复合群(M.tuberculosiscomplex,MTB)共包括人型、牛型、非洲型和田鼠型,对大多数抗结核药物的自然耐受性相近,临床上结核病的病原菌多为人型结核分枝杆菌和牛分枝杆菌。结核病是一种严重危害人民健康的慢性传染病,我国是结核病高负荷国家,耐药情况严重,在结核病防控工作中结核菌检查对于发现传染源、确定诊断和化疗方案、考核疗效、评价防治效果具有重要意义[1]。结核菌的实验室检验技术涵盖病原学检测、免疫学检测、分子生物学检测及生物化学检测。包括痰涂片镜检、结核分枝杆菌培养、结核抗体、γ-干扰素释放试验/T-Sport,分枝杆菌核酸检测(TB-NTM-PCR)等[2]。痰涂片镜检阳性率低,传统的罗氏培养法及药敏试验检出结果时间长,不能满足临床需要,而肺外标本采用传统方法诊断较为困难,涂阴培阴的结核患者占73.6%,因此迫切需要能快速、准确检测结核分枝杆菌及其耐药性的诊断技术。近年来随着分子生物学技术的发展,分枝杆菌核酸PCR、实时荧光RNA 恒温扩增检测(SAT)、Xpert 结核分枝杆菌/利福平快速分子鉴定(Mycobaeterium tuberculosis/Rifampicin,MTB/RIF)、线性探针、基因芯片等新的检验方法也不断应用于临床[3]。本研究对肺结核病患者的痰标本分别采用直接涂片抗酸染色(Z-N 法)、结核杆菌MGIT 液体培养、Xpert MTB/RIF方法进行检测,现分析报告如下。
1 对象与方法
1.1 研究对象
选取2018年1月至2018年9月在本院传染病院住院的确诊肺结核病患者116 例,纳入标准:参照WS 288-2017 肺结核诊断标准[4],依据临床表现、胸部影像学及实验室检查。其中结核杆菌MGIT液体培养阳性72 例,男51 例,女21 例,年龄16~90岁,平均年龄50.6 岁,男女性别比2.43∶1。培养阴性44 例,男31 例,女13 例,年龄21~88 岁,平均年龄49.5 岁,男女性别比2.38∶1。排除标准:影像学及实验室检查均排除非结核分枝杆菌肺病及其它肺部疾病。实验采用研究对象的痰标本,研究经过医院伦理委员会同意,免于签署患者知情同意书。
1.2 标本采集
收集3 份痰标本(当日即时痰、夜间痰和次日晨痰)。患者用清水漱口后,深吸气2~3 次,每次用力呼出,从肺部深处咳出第2、3 口痰液收集于样本容器,拧紧盒盖送检。对当日不能检测的痰标本置于4℃冰箱保存,不超过12 h,要求标本量一般3~5 mL,标本采集前均未使用抗结核药物治疗[4]。
1.3 仪器与试剂
采用全自动医用PCR 分析系统(美国Cepheid公司,型号:GeneXpert)、全自动分支杆菌培养监测仪(美国BD 公司,型号:BACTEC MGITTM320)、生物显微镜(德国Leica 公司,型号:MD1000)。Xpert MTB/RIF 检测试剂盒(美国Cepheid 公司)、BBLTMMGITTM培养管(美国BD 公司)、分枝杆菌联合药敏试剂盒(美国BD 公司)、抗酸染色试剂盒(珠海贝索公司)。
1.4 检测方法
1.4.1 直接涂片抗酸染色
对3 份痰标本采用萋尼染色法(Z-N 法),参照WS 288-2017 肺结核诊断、《中国结核病防治规划。痰涂片镜检标准化操作及质量保证手册》进行标准化操作及质量控制,涂片阳性结果定义为至少两份标本判断为阳性[4-5]。
1.4.2 MGIT 液体培养
对3 份混合痰标本用2% N-乙酰-L-半胱氨酸-NaOH 进行处理,将处理后的标本接种于含营养添加剂及抑制剂的MGIT 液体培养管,放入BACTEC MGITTM320 仪器自动检测,通过分析荧光强度判断是否有结核MTB 生长,一般快速7~14 d 培养阳性,培养周期设定42 d。
1.4.3 MGIT 联合药敏试验
使用MGIT 阳性1 天的悬浮培养液,按照药敏试剂盒接种程序操作,4~13 d 内通过分离菌株在含药培养管和生长对照管的对比确定药物敏感性结果。
1.4.4 Xpert MTB/RIF 技术
取1 mL 混合痰标本加入2 mL 样本处理液,按照操作规程将处理后的样本加入检测盒,置于GeneXpert 检测模块自动检测。该技术采用巢式实时荧光定量PCR,针对结核分枝杆菌rpoB基因81 bp 利福平耐药核心区(rifampin resistance determining region,RRDR)设计引物、探针,检测其是否突变。
1.5 统计学分析
采用SPSS 20.0 统计分析,计数资料以n(%)表示,组间比较采用Pearson 卡方检验,采用McNemar 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 3 种检测方法阳性率比较
3 种检测方法阳性率比较,差异有统计学意义(P<0.05)。见表1。

表1 3 种检测方法阳性率比较[n(%)]Table 1 Comparison of positive rate of 3 methods[n(%)]
2.2 MGIT 液体培养与Xpert MTB 结果比较
MGIT 液体培养与Xpert MTB 结果比较,差异无统计学意义(P>0.05)。以临床确诊为诊断标准,Xpert 法灵敏度90.3%,特异度77.3%,阳性预测值86.7%,阴性预测值82.9%,Youden 指数0.676,总符合率85.3%。见表2。

表2 MGIT 液体培养与Xpert MTB 结果比较[n(%)]Table 2 MGIT liquid culture and XPERT MTB results comparison[n(%)]
2.3 Xpert MTB 与Z-N 法结果比较
Xpert MTB 与Z-N 法结果比较,差异有统计学意义(P<0.05)。见表3。

表3 Xpert MTB 与Z-N 法结果比较[n(%)]Table 3 Xpert MTB and Z-N results comparison[n(%)]
2.4 Xpert MTB/RIF rpoB 基因检测结果
75 例Xpert MTB/RIFrpoB基因检测结果分析,66 例Xpert MTB/RIFrpoB基因未检出突变,即未检测到RIF 耐药,与MGIT 联合药敏试验利福平敏感结果一致,9 例Xpert MTB/RIFrpoB基因突变被检出,为RIF 耐药,而药敏试验为利福平敏感,总符合率88.0%(66/75)。见表4。
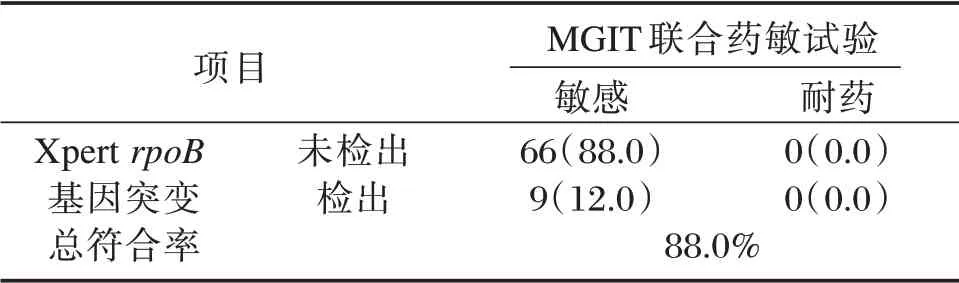
表4 Xpert 利福平rpoB 基因检测结果[n(%)]Table 4 The results of Xpert rpoB gene[n(%)]
3 讨论
结核杆菌耐药表型及耐药基因型关系的确立,为基于利福平耐药基因rpoB突变为靶点的诊断奠定了基础[6]。Xpert MTB/RIF 以5 条引物探针选择性覆盖结核分枝杆菌特有的序列rpoB基因81 bp 上RRDR,第6 条探针用做内部质量控制,以检测标本是否含有结核分枝杆菌复合群(MTB)以及利福平是否耐药[7]。
WHO 推荐Xpert MTB/RIF 对成人疑似多重耐药结核或HIV 相关肺结核初筛诊断,Xpert MTB/RIF 检测结核分枝杆菌灵敏度高[8]。据报道,抗酸染色法通常需5 000 CFU/mL 才能得到阳性结果,而Xpert MTB/RIF 方法的检测限(LoD)为131 CFU/mL,尤其在MTB DNA 低拷贝时,抗酸染色法往往是阴性结果。本研究显示,痰直接涂片抗酸染色法的阳性率远远低于Xpert MTB 与MGIT液体培养阳性率,而Xpert MTB 与MGIT 液体培养阳性率接近。直接痰涂片阳性率低,容易漏检,也和未采用浓缩集菌法涂片、荧光染色镜检以及与工作人员的涂片质量和阅片技能有一定关系[9]。
国外有报道,Xpert MTB/RIF 试验在痰涂片阳性的标本中,其敏感性接近100%,本文的研究结果与其一致[10]。文献报道,传统罗氏培养阳性率为44.5%,培养时间约6~8 周,MGIT 液体培养阳性率为62.1%,7~14 天培养阳性,较罗氏培养阳性率提高,且培养时间缩短,但对生物安全级别要求高,在基层难以开展[11]。而Xpert MTB/RIF方法整个流程仅需2 h,手工只需处理样本即上机自动检测。本文研究结果表明Xpert MTB/RIF检测具有同液体培养及药敏试验接近的临床应用价值,提示可以用Xpert MTB/RIF 对疑似耐药结核进行初筛[12]。
除了痰标本外,Xpert MTB/RIF 还可以检测灌洗液、胸腹水、引流液、脑脊液标本,据研究报道,阳性率依次为灌洗液65.9%、痰样本53.9%、胸水16.4%,特异性均较高[13]。Xpert MTB/RIF 检出rpoB 阳性基因型耐药高于药敏试验表型耐药结果,大多数原因是标本中存在异质性利福平耐药,与某些基因位点突变的低水平耐药相关,也可能存在Xpert MTB/RIF 检测的假耐药,可能与沉默子突变或Xpert MTB/RIF 检测系统判读错误有关,对不一致菌株应进行rpoB 耐药基因核心区间测序[14]。另外,Xpert MTB/RIF 系统不能区分是否活性结核分枝杆菌,不能被用于监测治疗或复发[15]。综上,Xpert MTB/RIF 是一种结核病快速诊断的新方法,具有快速、简便、准确、对生物安全要求不高等特点,可以在基层开展,能同时检测出结核分枝杆菌及是否对利福平耐药,对肺结核及肺外结核病的早期诊断具有重要意义,是痰涂片镜检及培养检查方法的有力补充。