肠道菌群紊乱在大鼠非酒精性脂肪肝中的作用机制
耿妍 鲁晓岚 耿燕 史海涛
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是指除酒精和其他明确肝损伤因素外所致的,以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征[1]。随着“全球肥胖”的流行,NAFLD 在中国及欧美发达国家的患病率逐年升高,该病目前已被公认为是成人及儿童慢性肝脏疾病的首要病因[2]。NAFLD 作为一种复杂的疾病,病理生理机制尚未完全阐明,其发生发展的主要危险因素包括肥胖、胰岛素抵抗、2 型糖尿病、高脂血症等[3]。因此,探究单纯性肥胖引起NAFLD 的发病机制,对于了解从单纯性肥胖(Simple Obesity,SO)进展为NAFLD 这一过程至关重要。近年来,多项研究发现肠道菌群作为一个新的环境因素在肥胖和NAFLD 的发生中发挥重要作用[4-5]。目前肠道菌群在肥胖转化为NAFLD 的作用及机制研究较少,本研究将探讨肠道菌群在肥胖及NAFLD的作用,以期为肥胖及NAFLD 的防治提供新的理论依据。
1 材料与方法
1.1 材料与试剂
SD 雄性大鼠[动物合格证号:skxk(shaan)2018-001]购自西安交通大学医学院动物实验中心。内毒素检测试剂盒购自北京金山川科技发展有限公司。粪便总DNA 提取试剂盒购自北京艾德莱试剂有限公司。实时定量PCR 反应试剂盒购自日本TaKaRa 公司。ELISA 试剂盒购自上海源叶生物科技有限公司。全自动生化分析仪购自日本OLYMPUS 公司。
1.2 实验动物
8 周龄雄性SD 大鼠30 只(SPF 级),平均体重160 g 左右,分笼饲养于西安交通大学医学院动物实验中心(动物实验条件符合二级标准)。高脂饲料配方:10%猪油、2%胆固醇、5%蔗糖、0.5%猪胆盐、82.5%基础饲料;普通饲料购自西安交通大学医学院动物实验中心。
1.3 实验方法
1.3.1 实验分组
将30 只大鼠随机分为对照组(NC 组)(普通饲料,n=6)、模型组(高脂饲料,n=24)。分别给予普通饲料及高脂饲料喂养8 周。于8 周末处死所有大鼠,行肝脏苏木精伊红(Hematoxylin and Eosin,HE)染色,光镜下观察筛选模型组中发生脂肪变的为NAFLD 组(n=12),未发生脂肪变的为SO 组(n=12)。
1.3.2 血清生化指标检测
全自动生化分析仪检测血清:胆固醇(Total cholesterol,TC)、甘油三酯(Triglyceride,TG)、谷丙转氨酶(Alanine transaminase,ALT)、谷草转氨酶(Aspartate Aminotransferase,AST)。
1.3.3 动态比浊法测定血清内毒素
按照内毒素检测试剂盒的说明书操作。
1.3.4 肝脏组织及回肠粘膜HE 染色
分别取各组大鼠肝脏及回肠组织(距回盲瓣7~17 cm),置于4%的多聚甲醛溶液中,常规制成石蜡切片,行HE 染色。
1.3.5 肠道粪便中乳酸杆菌属、大肠杆菌属、双歧杆菌属的测定
严格按照北京艾德莱试剂粪便总DNA 提取试剂盒及日本TaKaRa 公司荧光实时PCR 反应试剂盒操作。以DNA 为模板,PCR 扩增大肠杆菌属,乳酸杆菌属,双歧杆菌属,标准品为内参。引物见表1[6]。

表1 相关引物信息Table 1 Related primer information
1.4 统计学方法
采用SPSS 22.0 软件进行数据分析。计量资料以(±s)表示,多组间比较采用单因素方差分析,差异有统计学意义者两组间比较采用LDL-t检验。粪便细菌定量结果数据以logx±s表示。采用Pearson相关分析和Spearman 秩相关分析自变量和因变量之间的相关性。以P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠一般状况、体重及饮食变化
实验过程中,各组大鼠均无死亡。喂养至第8周时,NC 组大鼠皮毛光泽,反应灵敏。SO 组及NAFLD 组大鼠皮毛暗淡无光泽,活动减少,精神萎靡,进食量较多。喂养至第4、8 周时模型组大鼠体重明显高于NC 组大鼠,差异具有统计学意义(P<0.05),而SO 组与NAFLD 组体重比较差异无统计学意义(P>0.05)。见表2。
2.2 肝脏病理变化
光镜下可见NC 组大鼠肝细胞呈条索状排列,围绕中央静脉呈放射状,核圆、大、居中。SO 组大鼠肝细胞排列整齐,无脂滴及炎症细胞浸润。NAFLD 组大鼠肝细胞排列整齐,可见散在小泡性脂滴浸润,无明显炎症细胞及坏死。见图1。
表2 各组大鼠体重变化(±s,g)Table 2 Weight change in each group(±s,g)
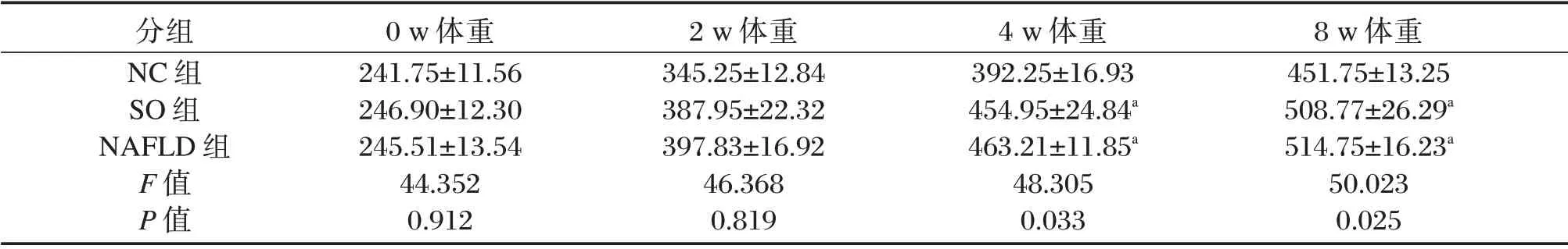
表2 各组大鼠体重变化(±s,g)Table 2 Weight change in each group(±s,g)
注:与NC 组比较,aP<0.05。
分组NC 组SO 组NAFLD 组F 值P 值0 w 体重241.75±11.56 246.90±12.30 245.51±13.54 44.352 0.912 2 w 体重345.25±12.84 387.95±22.32 397.83±16.92 46.368 0.819 4 w 体重392.25±16.93 454.95±24.84a 463.21±11.85a 48.305 0.033 8 w 体重451.75±13.25 508.77±26.29a 514.75±16.23a 50.023 0.025

图1 各组大鼠肝脏病理改变(HE,×400)Figure 1 Pathological changes of liver of rats in each group(HE,×400)
2.3 各组大鼠血清转氨酶、内毒素、血脂比较
SO 组及NAFLD 组大鼠血清ET、TG 水平显著高于NC 组,差异具有统计学意义(P<0.05)。SO组TC 水平显著高于NC 组,差异具有统计学意义(P<0.05)。NAFLD 组ET 水平显著高于SO 组,差异具有统计学意义(P<0.05)。3 组间ALT、AST 水平比较差异无统计学意义(P>0.05)。NAFLD 组与余两组TC 水平比较差异无统计学意义(P>0.05),NAFLD 与SO 组TG 水平比较差异无统计学意义(P>0.05)。见表3。
2.4 各组大鼠肠道菌群的变化
模型组肠道粪便大肠杆菌属数量显著高于NC 组,差异具有统计学意义(P<0.05)。NAFLD 组大肠杆菌属数量显著高于SO 组,差异具有统计学意义(P<0.05)。模型组双歧杆菌属、乳酸杆菌属数量显著低于NC 组,差异具有统计学意义(P<0.05)。NAFLD 组双歧杆菌属数量显著低于SO组,差异具有统计学意义(P<0.05)。SO 组与NAFLD 组乳酸杆菌数量相比较差异无统计学意义(P>0.05)。见表4。
2.5 肠道病理改变
光镜下可见NC 组小肠粘膜表面微绒毛排列整齐,结构清晰。SO 组小肠上皮细胞肿胀,细胞游离面微绒毛短小,排列紊乱,黏膜层可见少许炎性细胞浸润,伴灶性糜烂。NAFLD 组小肠粘膜上皮细胞肿胀,结构明显紊乱,细胞游离面微绒毛短小,黏膜层可见大量炎性细胞浸润,伴灶性糜烂。见图2。
表3 三组大鼠血清转氨酶、内毒素、血脂的比较(±s)Table 3 Comparison of serum transaminase and endotoxin of 3 group(±s)
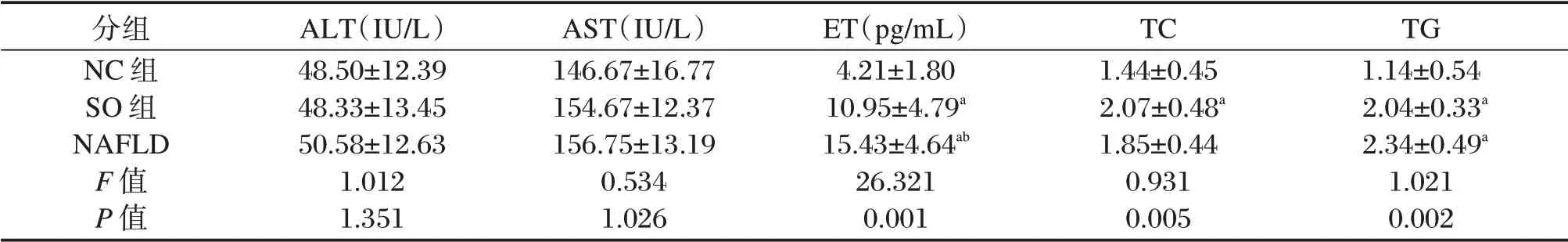
表3 三组大鼠血清转氨酶、内毒素、血脂的比较(±s)Table 3 Comparison of serum transaminase and endotoxin of 3 group(±s)
注:与NC 组比较,aP<0.05,与SO 组比较,bP<0.05。
分组NC 组SO 组NAFLD F 值P 值ALT(IU/L)48.50±12.39 48.33±13.45 50.58±12.63 1.012 1.351 AST(IU/L)146.67±16.77 154.67±12.37 156.75±13.19 0.534 1.026 ET(pg/mL)4.21±1.80 10.95±4.79a 15.43±4.64ab 26.321 0.001 TC 1.44±0.45 2.07±0.48a 1.85±0.44 0.931 0.005 TG 1.14±0.54 2.04±0.33a 2.34±0.49a 1.021 0.002
表4 各组大鼠肠道菌群结果比较(±s)Table 4 The results of intestinal flora in rats were compared(±s)

表4 各组大鼠肠道菌群结果比较(±s)Table 4 The results of intestinal flora in rats were compared(±s)
注:与NC 组比较,aP<0.05,与SO 组比较,bP<0.05。
分组NC 组SO 组NAFLD 组F 值P 值大肠杆菌属8.41±0.96 8.99±0.49a 9.54±0.69ab 15.362 0.000双歧杆菌属9.23±0.65 8.65±0.33a 8.36±0.57ab 19.821 0.000乳酸杆菌属8.38±0.72 7.76±0.47a 7.33±0.49a 18.365 0.021
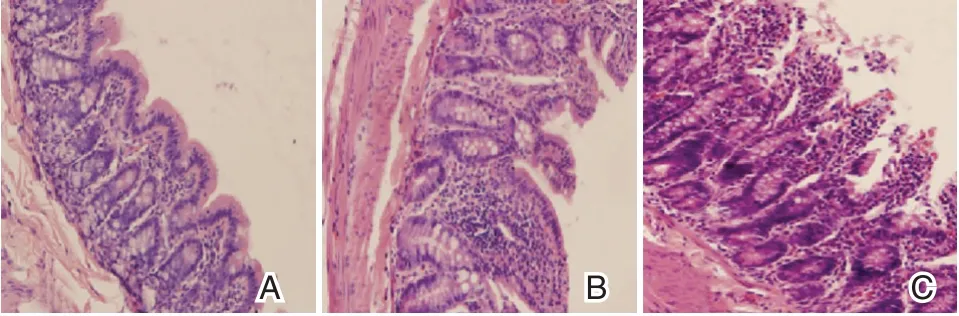
图2 各组大鼠小肠粘膜病理改变(HE,×400)Figure 2 Pathological changes of small intestinal mucosa of rats in each group(HE,×400)
2.6 肠道菌群与内毒素、转氨酶的相关性分析
Pearson 相关分析及Spearman 秩相关分析表明,大肠杆菌与ET、肝脏脂肪变程度均呈正相关(P<0.05),乳酸杆菌、双歧杆菌与ET、肝脏脂肪变均呈负相关(P<0.05)。见表5。
3 讨论
肥胖是导致NAFLD 的重要危险因素,有研究表明在重度肥胖人群中NAFLD 的发病率可达90%[7]。从肥胖到NAFLD 的发生发展有多种机制参与,其中肠道菌群的构成紊乱可能是重要的组成部分。本研究通过高脂饮食的饲养诱导大鼠肥胖模型,观察到高脂饮食可以诱发大鼠肠道菌群紊乱以及NAFLD 的出现。
陈杏云等[8]通过高脂饲料喂养小鼠8 周后,发现小鼠肠道菌群结构发生了明显变化,这与本实验研究结果一致。分析高脂饮食对于肠道菌群构成影响的机制,已有的研究结果表明,高脂饲料可以使肠道中作为菌群养料来源的碳水化合物的生成减少,同时高脂饮食代谢的部分产物可以破坏肠道菌群所在的微环境,从而影响肠道菌群的组成平衡,导致机体肠道菌群的紊乱[9]。
肠道菌群可以通过多种机制影响肥胖。首先,肠道菌群可以影响机体的能量平衡。Bäckhed等[10]的研究发现肥胖小鼠的肠道菌群酵解碳水化合物的能力增强,因此为宿主提供的能量增多,促进肥胖。其次,肠道菌群失调可破坏肠道上皮屏障,增加肠道的通透性,使得血清内毒素含量增多,这种肠源性内毒素水平的升高可以导致慢性炎症的形成,进而导致肥胖[11]。
肠道菌群紊乱既可以通过促进肥胖间接地影响NAFLD,也可以通过多种通路直接促进NAFLD。例如,针对NAFLD 的研究表明肠道菌群通过改变肠道对胆碱和胆汁酸的代谢,产生丙酸、丁酸等短链脂肪酸及禁食诱导脂肪因子等,从而影响NAFLD 的发病[12]。另一方面,前述的血清内毒素可经由门静脉进入肝脏,诱导肝细胞产生肿瘤坏死因子、白细胞介素-1、白细胞介素-6 等炎性细胞因子,促进NAFLD 的发病[13-14]。本研究发现NC 组到SO 组,再到NAFLD 组,大肠杆菌属计数显著增加,而优势菌显著减少,肠道粘膜结构由轻到重均有破坏,肠源性内毒素水平逐渐增高,这与之前研究是一致的[15]。行相关性检验发现,大鼠肠道菌群失调与内毒素及脂肪肝病变程度呈正相关。研究结果提示肠道菌群紊乱在脂肪蓄积及从SO 向NAFLD 进展过程中均发挥重要作用。
从治疗的角度来说,有研究显示双歧杆菌可改善肠道屏障功能并降低血清内毒素水平,从而减缓NAFLD 的进展[16]。另外,对肥胖患者采取饮食干预能够使产生内毒素的肠道菌种类比例明显下降[17]。

表5 肠道菌群与内毒素、肝脂肪变程度的相关性分析Table 5 Correlation analysis of intestinal flora with endotoxin and liver fat change
综上所述,肠道菌群可通过多种途径和机制影响NAFLD 的发病。通过优化肠道菌群构成,针对NAFLD 的靶向治疗在动物模型中获得一定疗效,但迄今为止相关的临床研究不足。随着现代生物技术的进步,调节肠道菌群或可成为治疗NAFLD的新方式。

