水貂源致病性大肠杆菌对喹诺酮类药物耐药表型与耐药基因型检测与分析
郭家媚 葛 成 张文斌 吴同垒张志强 贾青辉 张召兴,2* 张艳英*
(1.河北科技师范学院,河北省预防兽医学重点实验室,昌黎,066600;2.河北旅游职业学院,承德,067000)
水貂大肠杆菌(Escherichiacoli)病是水貂养殖中主要的细菌性传染病之一,该病对不同阶段的水貂均有易感性,尤其对40—60日龄的幼貂最易感,可以引起幼貂的急性败血型、肺炎、肠炎及神经症状等一系列疾病,发病率和死亡率均较高,还可以导致妊娠母貂的死胎、流产,给水貂养殖业造成严重的经济损失[1-2]。临床中抗生素是防治大肠杆菌主要手段,长时间过量添加使用抗生素,进而导致大肠杆菌产生耐药性,其耐药性可以在不同菌株传播,从而导致抗生素防治效果减低,对养殖业和人们的健康具有潜在的威胁[3]。
喹诺酮类药物为临床中常用的人工合成的广谱类抗生素之一,该类药物具有抗菌谱广、效果显著、使用安全等多种优点,被广泛应用[4]。相关研究表明,大肠杆菌、沙门菌(Salmonella)、绿脓杆菌(Pseudomonasaeruginosa)、肺炎克雷伯氏杆菌(KlebsiellaPneumoniae)等病原菌对喹诺酮类药物产生很强的耐药性,其产生的耐药性与其携带的耐药基因具有一定的相关性[5-6]。本试验以临床中分离的15株水貂源致病性大肠杆菌为研究对象,检测其喹诺酮类药物耐药表型和耐药基因,分析其相关性,为临床中喹诺酮类药物在水貂养殖过程合理应用及研究其耐药机制提供参考依据。
1 材料与方法
1.1 试验菌株
1.1.1 试验菌株
15株水貂源大肠杆菌分离患腹泻病水貂的肝脏、肛拭子等组织,通过人工感染致病试验,具有很强致病性,由河北省预防兽医学重点试验室保存。
1.1.2 实验材料
恩诺沙星、环丙沙星、氧氟沙星、诺氟沙星药敏纸片均购自北京天坛药物生物技术开发公司;营养琼脂、营养肉汤均购于北京陆桥生化试剂有限公司;DNA Marker 2000 购于北京中科瑞泰生物科技有限公司;2×Master Mix购自北京康为世纪生物科技有限公司。
1.1.3 实验材料
FGEN02TD型PCR仪,英国Techne公司生产;Bio-Rad型凝胶成像系统,美国Bio-Rad生产;DHP-9082型恒温培养箱,上海一恒科技有限公司生产。
1.2 方法
1.2.1 药敏试验
按照美国临床检验标准委员会(NCCLS)2019年推荐的标准K-B纸片法进与试验于结果判断。将菌株复苏扩大培养,调整菌液浓度为0.5个麦氏浊度,无菌条件下均匀涂在营养琼脂,贴上药敏纸片,37℃培养12—18 h后,每种药物做3个重复,测量抑菌直径。
1.2.2 基因组DNA的制备
采用水煮法提取菌株的基因组DNA,取1 mL菌液放到1.5 mL EP管于离心,弃上清液加1 mL生理盐水反复洗涤3次,加入200 μL生理盐水,放入金属浴中100℃ 10 min,冷却后10 000 rpm/min,离心2—3 min,吸取上清液体,即为DNA模板。
1.2.3 基因PCR检测
参考文献[7],根据根据GenBank上引物序列,设计喹诺酮类药物9种的耐药基因引物(gyrA、gyrB、qnrA、qnrB、qnrC、qnrD、qnrS、Aac(6′)-Ib-cr、pare)由上海生工生物工程有限公司合成。已提取15株致病性大肠杆菌的基因组DNA为模板,对喹诺酮类药物9种的耐药基因进行PCR检测。反应体系(50 μL):2×Master Mix 30 μL,上、下游引物各1.5 μL,DNA 模板2 μL,ddH2O 15 μL;PCR反应条件为94℃ 5 min,94℃ 50 s,56℃ 45 s,72℃ 1 min,30个循环,72℃延伸10 min。PCR结束后取5 μL扩增产物,在1%琼脂糖凝胶上电泳检测,其PCR产物上海生工生物工程有限公司进测序,其测序结果与GenBank中的参考序列进行对同源性比较。
1.2.4 耐药表型与耐药基因相关性分析
参考文献[6],临床分离的15株水貂源致病性大肠杆菌对喹诺酮类药物耐药性与携带耐药基因进行统计,计算其符合率,分析其相关性。
2 结果与分析
2.1 药敏试验检测与耐药表型分析结果
由表1可知,临床分离的15株水貂源致病性大肠杆菌对4种喹诺酮类药物均产生不同程度的耐药性。对诺氟沙星耐药性为40%、恩诺沙星46.7%、左氧氟沙星40%,环丙沙星26.7%。
如何在刑事立法政策的制定过程中辩证地认识民意,正确引导民意、有效利用民意是一个需要亟待解决的问题。然而民意的定义与范围十分抽象、复杂,甚至真伪难辨,一旦研判失误,极易误导决策者,甚至可能造成社会混乱。因而对民意的考量必须加以合理的规制。
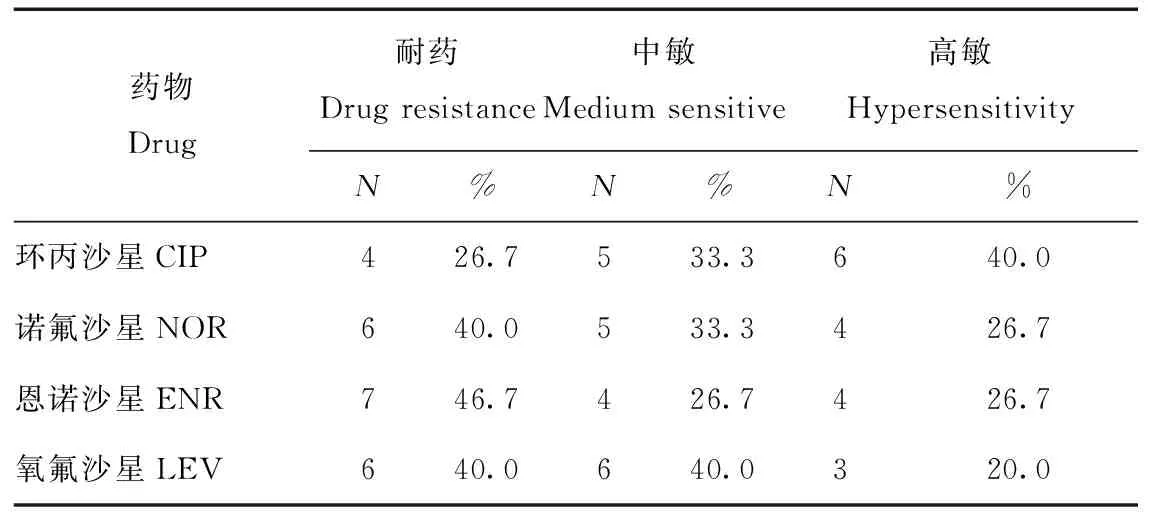
表1 15株大肠杆菌分离株耐药性分析结果Tab.1 Drug resistance analysis results of 15 strains of Escherichia coli
由表2可知,临床分离的15株水貂源致病性大肠杆菌呈现多重耐药,多重耐药占分离菌株的40%。共呈现3种耐药表型,其中耐药表型CIP+-NOR+-ENR+-NA+菌株有4株,占分离菌株的26.7%,耐药表型为NOR+-ENR+-NA+-CIP-的菌株有2株,占分离菌株的13.3%;耐药表型是NOR+-CIP--NOR--ENR-菌株有3株,占分离菌株的20%。
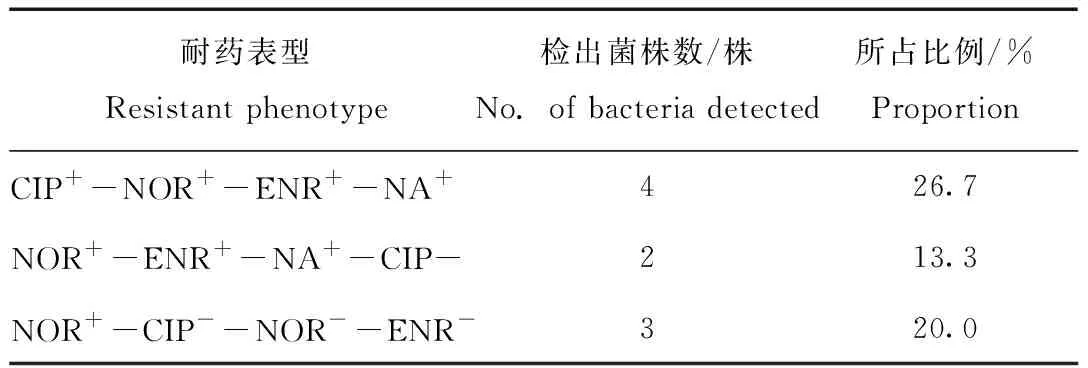
表2 15株大肠杆菌分离株耐药表型分析结果Tab.2 Analysis results of drug resistance phenotype of 15 strains of Escherichia coli
2.2 耐药基因型检测与分析结果
临床分离的15株水貂源致病性大肠杆菌同时携带7种耐药基因gyrA、gyrB、qnrA、qnrB、qnrS、Aac(6′)-Ib-cr、pare,目的条带大小与实际相符(图1),其测序结果与GenBank中的登录参考序列相比,同源性均>97%。由表3可知,耐药基因gyrA、gyrB、qnrA、pare、qnrB检出率较高,检出率为80%—100%,耐药基因Aac(6′)-Ib-cr、qnrS检出率分别为40%、7.0%。耐药基因qnrC、qnrD未检出。
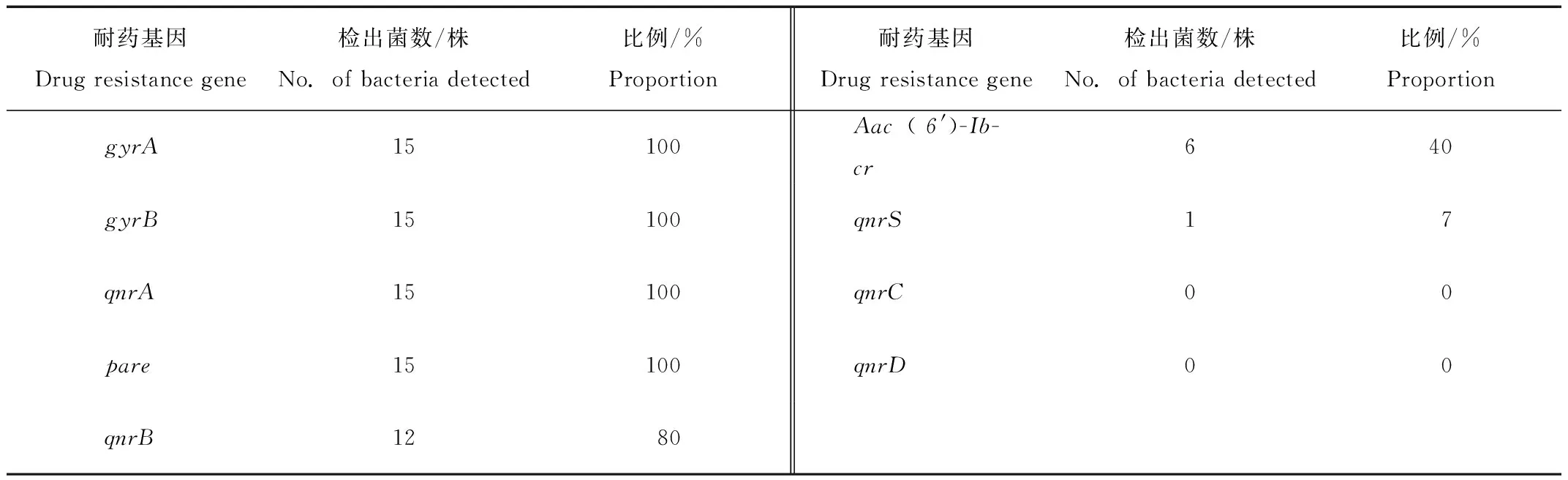
表3 耐药基因检出率结果Tab.3 Results of drug resistance gene detection rate
由表4可知,临床分离的15株水貂源致病性大肠杆菌同时携带多种耐药基因,呈现多种耐药基因型,其中耐药基因型gyrA+gyrB+qnrA+pare+菌株有3株,占分离菌株的20%,耐药基因型gyrA+gyrB+qnrA+pare+qnrB+Aac(6′)-Ib-cr+的菌株有6株,占分离菌株的40%;耐药基因型为表型gyrA+gyrB+qnrA+pare+qnrB+菌株有5株,占分离菌株的33.3%;耐药基因型gyrA+gyrB+qnrA+pare++qnrB+qnrS+菌株有1株,占分离菌株的0.7%。

表4 耐药基因型分析结果Tab.4 Analysis results of drug resistant genotypes
2.3 耐药表型与耐药基因相关性分析结果
由表5可知,恩诺沙星、诺氟沙星、氧氟沙星、环丙沙星耐药表型与耐药基因gyrA、gyrB、qnrA、pare符合率为40%—53.3%,恩诺沙星、诺氟沙星、氧氟沙星、环丙沙星耐药表型耐药基因Aac(6′)-Ib-cr复合率20%—30%,环丙沙星、诺氟沙星与耐药基因qnrB符合率为26.7%—33.3%,恩诺沙星、氧氟沙星与耐药基因qnrB均为46.7%。
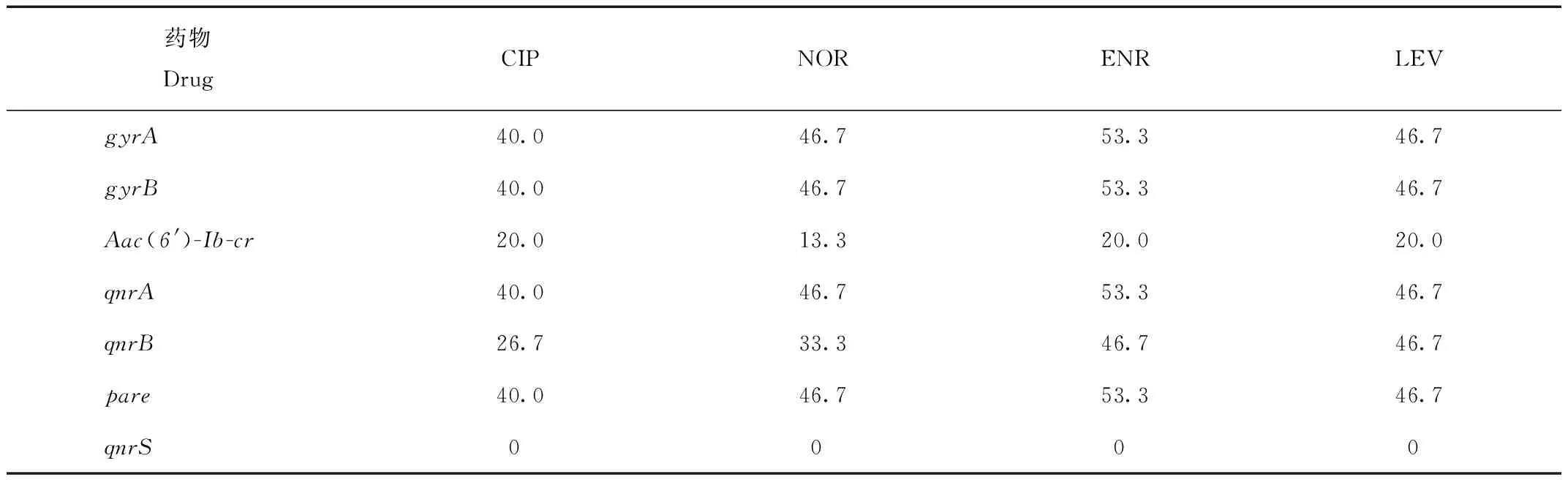
表5 耐药表型与耐药基因相关性分析结果Tab.5 Analysis results of correlation between drug resistance phenotype and drug resistance gene %
3 讨论
大肠杆菌是临床中主要人畜共患病原菌,该菌可以引起多种动物发病,当外界条件改变时,多种动物宿主处于免疫力低下的状态,大肠杆菌通过多种途径入侵宿主,在宿主的体内大量地繁殖,进而引起宿主一系列疾病[8]。近几年,随着养殖业的发展,水貂养殖数量逐渐升高,关于水貂大肠杆菌病的报道逐渐增多,大肠杆菌对水貂养殖危害较大。因此,在水貂养殖过程中应注意该病的防控。
临床中常用的喹诺酮类药物主要包括环丙沙星、恩诺沙星、氧氟沙星等,广泛用于医学、兽医学临床,临床上喹诺酮类药物频繁使用,动物源的大肠杆菌对喹诺酮类药物产生很强的耐药性,不同动物对喹诺酮类药物耐药性具有一定差异性[9]。本试验研究表明,15株水貂源致病性大肠杆菌对恩诺沙星、诺氟沙星、氧氟沙星、环丙沙星耐药率为46.7%—26.7%,呈现多重耐药性,与于杰等[10]报道的水貂源大肠杆菌对氟喹诺酮类药物产生很强的耐药性一致。与夏琦琦等[2]、冯涛等[11]的报道存在差异性,可能与氟喹诺酮类药物在水貂养殖过程中使用频率及地区有关。大肠杆菌对喹诺酮类抗生素耐药性的产生,不仅与喹诺酮类抗生素药物的不规范使用有关,还与其携带耐药基因有关,喹诺酮耐药基因是有质粒介导的,qnrA、qnrB、qnrS、qnrC、qnrD基因通过质粒可以介导的喹诺酮药物的耐药性,oqxA和oqxB基因通过介导细菌的外排作用产生耐药性[9-12]。国内外对动物源大肠杆菌对喹诺酮类药物耐药性的研究较多,但是对水貂源致病性大肠杆菌介导的喹诺酮耐药基因oqxA、oqxB、qnrA、qnrB、qnrC、qnrD、qnrS等研究较少。本试验结果表明,15株水貂源致病性大肠杆菌携带多种耐药基因,呈现多种耐药基因型,其中恩诺沙星、诺氟沙星、氧氟沙星、环丙沙星耐药表型与耐药基因gyrA、gyrB、qnrA、par的符合率为40%—55.3%,具有一定相关性,说明水貂大肠杆菌对喹诺酮药物耐药性产生可以与耐药基因gyrA、gyrB、qnrA、par有关,其作用机制尚未明确,有待进一步研究。本试验为临床中喹诺酮类药物在水貂养殖过程合理应用及研究其耐药机制提供参考依据。

