兰州百合试管小鳞茎膨大及碳水化合物变化规律研究
裴怀弟 李琦 李淑洁 张敏敏 王立光 石有太

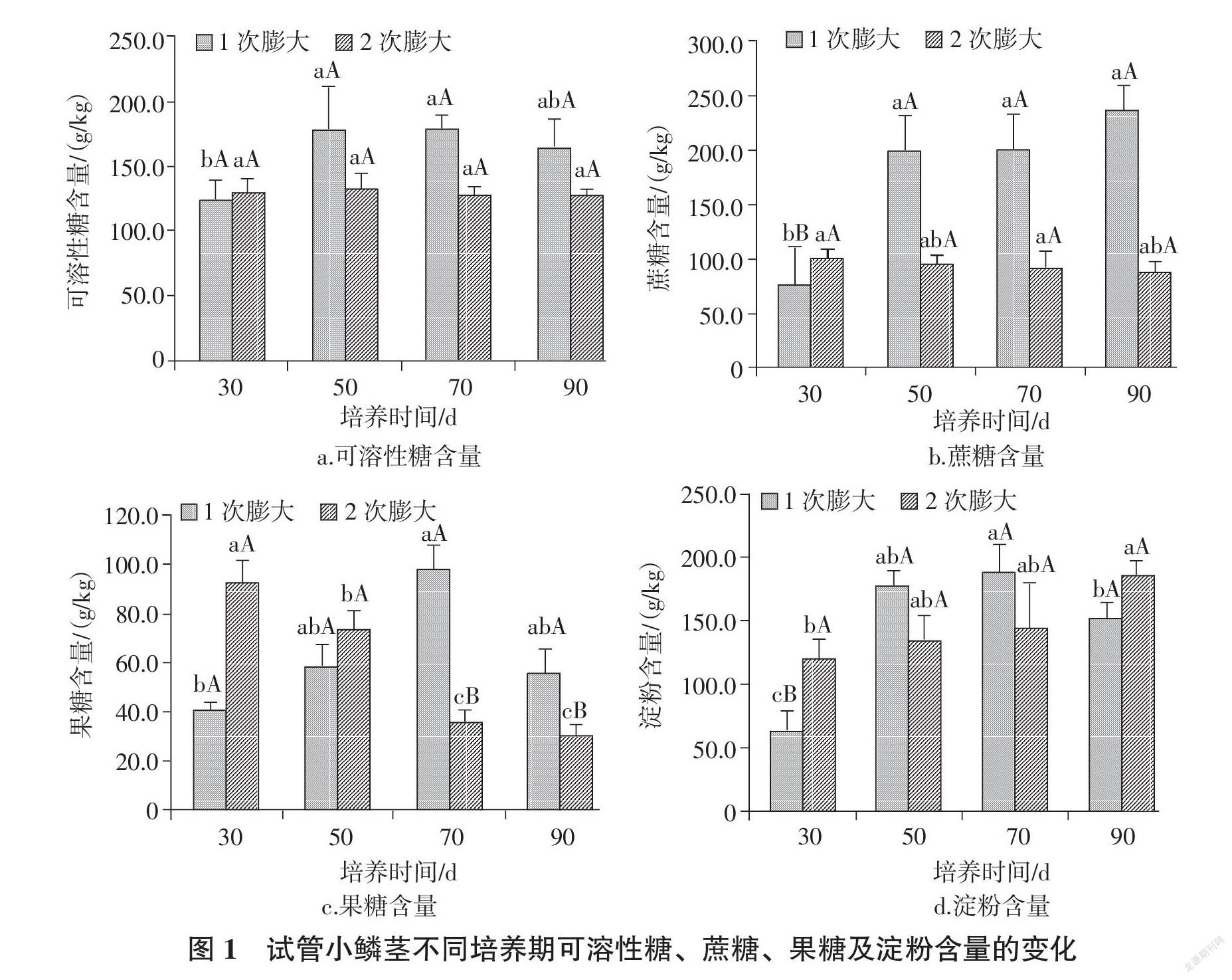
摘要:为了探明兰州百合小鳞茎的生长及膨大规律,以添加不同浓度蔗糖处理为依据,明确小鳞茎生根膨大培养基以1/2MS+0.2 mg/L NAA +70 g/L蔗糖为最适。在此浓度基础上对兰州百合试管小鳞芽进行1次和2次膨大培养,分别在培养30、50、70、90 d时测定小鳞茎鲜重、干重、糖及淀粉含量。结果表明,随着培养天数的增加,兰州百合1次和2次膨大小鳞茎单粒鲜重和干重均呈增加趋势,且2次膨大较1次膨大效果显著。1次膨大小鳞茎可溶性糖、果糖和淀粉含量均随培养天数的增加呈先增加后降低的趋势,且变化趋势基本一致;蔗糖含量随着培养天数的增加呈上升趋势,与培养30 d相比,培养50~90 d时蔗糖含量明显增加,且达极显著差异。随培养天数的增加,2次膨大小鳞茎可溶性糖和蔗糖含量变化趋势较平缓,各培养时期差异不明显;果糖含量呈降低趋势,与培养30 d相比,培养50~90 d时果糖含量显著降低;淀粉含量呈增加趋势,在培养90 d时达最大值。
关键词:兰州百合;试管小鳞茎;膨大;碳水化合物
中图分类号:S644.1 文献标志码:A 文章编号:1001-1463(2021)12-0005-06
doi:10.3969/j.issn.1001-1463.2021.12.002
Regularity of Enlargement and Carbohydrate Changes
in Bulblets in vitro of Lanzhou Lily
PEI Huaidi, LI Qi, LI Shujie, ZHANG Minmin,WANG Liguang, SHI Youtai
(Institute of Biotechnology, Gansu Academy of Agricultural Sciences, Lanzhou Gansu 730070, China)
Abstract:The regularity of growth and enlargement of Lanzhou lily bulbs was investigated in this work. The optimal rooting expansion medium was 1/2MS+0.2 mg/LNAA+70 g/L sucrose based on the treatment with different sucrose concentrations. The bulblets were further cultured for enlargement once and twice, the fresh weight, dry weight, sugar content and starch content of bulblets were measured on 30 d, 50 d, 70 d and 90 d during culturing period. The results showed that the fresh weight and dry weight of bulblets of Lanzhou lily were increased at first and second enlargement with the increase of the cultivation days, and the effect of second enlargement was more significant than the first enlargement. With the increase of cultivation days, the content of soluble sugar, fructose and starch of bulblets showed almost the identical trend of increasing and then decreasing in the first enlargement, the starch content showed an upward trend, and the content increased significantly from 50 d to 90 d, compared with 30 d, it showed significant increase. With the increase of cultivation days, the soluble sugar and sucrose content of bulblets showed a gentle trend, and there was no obvious difference between each culture period. The fructose content showed a decreasing trend, it was significantly decreased at 50~90 d compared with that at 30 d. The starch content showed an increasing trend, and reached the maximum value at 90 d of culture period.
Key words:Lanzhou lily;Bulblets in vitro;Enlargement;Carbohydrate
蘭州百合(Lilium davidii var.unicolor)是百合科(Liliaceae)百合属(Lilium) 川百合的变种,为多年生鳞茎草本植物,其鳞茎具有营养和滋阴养肺等功效,是我国食用百合中唯一的甜百合。百合在甘肃已有400多年的栽培历史,因其兼具一定的药用价值,被国家卫生部确定为“药食同源”植物,也是甘肃省重要的地理标志产品和重要的名优特农产品之一[1 - 3 ]。长期以来,兰州百合主要以分球繁殖、珠芽和鳞片扦插等无性繁殖方式为 主[4 ],长期采用易感染病害,造成种性退化,严重影响百合的产量和品质。利用组织培养技术可有效地提高种苗种球繁殖系数,且操作简便,同时还可以保持优良的性状,防止植物病毒的危害,在无性繁殖作物中广泛应用。
百合的鳞茎是地下茎及其腋芽肥大而形成的变态器官[5 ],具有繁殖和营养双重作用,其形成与膨大是个复杂的生理过程[6 ]。碳水化合物的变化与百合鳞茎的发育有着密切的关系[5 ],其中蔗糖是光合作用的主要产物,存在于许多果实中,它不仅是糖积累的主要方式,更是影响品质形成的重要因子[7 ]。糖既可以直接作为基质调节代谢,也可以作为有效的信号分子,所以糖的可利用性对植物的生长发育有着关键的驱动作用[8 - 9 ]。Jia等[10 ]研究发现,果实的生长和发育与糖浓度变化有着紧密的联系,糖浓度增加时,可诱导ABA的积累,从而加速果实的成熟。淀粉是百合鳞茎细胞内碳水化合物的主要贮藏形式[11 - 14 ],其代谢作用直接关系到鳞茎及植株的发育[15 - 16 ]。目前关于兰州百合试管小鳞茎形成过程中物质累积、糖及淀粉含量变化规律的研究相对较少,我们利用组织培养技术,采用生长分析法研究小鳞茎生长膨大过程中生物量累积、糖及淀粉含量变化,以进一步了解兰州百合种球的形成及膨大机理,为调控百合鳞茎的生长发育及膨大规律提供技术支撑。
1 材料与方法
1.1 材料
兰州百合种球于2018年1月在兰州市七里河区西果园镇百合试验田采集,选用外形饱满、颜色洁白、健壮无病虫害的3年生兰州百合鳞茎。试验于2018年3月至2019年12月在甘肃省农业科学院生物技术研究所实验室进行。
1.2 试验方法
将兰州百合外层鳞片剥去,选取中内层鳞片,用流水冲洗6~8 h,滤纸吸干水分,然后在超净工作台上用无菌水冲洗3~5次,用70%乙醇消毒30~40 s,投入0.1%升汞溶液中消毒8~10 min,再用无菌水冲洗5~6次,置于垫有滤纸的培养皿中晾干水分。用解剖刀将鳞片分上中下3部分,切成0.5 cm×0.5 cm左右的外植体,接种于芽诱导培养基(MS+0.5 mg/L 6-BA+0.05 mg/L+30 g/L蔗糖)中。在(25±2) ℃、2 000~3 000 lx光照12~16 h条件下培养。培养30~35 d 后将诱导出的不定芽切下接种至增殖培养基(MS+1.25 mg/L6-BA+0.2 mg/L+30 g/L)中扩繁,然后将丛生苗分单株切下接种到生根膨大培養基(1/2 MS+NAA 0.2 mg/L+70 g/L蔗糖)中培养(每瓶装50 mL的培养基)。接种60瓶(其中30瓶进行1次膨大测定用,其余30瓶1次膨大90 d后转接到新的生根膨大培养基中,进行2次膨大培养),每瓶接种10个小鳞芽,定期(30、50、70、90 d)采集样品(小鳞茎),用直尺测定根长,采用称重法测定小鳞茎鲜重,采用烘干法测定小鳞茎干重[2 ]。
1.3 测定方法
1.3.1 可溶性糖含量测定 采用蒽酮比色法测定[17 ]。准确吸取0、0.1、0.2、0.3、0.4、0.5、0.6 mL浓度为200 μg/mL 的蔗糖标准溶液于7 支刻度试管中,加蒸馏水至2.0 mL,依次加入0.5 mL蒽酮乙酸乙酯试液、5 mL 浓硫酸,经涡旋振荡后,置沸水浴中逐管准确保温1 min,取出并自然冷却至室温后,以空白为对照,测定其在630 nm 处的吸光值,以蔗糖浓度为横坐标,吸光值为纵坐标,绘制标准曲,并求出标准曲线方程。
称取烘干的百合鳞片粉末0.2 g,放入刻度试管中,加入10 mL蒸馏水,沸水中提取30 min,提取液用漏斗过滤(反复漂洗残渣),上清液最终定容至25 mL的容量瓶中即为可溶性糖提取液,每处理重复提取3次。吸取样品提取液0.5 mL,加入1.5 mL H2O、0.5 mL的蒽酮,再缓慢加入5 mL浓H2SO4,盖上试管塞后轻轻摇匀,然后打开试管塞置沸水浴中煮沸1 min,取出冷却至室温,在630 nm下测OD值,以0浓度管调零。查标准曲线得到提取液可溶性糖含量,计算样品中的可溶性糖含量。
1.3.2 蔗糖含量测定 参照张志良[18 ]的方法测定。取蔗糖标准液用80%乙醇稀释成0、10、20、30、40、60、80、100 μg/mL浓度的溶液,分别取0.4 mL溶液,各加入200 μL的浓度为2 mol/L NaOH溶液,100 ℃煮沸5 min,冷却,再加入2.8 mL 30% HCl和0.8 mL 0.1%间苯二酚,摇匀,80 ℃水浴10 min,冷却后在480 nm下测定OD值,以0浓度管调零。以蔗糖浓度为横坐标,OD值为纵坐标,绘制标准曲,并求出标准曲线方程。
称取烘干的百合鳞片粉末50 mg,放入10 mL刻度离心管中,加入4 mL 80%乙醇,置于80 ℃水浴中不断搅拌40 min,离心,收集上清液,其残渣加2 mL 80%乙醇重复提2次,合并上清液。在上清液中加入10 mg活性炭,80 ℃脱色30 min,80%乙醇定容至10 mL,重复3次。吸取样品提取液0.4 mL,加入2.8 mL 30%HCl和0.8 mL 0.1%间苯二酚,然后摇匀,80 ℃水浴反应10 min,冷却至室温,在480 nm下测定OD值,以0浓度管调零。查标准曲线得提取液中总的蔗糖含量,计算样品中的蔗糖含量。
1.3.3 果糖含量测定 称取标准果糖溶液用80%乙醇稀释成浓度0、15、30、50、75、150、200 mg/mL的溶液,取小试管8支,分别加入1.0 mL不同质量浓度的标准果糖溶液,各加入2.0 mL 0.1%间苯二酚及1.0 mL H2O,摇匀。80 ℃水浴反应10 min,冷却至室温,用分光光度计在480 nm处测定光密度OD值,以0浓度管调零。以果糖浓度为横坐标,OD值为纵坐标,绘制标准曲,并求出标准曲线方程。
果糖提取方法同1.3.2,吸取样品提取液1.0 mL,加入2.0 mL 0.1%间苯二酚和1.0 mL H2O,摇匀,80 ℃水浴反应10 min,冷却至室温,在480 nm下测定OD值,以0浓度管调零。查标准曲线得到提取液总的果糖含量,然后计算样品中的果糖含量。
1.3.4 淀粉含量测定 参照张志良等[18 - 19 ]方法测定。准确吸取0、0.4、0.4、0.8、0.8、1.2、1.2、1.6、1.6、2.0、2.0 mL 100 μg/L的淀粉标准液于11支刻度试管中,加蒸馏水至2.0 mL。顺序向试管中加入0.5 mL恩酮乙酸乙酯试剂和5.0 mL浓硫酸,充分振荡,立即将试管放入沸水浴中,逐管均准确保温1 min,取出后自然冷却到室温,以空白参比,在630 nm波长测OD值,以OD为纵坐标,以糖含量为横坐标,绘制标准曲线,并求出标准曲线方程。
在1.3.4提取可溶性糖后的残渣中加入100 mL热蒸馏水,涡旋振荡后置沸水浴中煮15 min。取出冷却后加入10.0 mL浓度为9.2 mol/L HClO4,边加边搅拌,提取15 min,冷却后摇匀,用滤纸过滤,转移上清液至25 mL容量瓶中,上清液定容至刻度即为兰州百合淀粉提取液,重复提取3次。吸取样品提取液0.5 mL,加1.5 mL H2O、0.5 mL蒽酮乙酸乙酯,再缓慢加入5.0 mL浓硫酸,充分振荡后立即将试管放入沸水浴中,逐管均保温1 min,取出后自然冷却到室温,以空白做参比,在630 nm下测定OD值。查标准曲线得到提取液总淀粉含量,然后计算样品中的淀粉含量。
1.4 数据处理
数据通过Microsoft Excel和SPSS 13.0 软件进行统计分析。
2 结果与分析
2.1 兰州百合试管小鳞茎不同膨大期的生物量变化
将兰州百合试管苗丛生小鳞芽接种在生根膨大培养基上进行生根膨大培养。从表1可以看出,随着培养时间的延长,1次膨大和2次膨大的鳞茎单粒鲜重、干重均呈增加趋势。相同处理在30、50、70、90 d时,与1次膨大相比,2次膨大的小鳞茎单粒鲜重分别增加176.8%、68.4%、96.1%、52.3%,单粒干重分别增加282.1%、127.6%、106.1%、101.0%。2次膨大效果明顯。
2.2 兰州百合试管小鳞茎可溶性糖含量变化
由试管小鳞茎可溶性糖含量的变化(图1-a)可知,在相同培养时期,试管小鳞茎可溶性糖含量1次膨大高于2次膨大,且均随着培养时间的增加呈现先升后降的趋势。1次膨大处理下,培养70 d的小鳞茎可溶性糖含量最大,与培养30 d差异达显著水平(P < 0.05)。2次膨大处理下,小鳞茎可溶性糖含量随着培养时间的延长,变化趋势较平稳,各生长阶段差异不显著。说明随着小鳞茎的逐渐膨大,可溶性糖含量变化趋于平缓,不同处理阶段变化不显著。
2.3 兰州百合试管小鳞茎蔗糖含量变化
由试管小鳞茎蔗糖含量变化(图1-b)可知,除培养30 d外,试管小鳞茎蔗糖含量1次膨大明显高于2次膨大。1次膨大处理下,蔗糖含量随着培养时间的延长呈上升趋势;与培养30 d相比,培养50~90 d时蔗糖含量明显增加,且达极显著差异(P <0.01)。这可能与试管苗膨大生根培养基中添加蔗糖有关,前期培养基中蔗糖含量较高,后期培养基中蔗糖含量逐渐降低。2次膨大处理下,随着培养时间的延长试管小鳞茎蔗糖含量变化趋势平稳,各处理间差异不显著。
2.4 兰州百合试管小鳞茎果糖含量变化
由试管小鳞茎果糖含量变化(图1-c)可知,1次膨大处理下,试管小鳞茎果糖含量随着培养时间的延长呈先升后降的趋势,培养70 d时小鳞茎果糖含量达最大值,与培养30 d差异达显著水平(P <0.05);培养70 d后小鳞茎果糖含量逐渐降低,培养90 d时果糖含量降到最低。2次膨大处理下,试管小鳞茎果糖含量随着培养时间的延长呈下降趋势,培养30 d时果糖含量最高;培养50 d与培养30 d差异达显著水平(P <0.05);培养70~90 d时果糖含量下降趋势明显,与培养30 d和50 d之间差异达极显著水平(P <0.01)。
2.5 兰州百合试管小鳞茎淀粉含量变化
由试管小鳞茎淀粉含量变化(图1-d)可知, 1次膨大处理下,试管小鳞茎淀粉含量随着生长周期的延长呈先升后降的趋势;培养50~70 d时淀粉含量逐渐增加,在培养70 d时达最大值,与培养30 d相比达极显著差异(P <0.01);培养90 d时,淀粉含量与培养70 d相比有所降低,但明显高于培养30 d,且达极显著差异(P <0.01)。2次膨大处理下,试管小鳞茎淀粉含量随培养时间的延长呈上升趋势,在膨大培养90 d时淀粉含量达最大值,与培养30 d的差异显著(P <0.05)。
3 结论与讨论
兰州百合大田栽培条件下种球繁殖速度较慢,且从无性繁殖的小鳞茎到大田种球的生长周期较长,自然繁殖方式已不能满足持续增长的种球需求量。组织培养技术是种苗种球繁殖的有效手段之一,该项技术极大地提高了百合种苗种球的生产效率。关于百合种苗种球组培快繁的研究较多。王家福等[20 ]对百合小鳞茎继代培育的研究表明,蔗糖质量浓度逐渐提高时,百合小鳞茎直径也随着增加。裴怀弟等[21 ]研究表明,兰州百合组培苗生根膨大的小鳞茎鲜重和横径均随着培养时间的增加而增加。傅玉兰等[22 ]研究指出,培养基中添加糖的含量和鳞茎增殖率之间并未表现出正相关性。本研究表明,生根膨大培养基中添加蔗糖浓度较高时抑制了根系的生长,生根数减少,从而导致植株生长势也变弱,可见培养基中添加蔗糖的浓度不宜太高,根据试管苗的长势可考虑添加70 g/L蔗糖为最佳,即促进了百合鳞茎的膨大、生根,又降低了生产成本。随着培养天数的增加,兰州百合1次膨大和2次膨大小鳞茎单粒鲜重和干重呈增加趋势,且2次膨大较1次膨大效果显著。
糖和淀粉是维持百合鳞茎发育过程中碳水化合物平衡的主要物质[22 ]。本研究表明:1次膨大小鳞茎可溶性糖、果糖和淀粉含量均随培养天数的增加呈先增加后降低的趋势,且变化趋势基本一致;淀粉含量在90 d时略有下降,但是与培养30 d相比仍为增加,且差异极显著。随培养天数的增加2次膨大小鳞茎可溶性糖和蔗糖含量变化趋势较平缓,各培养时期差异不明显;果糖含量呈降低趋势,与培养30 d相比,培养50~90 d时果糖含量显著降低;淀粉含量呈增加趋势,在培养90 d时达最大值。
参考文献:
[1] 江 晶,杨一斐,张朝巍,等. 兰州百合优势种植区分布与土壤养分分析[J]. 甘肃农业科技,2018(7):45-47.
[2] 林玉红. 兰州食用百合生长发育及氮磷钾素养分吸收累积与分配规律研究[J]. 甘肃农业科技,2019(12):8-17.
[3] 李淑洁,张金文,裴怀弟,等. 兰州百合同源四倍体诱导及其基因组大小估算[J]. 草业学报,2020,29(3):190-196.
[4] 李 瑛,黄惠英,张金文,等. 兰州百合病毒多重PCR 和ELISA 检测体系的比较与应用[J]. 甘肃农业大学学报,2011,6(3):59-64.
[5] 丁伟国,王常荣. 百合鳞茎的形成及成熟阶段体内干物质的变化[J]. 内蒙古农业科技,2005(7):213-219.
[6] 孙红梅,汪可心,王春夏,等. 百合鳞茎发育过程中可溶性糖含量的变化[J]. 河北农业大学学报,2008,31(5):61-65.
[7] 米宝琴. 外源糖对葡萄试管苗糖代谢的分子调控机理研究[D]. 兰州:甘肃农业大学,2016.
[8] SMEEKENS S,MAJ,HANSON J,et al. Sugar signals and molecular networks controlling plant growth[J]. Current Opinion in Plant Biology,2010,13(3):274-279.
[9] ROLLAND F,BAENA-GONZALEZ E,SHEEN J. Sugar sensing and signaling in plants:conserved and novel mechanisms[J]. Annu. Rev. Plant Biol,2006,57:675-709.
[10] JIA H,WANG Y,SUN M,et al. Sucrose functions as a signal involved in the regulation of strawberry fruit development and ripening[J]. New Phytologist,2013,198(2):453-465.
[11] MILLER W B,LANGHANS R W. Low temperature alters carbohydrate metabolism in Easter lily bulbs[J]. Hort Science,1990,25(4):463-465.
[12] 孫红梅. 低温解除百合鳞茎休眠的效应及其生理生化机制研究[D]. 沈阳:沈阳农业大学,2003.
[13] 张 月,孙红梅,沈向群,等. 百合鳞茎发育和低温贮藏过程中淀粉粒亚显微结构的变化[J]. 园艺学报,2007,34(3):699-704.
[14] 李梦雪,夏富娴,杨光映,等. 果实糖代谢中激素调控研究进展[J]. 云南大学学报,2019,41(4):819-831.
[15] SHIN K S,CHAKRABARTY D,PAEK K Y.Sprouting rate,change of carbohydrate contents and related enzymes during cold treatment of lily bulblets regenerated in vitro[J].Scientia Horticulturae,2002,96(1-4):195-204.
[16] XU R Y,NIIMI Y,HAN D S. Changes in endogenous abscisic acid and soluble sugars levels during dormancy-release in bulbs of Lilium rubellum[J]. Scientia Horticulturae,2006,111(1):68-72.
[17] 王韶唐. 植物生理学实验指导[M]. 西安:陕西科学技术出版社,1987.
[18] 张志良. 植物生理学实验指导[M]. 北京:高等教育出版社,2009.
[19] 马君义,韩小芬,陈 楠,等. 兰州百合鳞茎冷藏保鲜过程中碳水化合物含量及淀粉酶活性的变化[J]. 食品工业科技,2018,39(10):73-77.
[20] 王家福,陈振光. 百合快速繁殖条件的优化[J]. 福建农业大学学报,1999,28(2):152-156.
[21] 裴怀弟,林玉红,李淑洁,等. 兰州百合组培小鳞茎诱导技术研究[J]. 甘肃农业科技,2019(7):29-32.
[22] 傅玉兰,何风群.影响百合试管鳞茎增殖因素的研究[J]. 安徽农业大学学报,2001,
28(2):179-181.
(本文责编:杨 杰)

