建筑废弃物木屑材料制备多孔碳材料
谢 竺
(乌鲁木齐职业大学应用工程学院,乌鲁木齐 830000)
0 引 言
自工业革命以来,大量化石燃料的燃烧导致大气中CO2浓度急剧增加,引发了严重的温室效应,对人类社会的可持续发展造成威胁。如何有效降低大气中CO2的浓度并将其开发利用引起了各国研究者的普遍关注[1]。电化学还原CO2是一种新型的温和且高效的CO2利用方式,该反应运用可再生的电能将CO2转化为一氧化碳(CO)、甲酸(HCOOH)、乙烯(C2H4)、乙醇(C2H5OH)等化学品或燃料,在降低CO2浓度的同时,实现了CO2的资源化利用[2-3]。然而现阶段的CO2电化学还原仍存在一些问题亟待解决:一方面是水性电解液体系中存在电解水析氢的竞争反应,导致用于CO2还原的能量被消耗,降低还原效率;另一方面是CO2电化学还原的产物较多,选择性差,后续分离困难。因此,寻找合适的催化剂,提高CO2还原的选择性和抑制析氢反应是实现CO2高效还原的关键。在过去几十年中,研究者们已开发出各种各样的催化剂用于CO2电化学还原,如金属、金属氧化物、金属硫化物等[4]。其中,由贵金属,如金、银等为原料制备的催化剂可在较低的过电势下将CO2高效还原为CO,但这类贵金属由于价格昂贵,限制了它们的发展和大规模应用[4]。非贵金属中,铜是一类比较特殊的金属,可以将CO2还原为除一氧化碳和甲酸以外的产品,如甲烷、甲醇、乙醇、乙烯等[5]。但是这一特性也引起了铜做催化剂时产物选择性差的问题,导致各产物的效率较低,且后续分离困难。锡可将CO2高选择性地还原为甲酸,甲酸的法拉第效率(FE)可达90%以上,但是这类催化剂稳定性差,极易失活[6]。近年来,氮掺杂的碳材料作为电催化剂引起研究者的广泛关注,并取得了明显的进展。如Wu等[7]报道的氮掺杂碳纳米管用于二氧化碳电化学还原,仅在0.18 V的过电势下,便有37%(法拉第电流效率)的CO产生。在过电势为0.26 V时,CO的FE达到最大,为80%。刘开华[8]以氮掺杂的碳纳米管为基础,研究了不同氮官能团对CO2还原至CO的影响,发现吡啶氮是对CO形成最活泼的官能团,而吡咯氮和石墨氮活性较差。
本文选用建筑废料——锯末木屑为原料,NaNH2为活化剂和氮源,通过一步热解法制备氮掺杂的微孔碳催化剂,用于电化学还原CO2的研究。
1 实 验
1.1 材料与试剂
锯末木屑:收集于豪达装修股份有限公司;氨基钠、碳酸氢钾:分析纯,阿拉丁试剂有限公司;盐酸、乙醇:分析纯,西陇化工股份有限公司;导电炭黑:分析纯,赛博电化学材料有限公司;5%全氟磺酸型聚合物(Nafion)溶液:分析纯,深圳科斯顿科技有限公司;导电碳纸:HPCP060,深圳科斯顿科技有限公司。
1.2 催化剂的制备
称取1 g锯末木屑和2 g NaNH2于镍坩埚中充分搅拌至混合均匀,然后将混合物转移到刚玉方舟,于管式炉中,并在氮气氛围(100 mL/min)下以5 ℃/min的升温速率升至700 ℃、800 ℃、900 ℃保持1 h,待降至室温后取出样品,分别用1 mol/L HCl和蒸馏水洗涤样品至中性,最后将其置于真空干燥箱中以80 ℃干燥12 h。得到的样品记为SA-x,x表示活化温度(700 ℃、800 ℃、900 ℃)。
1.3 产物表征
采用德国布鲁克D8 Advance型X射线衍射仪对样品的物相结构进行分析,采用美国赛默飞ESCALEAB 250Xi光电子能谱仪对样品的化学组成进行分析,采用美国麦克ASAP 2060型吸附仪通过-196 ℃下N2的吸附-脱附等温线对样品的孔结构特性进行分析,通过德国Elementar Vario MICRO元素分析仪对样品的氮含量进行分析。
1.4 电化学测试
CO2电化学还原的测试实验通过一个由三电极构成的双室密封电解槽进行,电解槽两室之间由Nafion 212质子交换膜隔开,Ag/AgCl电极为参比电极,铂丝电极为对电极,0.1 mol/L KHCO3溶液为电解液。工作电极的制备通过10 mg样品、10 mg导电碳粉、100 μL 5%Nafion溶液和1 mL乙醇混合超声均匀后,量取100 μL混合液涂于(1 cm×1 cm)碳纸上。每次电解开始前,向阴极室内通入30 min CO2气体,以排除电解液中的O2并使CO2达到饱和(pH=6.8)。反应过程中,CO2气体保持20 mL/min的流速不断通入阴极室中。电解过程中的数据采集通过电化学工作站(CHI 660E)完成,气相产物由气相色谱仪(安捷伦7820A)检测。实验中涉及的过电势均根据式(1)转化为相对于可逆氢电极(RHE)的电势:
E(RHE)=E(Ag/AgCl)+0.210+0.059 1×pH
(1)
式中:E(RHE)为相对于可逆氢电极的电势,V;E(Ag/AgCl)为相对于参比电极的电势,V。
不同过电势下气体产物的法拉第效率(FE)通过式(2)计算得到:
(2)
式中:FE为法拉第效率,%;Jgas为生成CO或H2的电流密度,mA/cm2;Jtotal为总电流密度,mA/cm2;vgas为气相测得的CO或H2的产生速率,mL/min;N为CO或H2产生需要转移的电子数,均为2;F为法拉第常数,96 485 C/mol。
2 结果与讨论
2.1 催化剂结构分析
图1所示为样品的氮气吸附-脱附等温线,表1为样品孔结构特性。由图可知,在相对压力较低,即小于0.1时,氮气的吸附量迅速上升,且吸附曲线与脱附曲线之间没有出现回滞环,符合I型等温线的特性,说明样品主要由微孔组成[9]。结合表1可发现,活化温度由700 ℃升至800 ℃时,样品的比表面积和孔体积由1 405.8 m2/g和0.72 cm3/g升高到1 622.4 m2/g和0.82 cm3/g,当活化温度继续升到900 ℃时,样品的比表面积和孔体积出现下降,降至1 524.4 m2/g和0.75 cm3/g,可能是热解温度过高,孔结构坍塌所致。且对于3个样品,微孔含量均占主导,与氮气吸附-脱附曲线的结果一致。
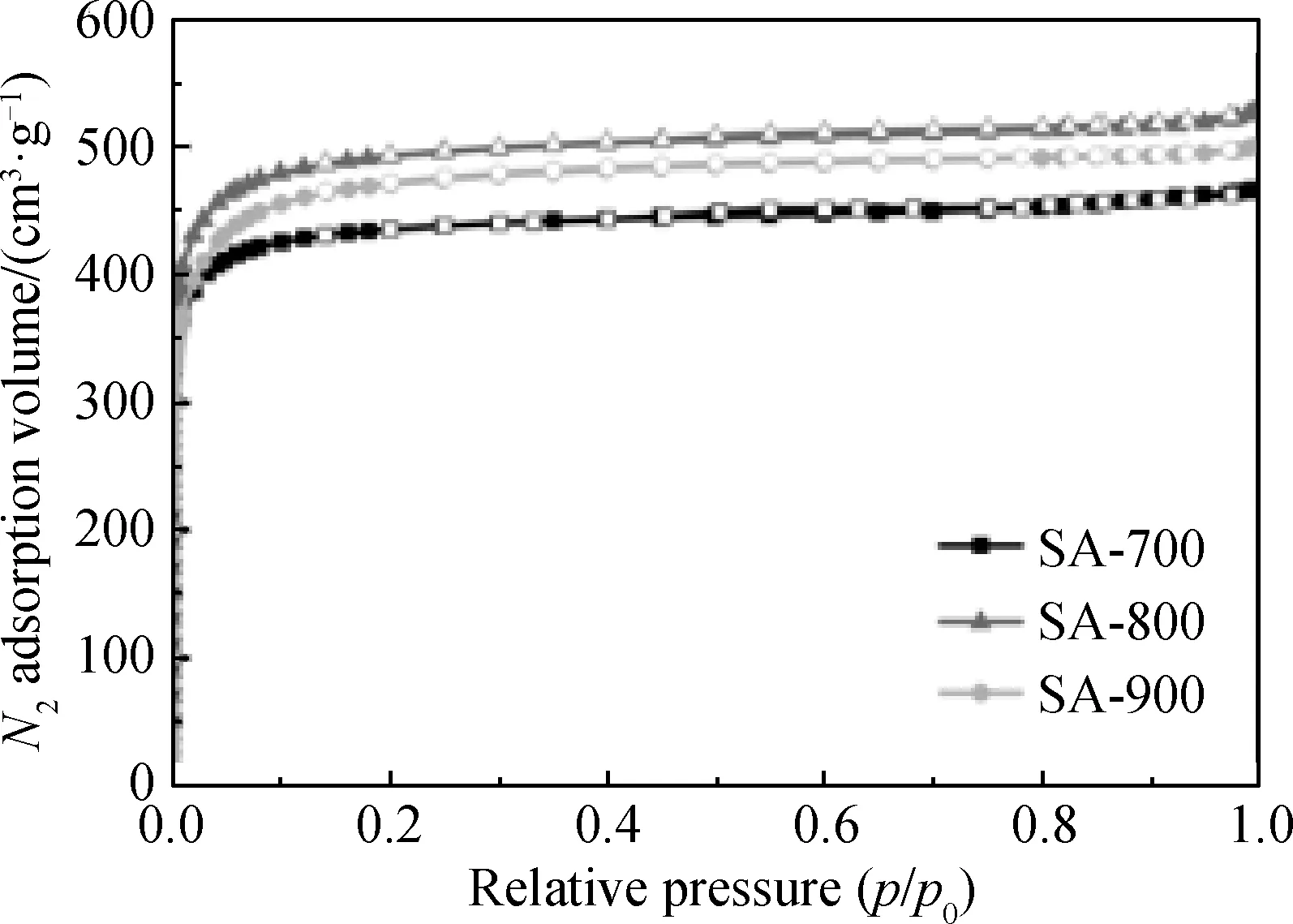
图1 样品的N2吸附-脱附等温线Fig.1 N2 adsorption desorption isotherm of samples

表1 样品孔结构特性Table 1 Textural properties of samples
图2所示为样品的XRD谱,所有样品均出现两个较宽的衍射峰,位于24.5°和44.2°,分别对应于无定型碳的(002)峰(100)峰,且活化温度越高,两个衍射峰越宽,说明样品的无序度越高[10]。

图2 样品的XRD谱Fig.2 XRD patterns of samples
由元素分析仪测得的氮元素含量如表2所示,随活化温度升高,样品的氮含量下降,活化温度由700 ℃上升至900 ℃,氮的质量分数从4.13 %下降到2.06%,说明氮元素极易挥发,热稳定性差。
图3为样品的X射线光电子能谱分析结果,可以看出样品主要由C、N、O三种元素组成,且随活化温度升高,位于~400 eV的氮元素峰强度下降,即含量降低,与表2所示元素分析的结果一致。

图3 样品的X光电子能谱Fig.3 X-ray photoelectronic spectra of samples

表2 样品的氮元素含量(质量分数)Table 2 N element content of samples (mass fraction)
图4~图6分别对样品的氮元素进行了X光电子能谱分析,进一步确定了样品中氮元素的存在形式,对氮元素进行解卷积后发现所有样品的氮元素均由吡啶-氮、吡咯-氮和吡啶型的氮氧化物三种形式存在[11],其中吡咯-氮和吡啶-氮的含量均高于吡啶型的氮氧化物。据文献报道,吡咯-氮和吡啶-氮相较于吡啶型的氮氧化物更有利于CO2电化学还原反应的进行,同时可抑制竞争反应,即析氢反应的发生[12]。
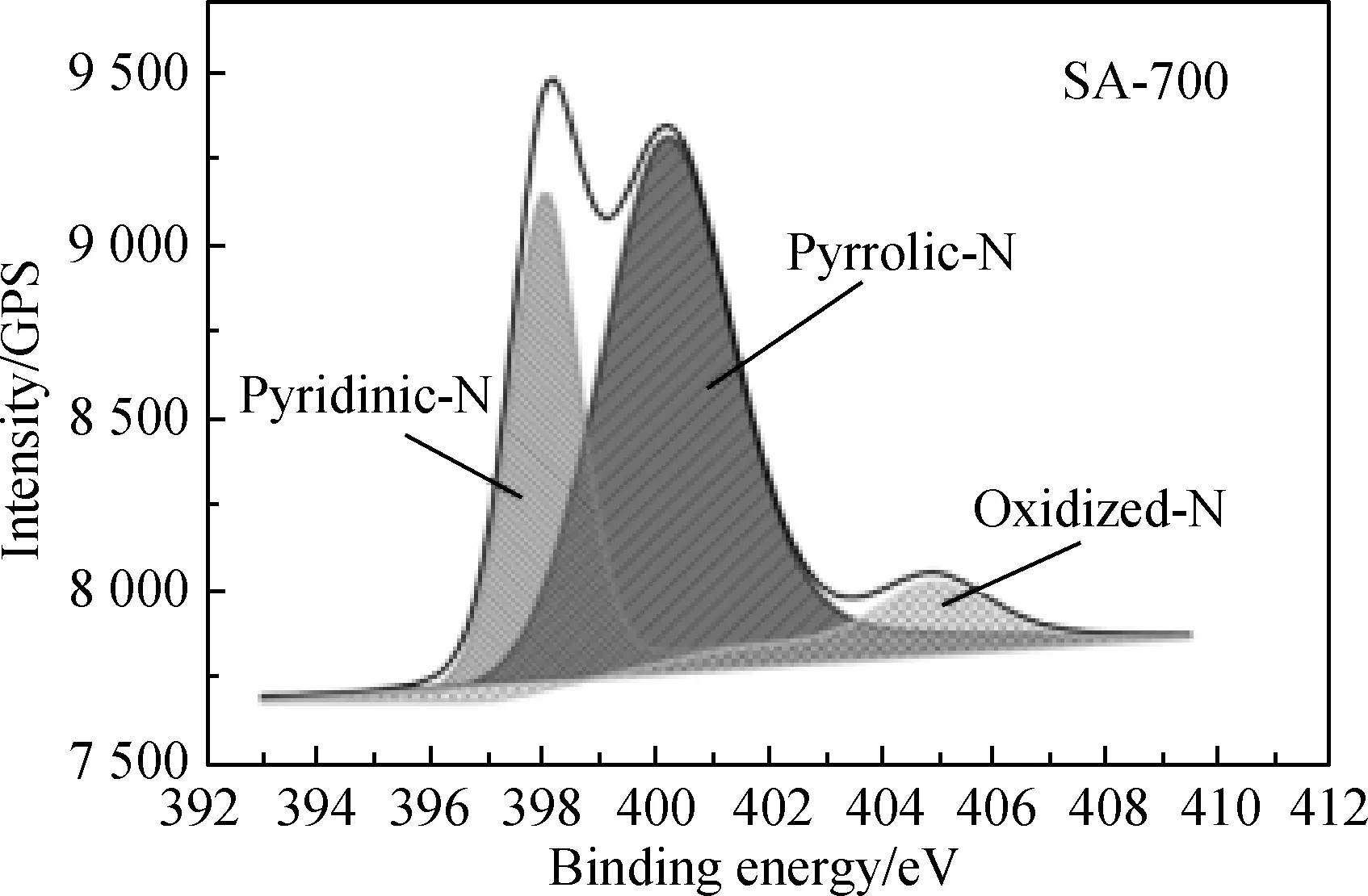
图4 样品SA-700的氮元素的X光电子能谱Fig.4 X-ray photoelectronic spectra of N element in SA-700

图5 样品SA-800的氮元素的X光电子能谱Fig.5 X-ray photoelectronic spectra of N element in SA-800
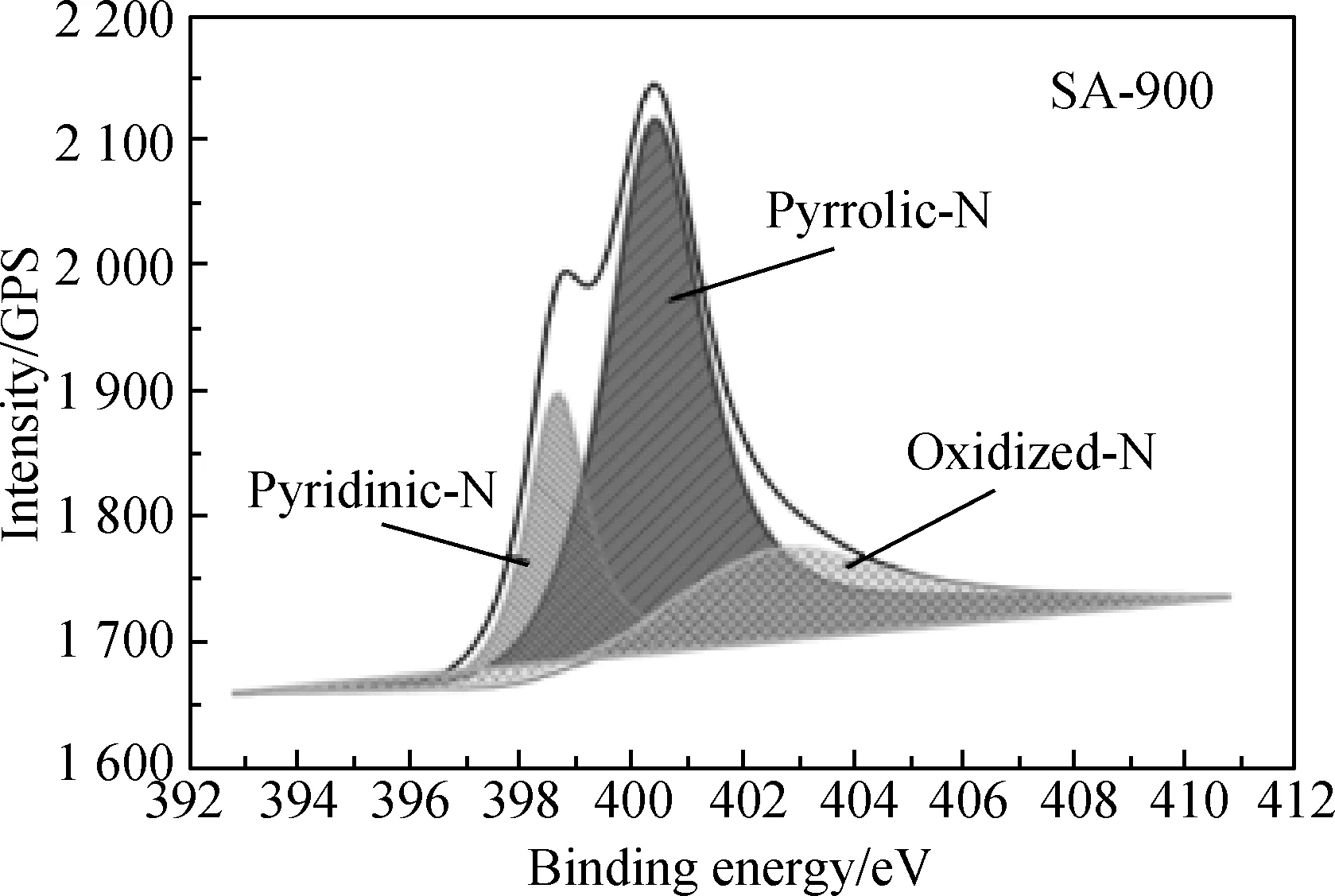
图6 样品SA-900的氮元素的X光电子能谱Fig.6 X-ray photoelectronic spectra of N element in SA-900
2.2 催化剂的CO2还原性能分析
图7为样品在CO2饱和的0.1 mol/L KHCO3中的线性扫描伏安曲线,从图中可看出,在不同过电势下,SA-800的电流密度最高,在-0.9 V时达到-6.36 mA/cm2,而SA-700和SA-900的电流密度仅有-1.48 mA/cm2和-4.52 mA/cm2。

图7 样品的线性扫描伏安图Fig.7 Linear sweep voltammetry of samples
为详细探究样品电化学还原CO2的性能,对其进行恒电压电解测试,不同过电势下CO和H2的FE加和约100%,且未检测到其他产物,说明CO为CO2还原的产物。不同过电势下CO和H2的法拉第效率分别如图8和图9所示,对所有样品,过电势从-0.5 V增加到-0.9 V,CO的法拉第效率先增加后降低,H2的法拉第效率则先降低后升高,CO的法拉第效率在-0.7 V达到最大,此时析氢反应被最大程度抑制,其中SA-800的还原效率最高,CO的FE可达82%,高于SA-700和SA-900的68%和77%。这一结果与文献报道的催化剂性能相当,如Li等[12]以小麦面粉为原料制备的多孔碳催化剂,CO的FE最高为83.7%,Wu等[7]以氮掺杂的碳纳米管制备的催化剂,CO的FE最高为80%,Zhao等[13]合成的镍单原子催化剂催化CO2还原为 CO的FE为71.9%。

图8 样品还原CO2为CO的法拉第效率图Fig.8 Faraday efficiency of CO2 reduction to CO of samples

图9 副产物H2的法拉第效率图Fig.9 Faraday efficiency of byproduct H2
在实际应用中,催化剂的稳定性也是一个较为重要的考虑因素,因此对样品SA-800进行了稳定性测试,结果如图10所示,由于电解液中存在一定电阻,为克服电阻起始还原电流出现波动,随后样品的电流密度在18 h内未出现明显下降,且还原产物的FE保持相对稳定,说明SA-800的稳定性良好,具有潜在的商业使用价值。

图10 样品SA-800的稳定性测试Fig.10 Stability test of SA-800
样品SA-800优异的CO2还原性能可能与其丰富的催化活性位点有关,可以通过电化学活性面积来反映[14]。一般来说,材料的电化学活性面积正比于材料的双电层电容,因此可通过分析不同扫描速度与电流密度的关系求得材料的双电层电容,从而比较其电化学活性表面积。本试验中样品不同扫描速率与电流密度的关系如图11所示。SA-700、SA-800和SA-900的双电层电容分别为14 mF/cm2、27 mF/cm2和20 mF/cm2,即SA-800的双电层电容最大,代表其催化活性位点最多。
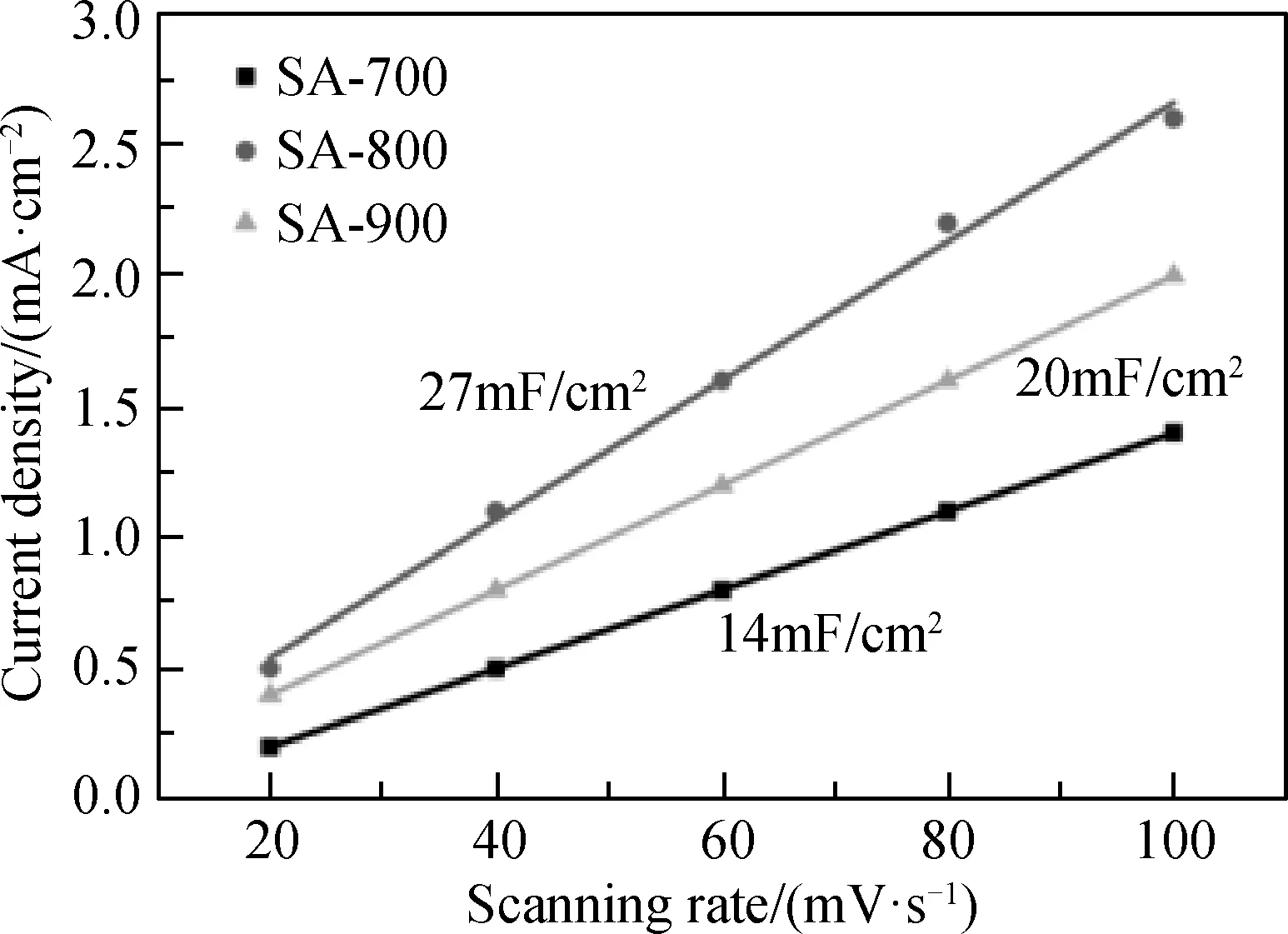
图11 样品的扫描速率与电流密度的关系图Fig.11 Relationship between scanning rate and current density of samples
样品对CO2气体的吸附性能也可用来评价其CO2还原性能,高的CO2吸附量可提供丰富的CO2反应物供还原反应发生[15]。样品在常温常压下的CO2吸附性能如图12所示,SA-700、SA-800和SA-900的CO2吸附量分别为2.61 mmol/g、3.65 mmol/g和3.17 mmol/g,丰富的孔隙率和高的氮含量相互协同,促进了样品吸附CO2的能力。因此大的比表面积为样品提供了丰富的催化活性位点,高的CO2吸附量提供了足够的CO2反应物,二者共同提高了样品的电化学还原CO2能力。

图12 样品的CO2吸附性能图Fig.12 CO2 adsorption performance of samples
3 结 论
(1)以建筑废料——锯末木屑为前驱体,NaNH2为活化剂和氮源,采用一步热解法制备了氮掺杂的多孔碳,将其用作电化学还原CO2反应的催化剂,可在-0.7 V的过电势下将CO2高效还原为CO,FE达82%,且稳定性良好,可稳定催化18 h。
(2)大的比表面积和高的氮含量相互协同,使催化剂具有高的CO2吸附能力,为CO2电化学还原反应的发生提供了丰富的CO2反应物。
(3)这种价廉易得的含氮多孔碳电催化剂为取代贵金属催化还原CO2提供了可能,具有很大的实际应用前景。

