一种淀粉类污垢含酶清洁剂及清洗工艺的研究
陈春旭, 孟闵节, 张 齐, 杨剑婷, 高红梅,杜传来, 郭元新, 李先保*
(1.安徽科技学院 食品工程学院,安徽 凤阳 233100;2.江苏科技大学 粮食学院,江苏 镇江 212004)
随着经济高速发展,人们对食品安全问题日益重视。食品清洗是保证食品安全的重要一环。食品行业内的清洗,主要是遵循相关程序与标准,对肉眼可见的食品污垢,以清水、清洗剂为清洗载体,进行彻底清洗的过程[1]。清洗剂和清洗工艺对清洗效果的影响占主导地位。传统清洗技术主要利用酸碱或酸碱复合清洗剂,如小苏打、氢氧化钠、硝酸等,而在现代清洗技术中,微量、高效、安全的含酶清洁剂正在逐步取代传统清洁剂[2]。常见的食品工业,如在焙烤加工、淀粉产业、饮料产业、糖类制品工业中,淀粉类污垢占有很大的比例。虽然传统清洗工艺使用碱性清洗剂,可以将淀粉部分清除,但是对于淀粉变性后的污垢及当其含有油渍等其他污垢时清洗效果不理想。因此,利用温和无腐蚀的含酶清洁剂,不仅对于淀粉类的污垢有更强的针对性,而且对于生产设备有一定的保护性[3-4]。
α-1,4-D-葡萄糖-葡萄糖苷水解酶(α-淀粉酶)是普遍分布在动物、植物和微生物中的一种重要的淀粉水解酶[5]。其广泛用于各类清洁剂中,几乎90%以上的液体清洁剂中都含有α-淀粉酶[6]。商品化的洗涤剂所用的α-淀粉酶来自于芽孢菌属的微生物,能切断连接淀粉多糖中的α-1,4键产生水溶性的葡萄糖从而去除含淀粉的污垢。此外,α-淀粉酶与大多数洗涤剂成分包括各类表面活性剂、洗涤剂助剂及其他酶制剂兼容,在粉状及液体洗涤剂中都具有较好的稳定性。同时研究还表明,α-淀粉酶与蛋白酶协同作用可以防止因淀粉污垢导致的再沉积[7]。
表面活性剂作为功能性精细化工产品[8],可产生润湿、乳化、增溶及发泡等清洗效果,不但能够降低水的表面张力,改善水对洗涤物表面的润湿性,还可以增强污垢的分散和悬浮能力[9-10]。其中,非离子表面活性剂表面活性较高,水溶液的表面张力低,临界胶束浓度低,胶束聚集数大,增溶作用强。例如,椰子油二乙醇酰胺不但具有使水溶液变稠的特性,而且对大多数类别的油脂都有很强的脱脂力,还可与离子型表面活性剂复配从而具有良好的增效性。而阳离子表面活性剂主要是含氮的有机胺衍生物,具有良好的杀菌,在水中电离后其表面活性基团带有正电荷,例如十二烷基二甲基苄基氯化铵对通常带负电荷的物品有很强的吸附力,从而具有消毒杀菌的作用[11-12]。
基于此,本实验拟以椰子油二乙醇酰胺和苯扎氯铵两种表面活性剂为原料进行复配,添加α-淀粉酶,通过单因素试验和正交试验分析优化得到淀粉污垢清洗的最佳工艺参数,为食品加工行业淀粉类污垢的清洗工艺的发展提供进一步的认识。
1 材料与方法
1.1 供试材料
不锈钢铁片购于思普家仪器有限公司;黄油、植物油均为市售;可溶性淀粉购于天津致远化学品试剂有限公司;α-淀粉酶(>50 U/mg)购于北京鑫达食品添加剂有限公司;无水柠檬酸(>99.5%)购于上海中试化工总公司;苯扎氯铵,椰子油二乙醇酰胺购于麦克林试剂有限公司。
1.2 仪器
101-3-5电热恒温鼓风干燥箱(上海精密试验设备有限公司);FA2004B电子天平(上海精密科技仪器有限公司);JTMX-HH-S24 型电热恒温水浴锅(北京中西泰安技术服务有限公司);SHB-III循环水式多用真空泵(郑州长城科工贸有限公司);JSM-6700F扫描电子显微镜(日本电子株式会社)。
1.3 试验方法
1.3.1 人工淀粉污片的制备 称量5 g可溶性淀粉,2.5 g黄油,2.5 g植物油,混合于磁力搅拌器中搅拌10 min即为淀粉污垢,称取1 g淀粉污垢涂抹于3 cm×3 cm的不锈钢铁片上,95 ℃恒温干燥12 h,取出即为淀粉污片[11-13]。
1.3.2 淀粉转化率测定 根据GB/T5009.7-2008,以亚甲基蓝作为指示剂,采用滴定法测定还原糖含量,根据还原糖含量转化计算出淀粉转化率。
1.3.3 去污率计算 取1片淀粉污片,称量质量,按操作要求清洗,清洗完成后用蒸馏水缓慢冲洗污片,冲洗液置于原液中,将污片放置鼓风干燥箱中干燥12 h,至无水分时,取出称量,再将污片完全洗净干燥后称量[13-14]。
1.3.4 微观结构观察 采用扫描电子显微镜(SEM)观察淀粉污垢在清洗过程中颗粒大小、形态结构变化。将淀粉污垢按要求进行清洗,清洗净后放在恒温干燥箱中干燥12 h至衡重,将样品固定于样品台并喷金,用JSM-6700F扫描电子显微镜(SEM)进行观察淀粉污垢表面状态[15-18]。
1.3.5 单因素试验 取一定量取5%椰子油二乙醇酰胺0、2、4、6、8 mL,5%苯扎氯铵0、1、2、3、4 mL,α-淀粉酶0、0.1、0.2、0.3、0.4 g,用蒸馏水定容至25 mL,并将其倒入装有淀粉污片的烧杯,分别在20、30、40、50、60 ℃恒温水浴锅中,在振荡频率为0、50、100、150、200 r/min的转速下,清洗0、5、10、15、20 min,后用少量蒸馏水清洗污片后放入烘箱干燥12 h,评估不同因素对污片清洗效果的影响。
1.3.6 正交试验 应用正交分析软件设计试验因素和水平,最终获得淀粉类污垢含酶清洁剂的优化工艺条件参数(表1)。

表1 正交试验因素水平
2 结果与分析
2.1 淀粉污片清洗单因素试验结果分析
2.1.1 α-淀粉酶含量对淀粉污片清洗效果的影响 由图1可以看出,在试验条件下,随着α-淀粉酶用量的增加去污率以及淀粉转化率逐渐增大,但当添加量大于0.2 g时,去污率略有下降,淀粉转化率上升速度变缓。
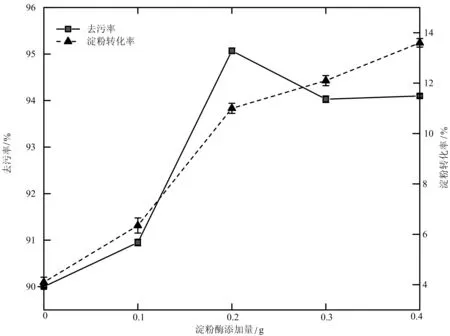
图1 α-淀粉酶添加量对去污率及淀粉转化率的影响
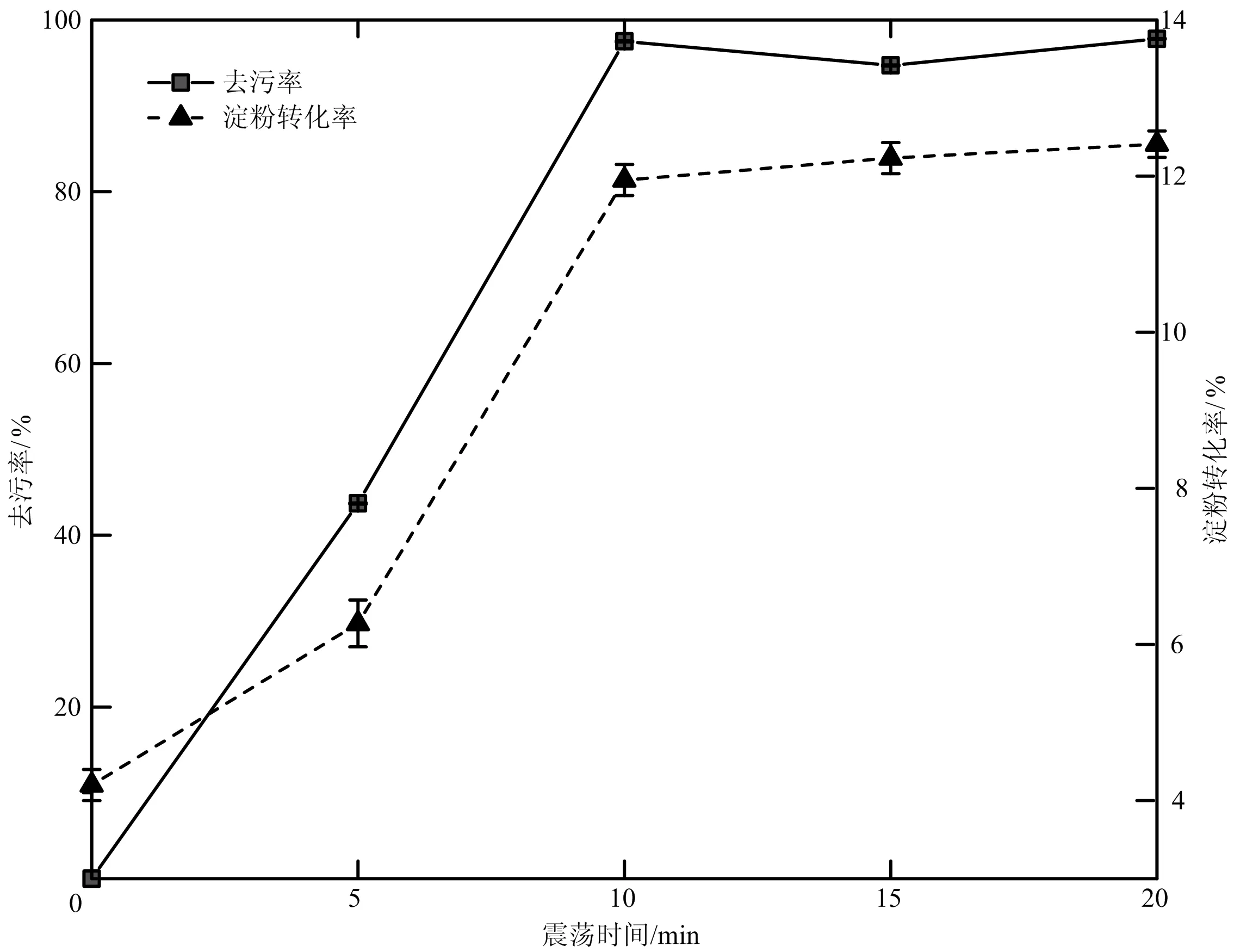
图2 震荡时间对去污率及淀粉转化率的影响
这可能是由于随着酶浓度提高,酶与底物结合越来越充分,反应速率不断加快,而当添加量大于0.2 g时,由于底物浓度降低淀粉转化率上升速率放缓,而且过量的淀粉酶在表面活性剂的影响下吸附于污垢表面,将一些已经分离的油脂重新聚集,使去污率下降。因此,试验选择α-淀粉酶添加量为0.2 g时具有最佳清洗效果。
2.1.2 清洗时间对淀粉污垢清洗效果的影响 从图2可知,随着清洗时间的增加,去污率及淀粉转化率逐渐增大,在10 min之后,去污率基本维持不变,淀粉转化率略有上升。这可能是由于前期污垢在表面活性剂的作用下扩散溶解,在α-淀粉酶的作用下分解,所以去污率与淀粉转化率逐渐升高,而10 min后,当油脂大部分扩散在水中时,此时去污率达到峰值,而其中游离出的淀粉颗粒继续与α-淀粉酶作用,淀粉转化率缓慢升高。比较10 min与20 min时的淀粉转化率,相差不大,但时间增加必然会增加一倍能量损耗,进而增加清洗成本。所以,选择10 min为单因素试验中最佳清洗时间。
2.1.3 温度对淀粉污片清洗效果的影响 由图3可知,随着清洗温度的增加,去污率及淀粉转化率逐渐增大,在40 ℃时,去污率和淀粉转化率达到峰值,随着温度继续升高,去污率基本不变,淀粉转化率反而减小。这可能是因为α-淀粉酶需要适宜的工作温度,当超过最适温度时,随温度升高酶活力开始下降,继续升高温度酶结构遭到破坏,使α-淀粉酶变性失活降低。因此,实验选择40 ℃为最佳清洗温度。
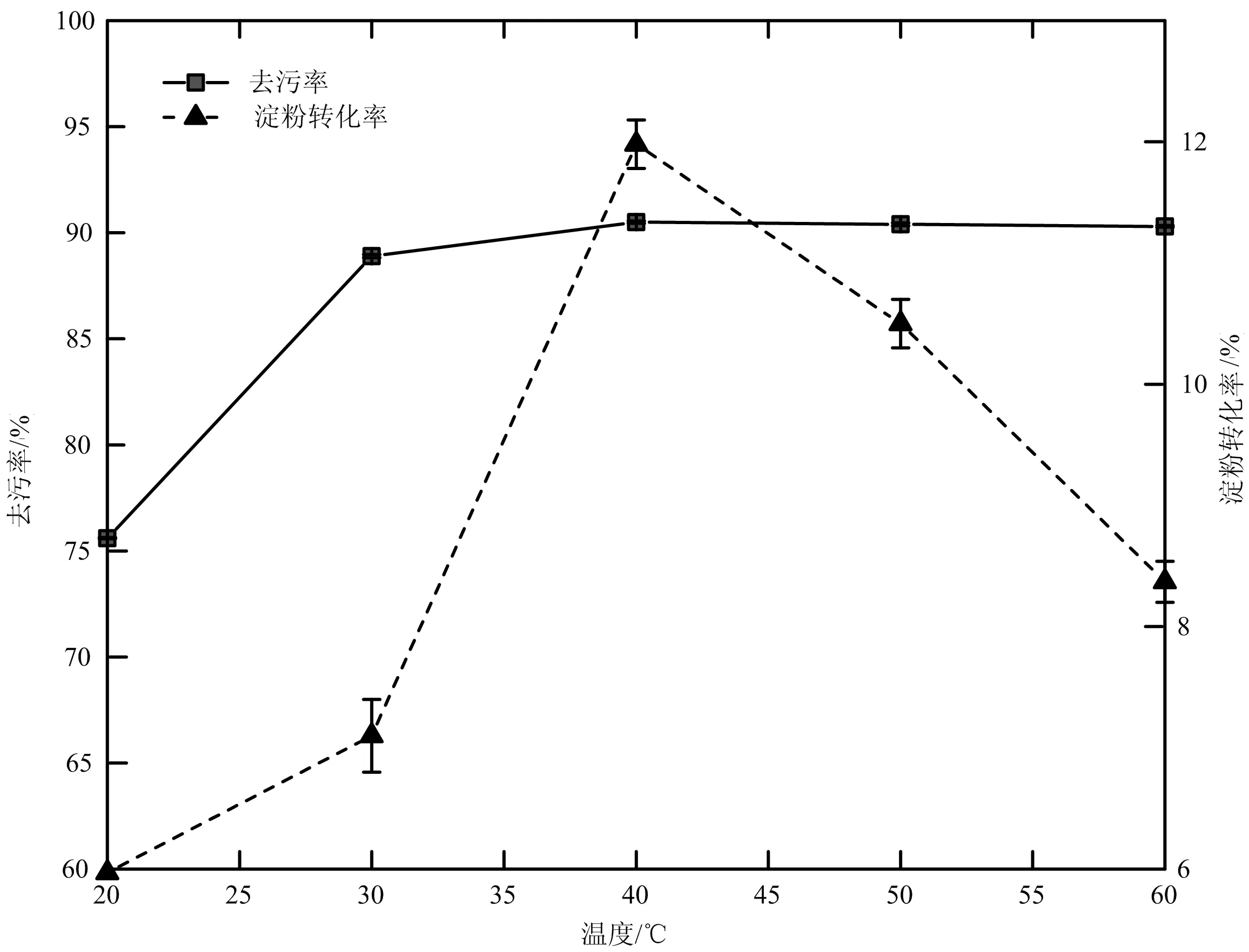
图3 清洗温度对去污率及淀粉转化率的影响

图4 震荡频率对去污率及淀粉转化率的影响
2.1.4 震荡频率对淀粉污片清洗效果的影响 从图4可以看出,随着震荡频率逐渐增大至100 r/min,去污率及淀粉转化率逐渐增大,当震荡频率超过100 r/min时,去污率基本不变,淀粉转化率有小幅升高。这可能是因为震荡有助于淀粉污垢中淀粉扩散至溶液中,增大底物浓度。当震荡频率达到一定程度时,几乎所有的淀粉都从污垢中扩散出来,相应的去污率也相应达到最大,α-淀粉酶利用余留底物,使淀粉转化率小幅的增加。因此,选择100 r/min的震荡频率作为清洗最佳震荡频率。
2.1.5 苯扎氯铵含量对淀粉污垢清洗效果的影响 由图5可知,在试验条件下,随着苯扎氯铵的浓度逐渐增大,淀粉转化率逐渐增加,当苯扎氯铵添加量超过1 mL时淀粉转化率开始下降。而去污率却随着苯扎氯铵浓度增大而逐渐减小,在苯扎氯铵用量大于2 mL时增速降低。这可能是因为当溶液中阳离子表面活性剂浓度过大时会抑制非离子表面活性的作用。同时,选择1 mL作为苯扎氯铵的最佳添加量。
2.1.6 椰子油二乙醇酰胺含量对淀粉污垢清洗效果的影响 从图4可以看出,在试验条件下,随着椰子油二乙醇酰胺的用量逐渐增大,淀粉转化率逐渐增大,当添加量大于6 mL时上升变缓。这可能是因为当溶液中非离子表面活性剂浓度较小时对于清洗抑制作用不明显,浓度过大时会抑制自身的作用。因此,选择5%椰子油二乙醇酰胺最佳用量为6 mL。

图5 苯扎氯铵添加量对去污率及淀粉转化率的影响
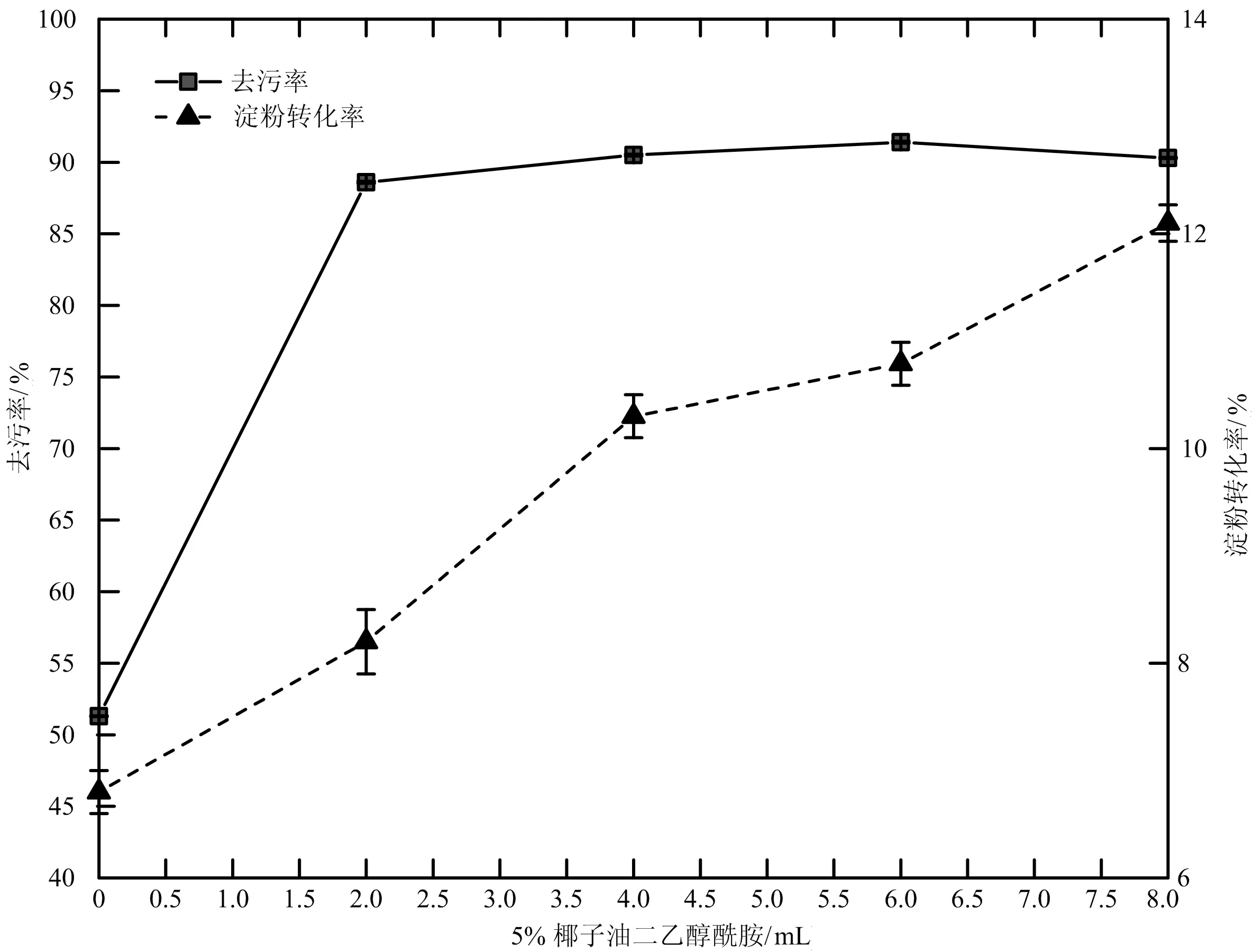
图6 椰子油二乙醇酰胺对去污率及淀粉转化率的影响
2.2 正交试验设计结果及分析
按照上述提取工艺,在多次单因素实验基础上,本文选择苯扎氯铵用量、α-淀粉酶用量、椰子油二乙醇酰胺用量、震荡频率作为研究对象,以淀粉转化率及去污率为考察指标,按照L9(34)进行四因素三水平的正交试验,对于淀粉污垢的清洗工艺参数进行优化,正交试验结果显示如表2所示。
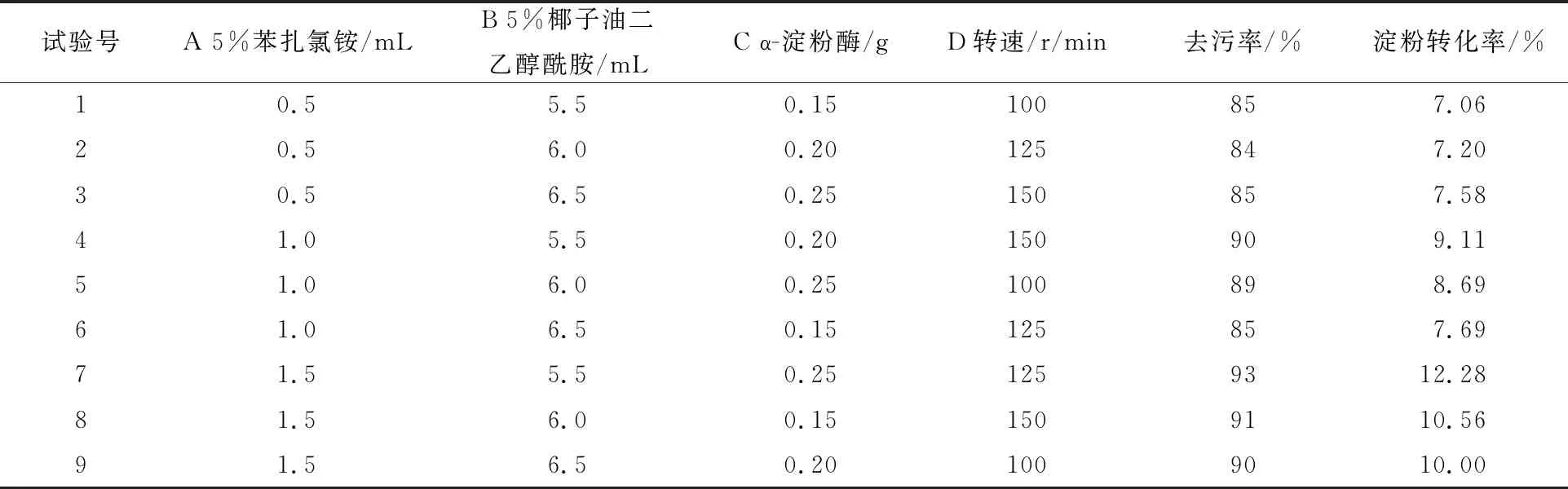
表2 正交实验结果
采用极差法对正交试验结果进行分析,分析结果见表3~4。结果表明,苯扎氯铵对去污率的影响最大,椰子油二乙醇酰胺次之,其后是α-淀粉酶用量,最后是震荡频率。对于淀粉转化率的影响,苯扎氯铵最大,其次是α-淀粉酶用量,椰子油二乙醇酰胺,震荡频率影响最小[15-16]。综合来看,不同考察指标影响差别主要在于α-淀粉酶与椰子油二乙醇酰胺,从表中可以看出,α-淀粉酶用量和椰子油二乙醇酰胺对淀粉转化率的影响几乎一致,而且两者都不是主要影响因素。所以,最优组合为A3、B1、C3、D3,即苯扎氯铵用量1.5 mL,椰子油二乙醇酰胺用量5.5 mL,α-淀粉酶用量0.25 g,震荡频率150 r/min。
由于此优化的条件在正交实验表中并未出现,因此进行验证实验。量取5%椰子油二乙醇酰胺5.5 mL,5%苯扎氯胺1.5 mL,α-淀粉酶0.25 g,用蒸馏水定容至25 mL,并倒入放入淀粉污片的烧杯中,将烧杯放入40 ℃恒温水浴锅中,在转速150 r/min的转速下,清洗10 min。清洗后用少量蒸馏水清洗污片后放入烘箱干燥12 h。对于清洗液过滤后测定其去污率及淀粉转化率。结果如表5所示,重复3次实验得到去污率为94.02%±0.10%,淀粉转化率为13.65%±0.35%。由此验证了正交试验所得实验结果的正确性。
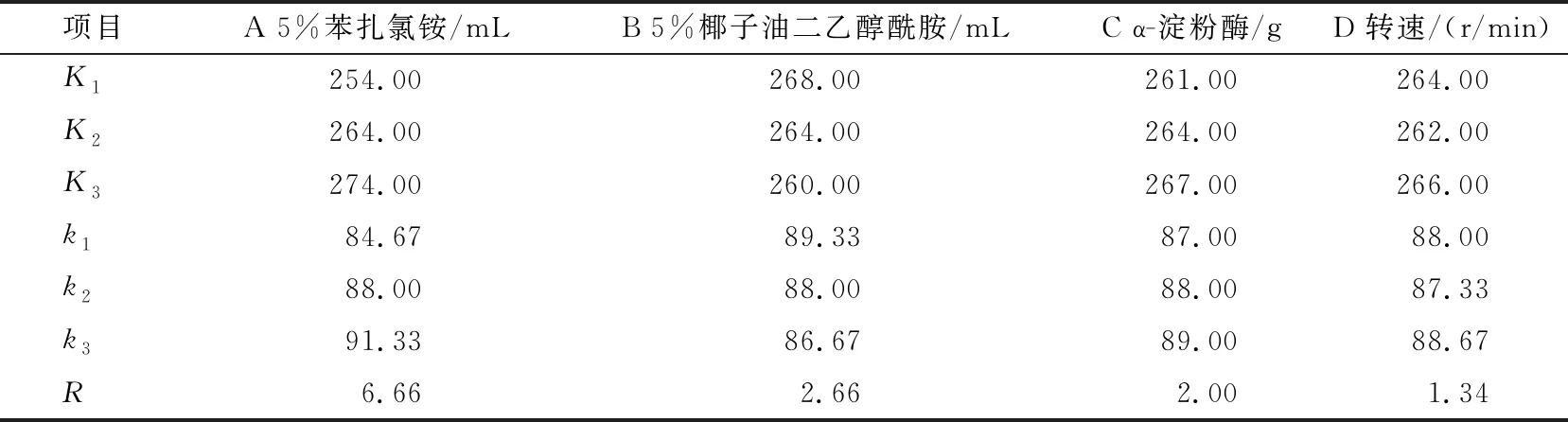
表3 去污率极差分析表
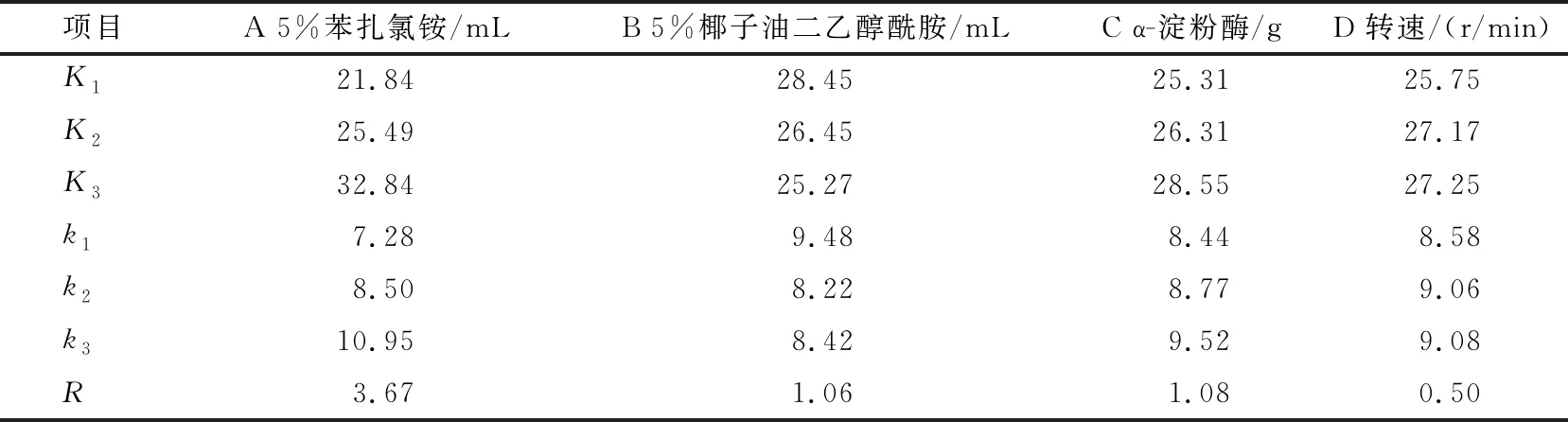
表4 淀粉转化率极差分析表

表5 验证试验结果
2.3 淀粉污垢处理扫描电镜
从图7a、b可以看出,淀粉小分子大部分颗粒饱满,成卵形,有轻微粘连在一起,成小块聚集。从图7c、d可以看出,淀粉小分子部分颗粒饱满,能看出小分子性质,分子粘连现象较为明显。由图7e、f可以看出,淀粉小分子出现空洞,颗粒间渐渐出现空隙。由图7g、h可知,空洞逐渐增大,小分子聚集成网状,大块颗粒逐渐解离。这主要是因为随着清洗时间的延长,含α-淀粉酶的清洁剂逐渐破坏其淀粉分子结构,使大分子逐渐分解为小分子,游离在溶液中[17-19]。

图7 淀粉污垢处理扫描图Fig.7 SEM of decontamination of starch dirt
3 结论与讨论
研究结果表明,当5%苯扎氯铵添加量为1.5 mL,5%椰子油二乙醇酰胺添加量为5.5 mL,α-淀粉酶添加量为0.25 g,以纯水定容至25 mL后,在震荡频率为150 r/min,清洗温度为40 ℃,清洗时间10 min的条件下对淀粉类污垢具有最佳的清洗工艺。此外,正交试验结果表明,苯扎氯铵对于淀粉污垢清洗效果影响最大,椰子油二乙醇酰胺和α-淀粉酶次之,震荡频率对其影响最小。不同类型的表面活性剂对生物酶有着不同的影响[19-20]。非离子表面活性剂在临界胶束浓度以下,可以提高生物酶的反应速率促进清洗作用,但是当在临界胶束浓度以上时,会抑制清洗效果。阳离子表面活性剂在低浓度时,对酶活性影响不大,而阴离子表面活性剂则较易抑制生物酶的活性,影响清洗效果。本研究的复配型清洗剂在优化条件下对于淀粉类污垢具有良好的去污性。对食品加工行业淀粉类污垢的清洗工艺有一定的理论指导意义。
——头发

