响应面法在灵芝深层发酵产灵芝酸优化中的应用
鲍 锐, 陈中凯, 刘 玲, 王松华
(安徽科技学院 生命与健康科学学院,安徽 凤阳 233100)
灵芝[Ganodermalucidum(Fr.) Krast]在中国、日本和韩国等亚洲国家有两千多年的应用历史。其既可以食用,又可以入药,具有强健精神、活血通经、延年益寿、美容等效果。灵芝子实体中含有多种活性成分(三萜类、多糖类、甾醇类、氨基酸类、生物碱类、有机锗等),在民间称为“灵丹妙药”或者“仙草”[1],其中灵芝酸是野生或人工栽培的灵芝子实体、孢子粉、菌丝体中的主要的天然药理活性物质。后者为一种高度氧化的四环三萜类甾醇化合物,具有抗癌症、抗HIV、抗衰老、抗氧化、降血糖、降血脂和降血压等药理和生理功能,在临床医疗和日常卫生保健方面有着广阔的应用前景和市场需求量[2]。目前,在医疗保健行业中灵芝酸提取的主要来源是灵芝子实体,由于野生灵芝越来越少,不得不采用人工栽培方法培养灵芝子实体。然而,在不同生长环境条件下栽培出来的灵芝活性成分存在差异而导致药理作用不同,质量无法保证,且耗工、耗时、生长周期长。灵芝酸的另一种来源是从液体发酵培养获得的菌丝体中提取,该法的优点是培养条件易控制、耗时短、活性成分稳、灵芝酸纯度高等。然而,常规液体发酵培养产生的菌丝体生物量和灵芝酸含量偏低,仍然无法满足工业规模化生产和日益增长市场需求,从而大大地制约了灵芝酸在医疗保健领域的广泛应用。对液体发酵法产灵芝酸的研究表明,在灵芝菌丝对数生长期之后向培养基中添加一定浓度的外源物质如褪黑素、一氧化氮、木质素、乙酸、钙离子和铜离子等均能够促进灵芝酸的生物合成[2-4]。然而,相关分研究结果只涉及灵芝酸浓度的改变,而对于深层发酵灵芝酸产量是否提高关注较少。
本文在单因素试验的基础上,采用Design Expert设计试验,对CaCl2、CuSO4和褪黑素(melationin)等3种诱导剂浓度进行优化,采用响应面法(Response Surface Methodology)对研究结果进行分析,获得因子最佳组合方案,目的是在增加灵芝酸浓度的同时也提高菌丝体生物量,从而实现灵芝酸产量增加,为其发酵工业应用提供理论参考。
1 材料与方法
1.1 材料
灵芝菌种(Ganodermalucidum)由安徽科技学院生物技术实验室保存。
1.2 菌种培养
菌种活化:将保存的灵芝菌种接种于由琼脂 15 g/L、蛋白胨10 g/L、葡萄糖20 g/L、马铃薯200 g/L组成的斜面培养基中,在28 ℃恒温箱中培养7 d;种子培养基培养:将活化的菌丝接种至由酵母浸出粉10 g/L、玉米粉4 g/L、马铃薯200 g、KH2PO41 g/L、MgSO41 g/L、蛋白胨10 g/L、葡萄糖20 g/L组成的种子液培养基中,于28 ℃,150 r/min恒温摇床中培养8 d,用分散器打碎。
1.3 试验设计及处理
1.3.1 单因素试验设计 在基础培养基(MgSO40.5 g/L、蛋白胨10 g/L、葡萄糖20 g/L、KH2PO41 g/L、水1 000 mL、pH自然)中按接种量5%接种,250 mL三角锥形瓶中装液量100 mL,28 ℃,150 r/min培养4 d后,添加50、100、200、400、600、800 μmol/L氯化钙溶液,或者添加50、100、200、400、600、800 μmol/L硫酸铜溶液,或者添加10、20、30、50、100、200 μmol/L褪黑素溶液。于28 ℃,150 r/min继续培养4 d,发酵液离心,收集菌丝体。对照组接种量以5%接种在基础液体培养基;28 ℃,150 r/min,培养8 d。
1.3.2 响应面最优试验设计 配制基础液体培养基并分成18组,在前期单因素实验基础上,应用Design Expert软件设计,得出各组诱导剂浓度试验方案。按接种量5%接种;250 mL三角锥形瓶中装液量100 mL,28 ℃,150 r/min培养4 d后,加入100 mmol/L褪黑素母液、1 mol/L CaCl2母液和1 mol/L CuSO4母液,使终浓度达到试验方案中各组对应的浓度,于28 ℃,150 r/min继续培养4 d,发酵液离心,收集菌丝体。

表1 响应面试验因素及水平表
1.4 生物量测定
将灵芝菌丝发酵液及菌丝体置于离心管中,在5 800 r/min离心8 min,丟弃上清液,将菌丝体沉淀置于-50 ℃真空冷冻机中干燥至恒重,研磨为粉末,称量即得生物量。
1.5 标准曲线制定
精密称取5.0 mg熊果酸(分析纯),溶解于50.0 mL色谱纯乙醇中,充分混匀即为100 mg/L熊果酸标准液。取0.10、0.20、0.40、0.60、0.80、1.00 mL熊果酸标准液于15 mL试管(加盖),于室温下挥发掉乙醇,添加5%香草醛-冰乙酸0.40 mL、高氯酸1.0 mL,在加热65 ℃下15 min,室温下静置15 min,添加预冷冰乙酸5.0 mL,盖紧试管盖上下颠倒充分摇匀,室温下静置20 min,在547.5 nm波长下测定吸光度,以吸光度为横坐标、熊果酸质量分数(mg/L)为纵坐标绘制标准曲线,标准曲线方程:y=0.007 4x+0.084 2(R2=0.996 2)。
1.6 灵芝酸提取与测定
准确称量干燥菌丝粉末0.1 g,加入10 mL 100%乙醇,常温超声波3 h,6 000 r/min 离心,20 min,小心量取上清液5 mL,再次浸提3次,将所有的上清液合并混匀。按照制作标准曲线的方法测量菌丝粉末中灵芝酸含量S,并通过以下公式计算灵芝酸产量:G=S×H/(P×V)(G:灵芝酸产量,mg/L;S:样品灵芝酸含量mg/g;H:菌丝体总干重g;V:发酵液体积L;P:样品干重g)。
1.7 数据分析
采用Design-Expert 8.0.5软件设计试验方案,数据统计使用SPSS 19.0分析软件。
2 结果与分析
2.1 不同浓度CaCl2、CuSO4和褪黑素对深层发酵灵芝酸产量的影响
在扩大培养第4天时分别加入不同浓度的CaCl2、CuSO4和褪黑素作为诱导剂,培养至第8天收获,测定菌丝体生物量和灵芝酸含量,并计算灵芝酸产量。
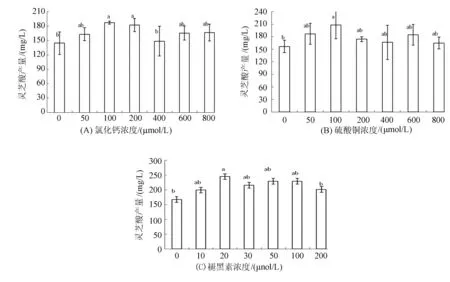
图1 不同浓度CaCl2、CuSO4和褪黑素对灵芝酸产量的影响
结果表明,CaCl2浓度为100和200 μmol/L时,灵芝酸产量(图1A)显著提高,达到187.061 mg/L和182.407 mg/L,是对照组的1.29和1.26倍;发酵液中CuSO4为100 μmol/L时,灵芝酸产量比对照组增加了57%,在CuSO4试验浓度范围内为最大值(图1B);褪黑素浓度在10~100 μmol/L时,灵芝酸产量均(P<0.05)大于对照组(图1C),灵芝酸产量最高(244.528 mg/L)时的褪黑素浓度为20 μmol/L(图1C)。鉴于此,响应面法设计选取CaCl2浓度为100~200 μmol/L、CuSO4浓度为50~100 μmol/L、褪黑素浓度为10~20 μmol/L。
2.2 氯化钙、硫酸铜、褪黑素对灵芝酸产量的影响
根据以上单因素试验,以A(CaCl2)、B(CuSO4)、C(褪黑素)等为三个影响因素,进行三因素三水平试验(表1),使用Designer-Expert 8.0.5 软件设计共17个试验组,进行灵芝菌丝体培养,测定灵芝酸含量和菌丝生物量,计算灵芝酸产量Y作为响应值,并进行数据拟合,研究结果如表2所示。
使用 Designer-Expert 8.0.5 软件对试验数据进行统计分析,得到A(CaCl2)、B(CuSO4)、C(褪黑素)为自变量、灵芝酸产量(YGA)为因变量的二次多项式回归方程为:
YGA=406.75+3.77A+10.33B+9.08C-12.26AB-0.57AC-27.46BC+13.33A2+1.83B2+1.60C2

表2 响应面分析试验结果
为研究影响灵芝酸产量的3种诱导剂之间的相互作用关系,确定其对深层发酵灵芝酸产量的影响程度,检测二元回归方程准确性,使用 Designer-Expert 8.0.5 软件对二元回归方程进行方差分析。由表3可知,二元回归方程模型达到极显著水平(P<0.01),失拟项0.336 2,表示失拟性在水平上不显著,该模型选取合适;方程复相关系数R2为0.919 7,说明该模型能解释91.97%响应值的变化,表明该模型拟合程度较好,可以采用该模型对灵芝酸产量进行分析和预测。从表中F值和P值可以看出,CuSO4(A)对灵芝酸产量的影响程度最大,褪黑素(C)次之,CaCl2(B)影响最小;褪黑素(C)和CuSO4(A)对灵芝酸产量影响达到极显著水平,CaCl2(A)则不显著。此外,A、B、C对灵芝酸产量的影响不是简单一次函数关系,交互项AB和BC对灵芝酸产量的影响达到显著水平,表明CaCl2与CuSO4之间互作(AB)、CuSO4与褪黑素之间的互作(BC)对深层液体发酵灵芝酸产量有显著影响。
图2A为影响灵芝酸产量的CaCl2浓度固定为零水平,即CaCl2浓度为150 μmol/L时,CuSO4和褪黑素交互作用对灵芝酸产量影响。由图2A可知,曲面较陡,二者交互作用等高线沿CuSO4轴方向变化相对密集,等高线呈明显曲面,表明其交互作用强。图2B为CuSO4浓度固定为零水平,即CuSO4浓度为75 μmol/L时,CaCl2和褪黑素交互作用对灵芝酸产量影响,CaCl2曲面平滑,表明对灵芝酸产量无显著影响,而褪黑素浓度对灵芝酸产量的影响较显著(图2B)。图2C为褪黑素浓度固定为零水平,即褪黑素浓度为15 μmol/L时,CaCl2和CuSO4交互作用对灵芝酸产量影响,其中CuSO4曲面较陡,表明其灵芝酸产量的影响较显著,而CaCl2浓度曲面平滑,对灵芝酸产量无显著影响。分析软件Designer-Expert 8.0.5得出最佳灵芝酸产量试验方案为:褪黑素20 μmol/L、CaCl2200 μmol/L、CuSO450 μmol/L,预测灵芝酸产量为465.19 mg/L。
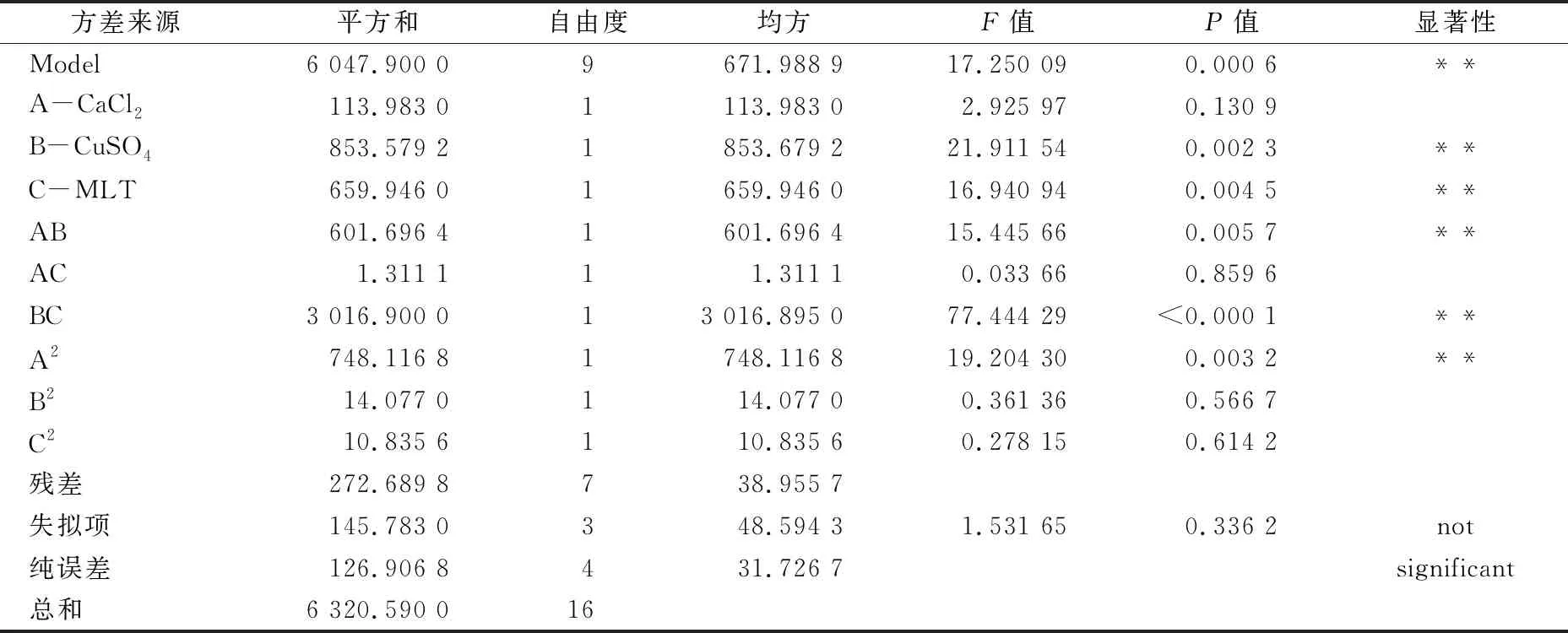
表3 回归模型方差分析

图2 CaCl2、CuSO4和褪黑素对灵芝酸产量的交互影响
2.3 试验验证
对优化得到的预测结果进行试验验证,在培养4d时向灵芝液体培养基添加200 μmol/L氯化钙、50 μmol/L硫酸铜、20 μmol/L褪黑素(试验组),对照组不添加任何诱导剂,各设置3个平行组试验,继续培养至8 d,得到对照组灵芝酸平均产量为156.42 mg/L,试验组灵芝酸平均产量为451.92 mg/L,与理论预测值接近(相对误差0.29%),且高于表2试验结果的灵芝酸最高产量444.63 mg/L,证明响应面优化的深层液体发酵灵芝酸产量模型可行。
3 结论与讨论
在液体培养基中添加外源物质(如金属离子Mn2+、Cu2+、Ca2+,植物激素水杨酸、茉莉酸甲酯、一氧化氮等)促进植物和微生物次生代谢产物生物合成是现代农业和医疗保健领域研究的热门课题[5]。近年来的文献报道显示,在灵芝深层液体发酵过程中添加适量的外源物质能不同程度地提高灵芝酸含量和菌丝体生物量[2,6]。Zhang等[7]在培养液中入5 mg/L的纤维酶(cellulase)能显著提高灵芝酸含量和灵芝酸产量,分别达到3.55 mg/100 mg和1 252.7 mg/L;10 mmol/L Ca2+显著提高灵芝酸-Mk、T、S、Me等的含量[8],菌丝体总灵芝酸含量比对照组高278%, 灵芝酸生物合成途径中的关键酶基因GL-sqs、GL-hmgr、GL-ls表达均有不同程度的显著上调;Tang等[9]的研究表明,在深层发酵培养灵芝菌丝至第4天时添加1 mmol/L Cu2+能够提高灵芝酸含量。然而本研究的结果表明,50~100 μmol/L Cu2+和100~200 μmol/L Ca2+能显著提高灵芝酸产量(图1A、图1B),高浓度的Cu2+和Ca2+离子则抑制灵芝酸的生物合成。这可能是因为,Tang等[9]是采用两阶段培养方法,先摇床培养再进行静置培养,在静置培养阶段施以Cu2+或者Ca2+进行处理。我们前期研究发现,在深层发酵培养灵芝菌丝至第4天时添加20 μmol/L褪黑素能够显著提高灵芝酸含量和产量[10]。
本文采用响应面优化法研究了Ca2+、Cu2+、褪黑素3个诱导剂因素相互作用对灵芝深层发酵灵芝酸产量的影响,同时对三个因素三个水平及其交互作用进行优化与评价,快速准确地确定深层发酵灵芝酸产量达到最大值的条件为褪黑素20 μmol/L、CaCl2200 μmol/L、CuSO450 μmol/L,灵芝酸产量为451.92 mg/L。本研究的结果显示,Ca2+、Cu2+、褪黑素三者对于对于灵芝酸产量的影响,存在着交互作用,这可能与三者在灵芝酸生物合成信号转导途径中处于不同上下游位置有关系。有研究表明,Ca2+是动植物和微生物中广泛存在的第二信号分子,在生物细胞面对各种纷繁复杂快速变化的环境因子应答信号转导途径中发挥着枢纽作用,参与真菌分生孢子形成、形态分化和次生代谢产物的生物合成等过程[11]。 Xu等[8]的研究表明,Ca2+通过钙调蛋白(CaM)依赖的钙调神经磷酸酶信号转导途径诱导3个灵芝酸生物合成关键酶基因的表达,进而调控灵芝酸的生物合成。在灵芝液体深层发酵培养基中加入Cu2+、Na+和Mn2+等金属离子可以引起细胞钙内流,进而上调灵芝酸生物合成。目前,有关灵芝酸生物合成信号转导的研究均发现,Ca2+通常位于水杨酸(SA)、茉莉酸甲酯(MeJA)、活性氧(ROS)和金属离子等信号分子的下游,信号传递链大致如下:Cu2+、Na+和Mn2+等金属离子-Ca2+离子-Ca·CaM(钙调素蛋白)-钙调神经磷酸酶-灵芝酸生物合成关键酶基因(GL-sqs、GL-hmgr、GL-ls)-灵芝酸, 或者是:SA/MeJA-ROS-Ca2+离子-Ca·CaM(钙调素蛋白)-钙调神经磷酸酶-灵芝酸生物合成关键酶基因(GL-sqs、GL-hmgr、GL-ls)-灵芝酸[12]。由此可见,在诱导灵芝酸生物合成的信号传递链中,Ca2+离子与Cu2+离子存在着协同关系,Ca2+位于Cu2+的下游,这与本研究A(CaCl2)、B(CuSO4)之间存在互作相一致,具体分子生物学机制尚待进一步研究。

