水杨酸和脱落酸浸种对低温下扁蓿豆种子萌发和幼苗生长的影响
李 颖,鱼小军,赵一珊,王 琳,彭 珍,范丽花,王玉霞,马晓东
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃省草业实验室,甘肃 兰州 730070)
扁蓿豆(Medicagoruthenica)一种多年生轴根性中旱生豆科(Leguminosae)牧草,生态适应性广、抗旱抗寒、耐瘠薄、营养价值较高,对改良天然草场、建立人工草地、提高草原生态系统中的氮素水平有重要意义[1]。扁蓿豆通常栽植于高寒草甸、高寒草原等地区[2],其在早春栽植过程中常遭遇持续低温危害,导致出苗不齐、出苗期推迟等不良现象,这不仅影响幼苗的生长,更对群体的建成极其不利[3]。种子萌发和幼苗生长是植物生长周期中生理代谢最旺盛、最敏感的阶段[4],低温可能会损害其生长,甚至不能完成生命周期,使植物的形成变得不可行。为此,寻求扁蓿豆抗寒的途径和方法对提高扁蓿豆在低温条件下的快速萌发和幼苗生长具有重要意义。
近几年来,对外源物质缓解环境胁迫下种子萌发的研究引起了众多学者的研究兴趣,国内外报道很多[5-8],选用的外源物质有水杨酸(salicylic acid,SA)、脱落酸(abscisic acid,ABA)、2,4-表油菜素内酯(2,4-epibrassinolide,EBR)和赤霉素(gibberellin acid,GAs)等。水杨酸(SA)在调控植物抗寒冷性上有重要作用,当植物抵御寒冷环境时,它可激活植物超敏反应(Hypersensitive response,HR)和系统获得性抗性(Systemic acquired resistance,SAR)[9],从而影响植物种子萌发。研究证实[10-13],一定浓度的SA可促进棉花(Gossypiumspp)、黄秋葵(Abelmoschusesculentus)、辣椒(Capsicumannuum)、玉米(Zeamays)等种子发芽且增加根长和芽长,其中,提高不同植物种子抗寒冷性的最佳浓度不同。脱落酸(ABA)在植物干旱、高盐、低温等逆境胁迫反应中起重要作用,是植物的抗逆诱导因子,也被称为植物的“胁迫激素”[14]。崔华威[15]的研究表明,1 g·L-1ABA浸种处理可提高低温下烟草(Nicotianatabacum)种子发芽势、发芽率、发芽指数和活力指数,杨晓娟等[16]在不同ABA浓度对冬油菜(Brassicacampestris)处理中表明低浓度ABA浸种促进种子萌发和幼苗生长,而高浓度有抑制作用。
目前,外源物质添加对扁蓿豆种子萌发的研究多集中于干旱胁迫条件下,研究结果表明,适度的一氧化氮、水杨酸(SA)预处理对其种子萌发和分枝期的生长有促进作用[17-18]。然而,在低温胁迫下,SA和ABA浸种对扁蓿豆种子萌发和幼苗生长的影响尚未见报道。因此,本研究以扁蓿豆为试验材料,通过不同浓度的SA和ABA浸种来探索其在低温条件下对种子萌发和幼苗生长的影响,从而筛选出低温下提高扁蓿豆种子发芽能力的SA和ABA的最佳浓度,旨在为高寒地区扁蓿豆的早春栽植和外源激素在农业生产中的应用提供参考。
1 材料与方法
1.1 试验材料
供试扁蓿豆种子于2018年9月采收于甘肃省武威市黄羊镇甘肃农业大学牧草试验站,试验站地理位置为103°15′ E,37°30′ N,海拔1 660 m,属于内陆性气候,干旱少雨,日照充足,蒸发量大;年均气温8℃,最高温39.5℃,最低温—26.5℃。年均降水量154.6 mm,多集中在7,8,9月。土壤为粉砂壤棕钙土,有机质含量为10.38~10.60 g·kg-1,全氮含量为5.37~7.07 g·kg-1、全磷含量为3.03~3.32 g·kg-1、速效钾含量为69.94~119.95 mg·kg-1;pH值为8.67~8.70[19]。
1.2 试验设计
试验前先采用98%的浓硫酸浸泡扁蓿豆种子15 min,然后流水冲洗3次[20],再以不同浓度的SA和ABA溶液于室温下分别浸种12 h,对照(CK)采用蒸馏水浸种12 h。SA处理浓度分别为0.1,0.5,1,5,10,20,50和100 μmol·L-1,分别记为S1~S8;ABA处理浓度分别为0.001,0.01,0.05,0.1,0.5,1,2和5 μmol·L-1,分别记为A1~A8,SA和ABA分别设有8个浓度梯度,共17个处理,每处理重复3次。试验于2019年在草业生态系统教育部重点实验室进行。种子萌发采用培养皿滤纸法,待浸种完成后挑选籽粒大小一致饱满的扁蓿豆种子,置于铺有2层滤纸的培养皿内,每个培养皿50粒。置于人工气候培养箱中,培养条件为光照12 h·d-1,黑暗12 h·d-1,模拟天祝高寒区5月初的情况,温度设置为5℃ 12 h,15℃ 3 h,20℃ 2 h,25℃ 2 h,20℃ 2 h,15℃ 3 h这 6个区段循环交替进行。发芽期间每日定时补充水分以保持滤纸湿润。
1.3 测定指标及方法
以置入培养皿的第2 d为种子开始萌发的第1 d,逐日定时记录发芽情况(以胚根伸出并达到种子长度的1/2为标准),在3 d时测定发芽势,7 d测定发芽率、发芽指数、活力指数,发芽结束后每个培养皿随机选取10株幼苗测定根长和芽长[21]。
发芽势(GE)=(发芽试验初期规定日期内发芽种子数/供试种子数)×100%;
发芽率(GP)=(发芽试验末期规定日期内发芽种子数/供试种子数)×100%;
发芽指数GI=∑Gt/Dt;
活力指数VI=GI×S。
其中Dt为发芽时间(d),Gt为与Dt相对应的发芽种子数,S为一定时期内正常幼苗的单株长度[22]。
1.4 数据分析
采用Microsoft Excel 2010进行数据整理,采用SPSS 20.0软件对所测数据统计分析,对SA和ABA处理下的扁蓿豆种子萌发指标分别进行单因素方差分析,并用LSD法对各不同浓度下种子萌发指标测定数据进行多重比较,差异显著性水平均为0.05,采用Excel 2010制图,所有试验数据以平均值±标准误表示。
采用模糊数学隶属函数法进行SA和ABA浸种下低温效应的综合评价,计算发芽期和苗期6项指标的隶属值,将其平均值作为最终评价指标。计算方法为:
Wji=(Xji-Xjmin)/(Xjmax-Xjmin)
(1)
(2)
公式(1)中Wj,i为第j,i水平指标的得分,Xj,i为第i水平第j个观测指标值,Xjmin为第j个观测指标的最小值,Xjmax为第j个观测指标的最大值,n为观测指标数,Wi为第i水平的综合隶属值。
2 结果与分析
2.1 SA和ABA浸种对低温下种子初次发芽天数、发芽势和发芽率的影响
除S8和A8外,所有处理均是第二天初次发芽,由于S8和A8处理在整个试验期间均不萌发,因此在以下统计分析图中均不呈现。整个发芽试验中,未见不正常幼苗。不同浓度SA和ABA处理对扁蓿豆发芽势和发芽率的影响趋势均为先升后降(图1)。SA处理中,S4下扁蓿豆发芽势最高,但较对照差异不显著。ABA处理中,A1~A4的浓度均促进扁蓿豆种子低温下发芽势的增加,其中在A3处理中达到最高为84%,较对照提高了16.7%,差异显著(P<0.05)。
与对照组相比,SA处理中,S1,S3,S4,S5均促进扁蓿豆种子萌发且差异显著(P<0.05),其中在处理S4中达到最高;ABA处理中,A2是提高种子发芽率的最佳浓度,A3次之,但两者差异不显著,A1~A6处理均促进发芽率的增加。
2.2 SA和ABA浸种对低温下扁蓿豆根长和芽长的影响
如图2所示,SA和ABA对于扁蓿豆在低温胁迫下根长和芽长的影响大体趋势为先增后减。S1~S5浓度均促进芽伸长,各浓度之间差异不显著,S4是促进根伸长的最佳浓度处理,较对照增加了28.78%,差异显著(P<0.05)。A3是促进芽伸长的最佳浓度,A5次之,较对照分别增加了59.34%和45.02%,差异显著(P<0.05)。和对芽长影响结果一致,不同ABA浓度对根长的影响也是在A3和A5处理中效果最佳,较对照增加了27.76%和29.22%(P<0.05)。
2.3 SA和ABA浸种对低温下扁蓿豆发芽指数和活力指数的影响
如图3所示,在SA处理中,与对照相比,S2,S4显著提高扁蓿豆种子的发芽指数(P<0.05),其中S4是提高种子发芽指数的最佳处理,S2次之,而S7处理较对照显著降低71.55%(P<0.05),降幅明显。在ABA处理中,A1~A4处理下发芽指数较对照分别提高了9.1%~18.49%,其中A3处理下的发芽指数最高,较对照差异显著(P<0.05)。
不同SA处理浓度对扁蓿豆的活力指数呈先增后降的趋势,处理S1~S4种子活力指数较对照差异显著(P<0.05),其中处理S4增加了46.84%,是促进扁蓿豆活力指数的最佳处理,而高浓度(>20 μmol·L-1)的SA处理则抑制种子的活力指数。在ABA处理中,处理A3为最佳浓度处理,种子的活力指数较对照增加了66.74%,差异显著(P<0.05)。
2.4 综合评价
采用模糊数学隶属函数法对SA和ABA各浓度处理的应用效果进行综合评价(表1)。结果表明,A3浸种处理的效果最好,S4和A4浸种处理效果较好,综合隶属平均值位于第2和第3。较CK而言,S1~S6和A1~A5浸种处理均能促进低温下种子的萌发,S7,A6和A7浸种处理均抑制种子萌发。
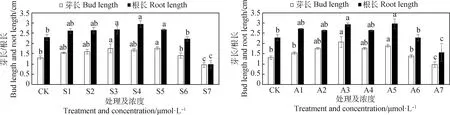
图2 不同SA和ABA浸种对扁蓿豆根长和芽长的影响Fig.2 Effects of soaking seeds with different SA and ABA on root length and bud length of Medicago ruthenica
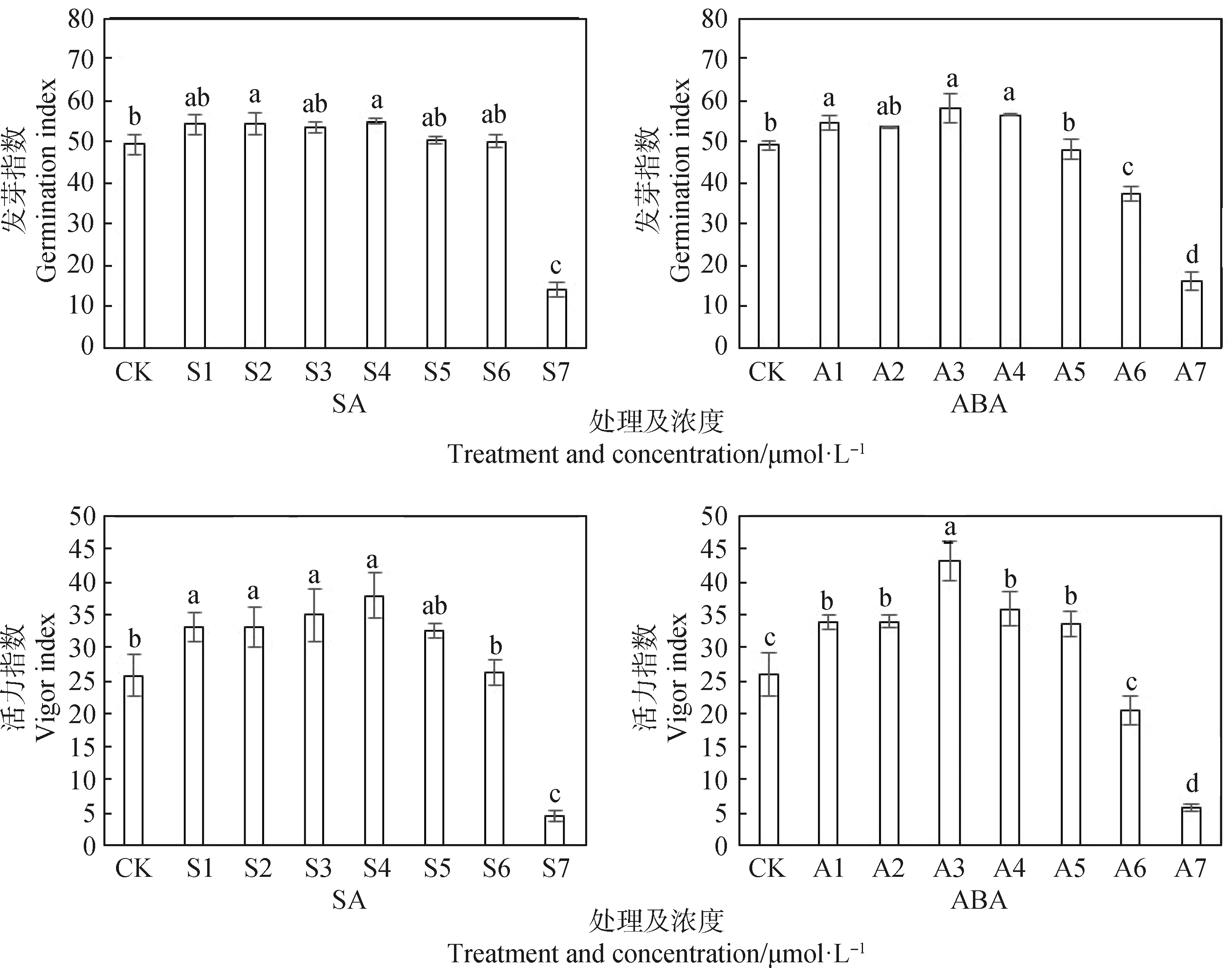
图3 不同SA和ABA浸种对扁蓿豆发芽指数和活力指数的影响Fig.3 Effects of soaking seeds with different SA and ABA on germination index and vigor index of Medicago ruthenica

表1 不同SA和ABA浸种对低温条件下扁蓿豆种子萌发的综合评价Table 1 Comprehensive evaluation of soaking seeds with different SA and ABA on germination of Medicago ruthenica at low temperature
3 讨论
3.1 SA和ABA浸种对低温下扁蓿豆种子萌发的影响
种子萌发及根长和芽长对环境胁迫表现敏感,因此对于大多数植物而言,常用这两种指标表现来评价植物的抗逆性[23]。种子萌发的发芽势、发芽率、发芽指数和活力指数是种子生命力和幼苗长势的重要表征指标[24],出苗期低温会抑制种子的萌发、减缓发芽速率、降低发芽势和发芽率,导致幼苗长势参差不齐[25]。在植物遭受低温胁迫时,SA通过抑制脂膜过氧化来维持细胞完整性,从而抵御逆境[26-27]。ABA是植物应答外界逆境的重要调节因子,在逆境下,植物体会增加ABA的合成,外源施用ABA通过提高植株自身ABA的合成和转运,诱导植物渗透调节剂含量的增加,提高细胞膜稳定性,从而提高植物的抗寒性[28-29],而SA和ABA诱导植物防御低温的效果取决于其浓度和应用模式[30]。
在本研究中,低温条件下扁蓿豆种子的4种萌发指标均随着不同外源物质浓度的增加呈先升后降的趋势,这与武季玲和陈桂平[31]在对植物抗冷性的研究得出的结果一致。在不同SA处理浓度中,以5 μmol·L-1为最佳处理浓度,其发芽势、发芽率、发芽指数和活力指数分别较CK提高了3.71%,7.33%,11.24%,46.84%,表明适当浓度的SA可以有效促进扁蓿豆种子的萌发,且使其保持较高的活力。杨小环等[32]对低温胁迫下玉米进行浸种后发现,与对照相比,SA处理下玉米的发芽势提高了33.34%,其增幅远大于本研究SA浸种对发芽势的增加,可能原因是玉米作为喜温作物,在低温条件下更容易受到冷害,对于外源物质更具敏感性。藜豆(Stizolobiumcapitatum)[33]、黑麦草(Loliumperenne)[34]对SA缓解低温冷害的最佳浓度均为1.5 mmol·L-1,提高烟草[35]抗冷性的最佳浓度为0.5 mmol·L-1。与它们不同的是本研究在>20 μmol·L-1的SA溶液中种子萌发已显示抑制作用,表明不同植物缓解低温冷害时的SA最佳浓度不同。此外,本试验表明,0.05 μmol·L-1的ABA溶液可以有效缓解扁蓿豆的低温胁迫,提高其萌发特性。>1 μmol·L-1的ABA浸种浓度对扁蓿豆的发芽特性产生显著抑制作用,这与徐文玲等[36]所研究的ABA在低浓度下提高大白菜(Brassicapekinensis)抗寒性的报道、杨晓娟等[16]对于冬油菜的种子萌发特性探讨均吻合。对于ABA浸种处理在发芽势和发芽率上出现的浓度差异,A3处理下发芽势最高,A2处理下发芽势较A3低,但发芽率高,可能原因是ABA在A3处理的较高浓度下促萌发作用显著,发芽较快。A5和A6处理显著抑制发芽势的增加,但发芽率与对照差异不显著,可能由于过高浓度的ABA抑制种子的发芽速度和发芽整齐度。最后,两种浸种剂均未对扁蓿豆初次发芽天数产生影响,与左志梅等[37]的研究结果相符,与丁军辉等[38]研究发现的10 mg·L-1的ABA在萌发第1 d对水稻(Oryzasativa)种子‘LP04’有显著促进的结论存在差异,其原因可能是水稻在低温下较扁蓿豆对ABA更具敏感性。最后,对于本研究中100 μmol·L-1的SA和5 μmol·L-1的ABA的处理浓度使得扁蓿豆的发芽率为0,可能原因是过高浓度的SA和ABA溶液对植物细胞的正常代谢造成影响,降低了种子渗透调节能力,从而不利于种子吸水或对其产生毒害作用[39]。因此,有必要针对不同植物选择适宜SA和ABA处理浓度,以便更有效地提高植物的抗逆能力[40]。
3.2 SA和ABA浸种对低温下扁蓿豆种子苗长的影响
植株幼苗的长度能体现植株生长速度和强壮程度。幼苗在遭受持续性低温时,表现为生长缓慢甚至停滞、根系生长受到抑制、叶片萎蔫,严重时导致植株死亡[41]。适量的水杨酸或脱落酸会使得植物产生系统获得性抗性,促进胁迫下植物的生长速率,调节离子吸收与转运、促进根系生长,从而抵御外界环境胁迫,但高浓度的外源物质会使植物发生超敏反应,引起植物细胞程序性死亡,从而抑制植物生长[42],所以,适宜的外源物质浓度的确定对于植物抵御不利环境有重要作用。本研究结果表明,低浓度SA和ABA浸种均能促进低温下扁蓿豆种子的芽和根伸长,这与王星剑等[43]在对茄子(Solanummelongena)的研究中体现出的“剂量效应”一致。在本研究中,SA处理中0.1~10 μmol·L-1之间的浓度均对扁蓿豆根长和芽长有促进作用,浓度适宜范围较广,与吕旭才等[44]对油菜(Brassicanapus)种子的研究结果一致。0.05 μmol·L-1ABA使低温条件下扁蓿豆芽长增加了59.34%,而根长在0.05和0.5 μmol·L-1的浸种溶液中均增加了27.76%和29.22%,表明芽伸长对ABA反应比根敏感,这与刘晶等[45]对蓖麻(RicinusCommunis)种子的研究中根长较芽长敏感的结论不同,但与郑世英等[46]的研究结果一致,其结果表明,SA缓解了盐胁迫下玉米种子的发芽情况,且对芽长的缓解作用大于对根长的缓解作用,这可能是不同植物的生长环境差异所致。此外,汤日圣等[47]在ABA对水稻种子萌发探索中发现,ABA抑制根和芽的伸长,而在干旱胁迫下ABA处理均能促进其种子萌发初期根和芽的伸长,这也证实ABA能缓解逆境条件下种子萌发和早期幼苗伸长的结论。同时,对于本研究在低温条件下,SA和ABA处理对扁蓿豆种子发芽率的影响比其根长和芽长的影响小,原因是可能扁蓿豆在经过浓硫酸处理后本身具有较高的发芽率,低温对于扁蓿豆的影响主要表现在幼苗上,且由于外源物质在抵御逆境过程中对诱导植物幼苗产生蛋白更有效,外源物质的添加会使种子发芽初期分泌更多渗透物质,因此对根和芽的伸长效果更为显著[12],这对于春季高寒草甸扁蓿豆的建植和增强其幼苗素质有积极作用。李灵芝等[48]等研究中证实,1 mmol·L-1的SA对于黄瓜(Cucumissativus)‘新夏丰2号’种子的发芽率较对照增加了14.81%,根长和芽长分别增加了27.88%和30.66%,这与本试验结果一致,表明较种子发芽率而言,外源物质浸种处理更具促进根和芽伸长的作用。
本研究各个指标通过模糊数学中隶属函数分析进行SA和ABA对低温效应的综合评价,避免了单个指标的片面性。经隶属函数分析后结果显示,0.05 μmol·L-1的ABA浸种处理是提高扁蓿豆种子萌发的最佳浓度。这与刘丽杰等[49]对寒地冬小麦(Triticumaestivum)的研究报告中显示SA单独浸种效果好于ABA不同,可能与不同植物对于外源激素的敏感性不同有关。本试验仅对单独浸种剂对种子萌发特性的影响作了探索,而对于复合浸种剂及其对低温下扁蓿豆发芽和幼苗生长的研究有待深入。
4 结论
0.05 μmol·L-1的ABA浸种处理显著提高低温下扁蓿豆种子发芽势和活力指数,低浓度的SA和ABA对种子发芽率和发芽指数均有提高,高浓度表现为抑制作用。
与萌发指标相比,SA和ABA浸种处理对根长和芽长的促进作用较大,且芽较根敏感,综合考虑其萌发指标,0.05 μmol·L-1的ABA浸种处理是低温下提高扁蓿豆种子萌发和幼苗初期生长的最佳浓度。

