青藏高原高寒草甸不同围栏年限土壤酶化学计量特征
米 琦,王 毅,秦小静,孙 建,叶冲冲
(1. 成都理工大学,四川 成都 610059; 2. 中国科学院地理科学与资源研究所生态网络观测与模拟重点实验室,北京 100101;3. 河南理工大学测绘与国土信息工程学院,河南 焦作,454000; 4. 西南石油大学土木工程与建筑学院,四川 成都,610500)
土壤胞外酶活性驱动着土壤有机质分解和养分循环[1],并能够快速响应植物、土壤微生物和土壤养分的变化,是理解生态系统土壤-植物驱动机制的关键[2]。目前,关于土壤胞外酶活性研究取得一定的成果,例如:土壤碳、氮和磷等养分因子作为各类酶重要底物,其含量的多少与酶活性显著相关[3-4];较低的土壤含水量通过抑制微生物生长,进而影响碳和氮转化相关的酶活性,例如β-葡萄糖苷酶(β-1,4-glucosidase,βG)、亮氨酸氨基肽酶(leucine aminopeptidase,LAP) 与N-乙酰-β-D-葡萄糖苷酶(N-acetyl-β-D-glucosidase,NAG);pH影响土壤养分元素的矿质化过程,如有机质分解、有效氮循环及有机磷化合物转化等,调节酶促反应中的相关酶活性[5]。围封措施下植被和土壤养分均得到一定恢复和改善,而不同围封年限群落演替过程中土壤酶活性的变化机制及土壤养分转化机理尚不明晰。
植物凋落物和根系的碳输入促进土壤有机物矿化过程[6],微生物和相应酶调节植物根系碳吸收与碳转化为氮和磷等养分之间的权衡效应[7],养分转化及含量的平衡过程受到环境因子的影响[8]。微生物能够分泌特定的胞外酶,获取限制性养分以满足自身生长,进而改变土壤生态酶计量比[9]。水解酶βG,NAG,LAP和碱性磷酸酶(alkaline phosphatase,ALP)4种胞外酶活性,与微生物群落代谢功能及养分生物循环密切相关[10]。一般将lnβG∶ln(NAG+LAP) 作为碳(carbon,C)∶氮(nitrogen,N)酶活性比、lnβG∶lnAP作为碳∶磷(phosphorus,P)酶活性比、ln(NAG+LAP)∶lnAP作为氮∶磷酶活性比[11]。基于酶生产的资源分配理论[12],酶活性计量比在一定程度上解释了微生物养分需求、碳分解与转化的平衡机制[13],同时土壤有效性养分通过影响微生物养分利用效率来改变酶活性[10]。有研究将βG∶AP与βG∶(NAG+LAP)酶活性坐标点的矢量长度量化碳含量与营养元素的相对限制量,角度作为氮和磷相对限制量[14],且βG∶AP与βG∶(NAG+LAP)酶活性比表现形式包含对数、反正弦和反正弦平方根等[15],以此将酶活性与C,N和P需求的比例可视化[16]。高寒草甸因其脆弱性、对外界环境变化极敏感性和严峻的沙化现状成为研究的热点[17],围栏封育是草地恢复管理的主要措施。研究发现,围栏禁牧有利于提高草地生产力和土壤易降解有机质含量,促进微生物生长,加速养分物质循环[18]。且高寒草地土壤酶活性与养分间的协同关系在群落演替中演变趋势存在差异[19],而荒漠草原土壤酶活性对围栏响应表现为无显著规律性[20],表层土壤中碱性磷酸酶活性显著增高[21]。因此,土壤酶的化学计量对探究植被恢复阶段土壤养分间矿化速率的驱动机理具有重要意义[4]。
若尔盖地区位于青藏高原的东部边缘,包括四川省的若尔盖县、红原县、阿坝县和甘肃省的玛曲县,具有重要的水源涵养功能、生物多样性保育和调节气候的功能[22]。近年来,若尔盖湿生环境趋于干旱化,沙化草地面积扩大[23],退化草地的恢复治理成为该区域生态保护的主要内容之一。本文选择若尔盖高寒草甸沙化区,选择2,4,6,8和10年围栏自然恢复样地,研究在高寒草地长期的恢复过程中与生态系统碳、氮和磷循环密切相关的土壤酶与环境因子的关系,以及在适应长期恢复生境的变化时酶化学计量比变化关系,以期探究高寒草甸恢复过程中土壤酶调控机制和适应性策略。本研究将为沙化草地恢复提供理论依据和科学参考。
1 材料与方法
1.1 研究区概况
红原县瓦切乡(33°47′24″ N,102°33′ E)位于四川省西部(图1),平均海拔3 600 m,年平均气温1.1℃,极端最低气温零下36.2℃,年降雨量为750 mm,主要集中在5-9月[24]。气候类型属于大陆性高原寒温带季风气候,年均日照时数2 400 h,年均积雪90 d左右,无绝对无霜期[25]。气候垂直分异明显,从下到上出现暖热到寒冷的气候变化。土壤以亚高山草甸土为主,有部分沼泽土及沼泽化草甸土[26],0~30 cm土层为草毡层。高寒草甸植被主要优势种有四川嵩草(KobresiasetchwanensisHand.-Mazz.)、紫花针茅(StiPaPurPureaGriseb),伴生种为甘肃棘豆(OxytroPiskansuensisBunge)、珠芽蓼(PolygonumviviparumL.)等[27]。
图1 研究区位置Fig.1 Location of study area
1.2 研究方法
1.2.1测定指标与方法 2018年7月,分别在围栏封育年限为2,4,6,8和10年的恢复地内随机选取3个50 cm×50 cm的样方,进行群落调查,分物种记录株高、株数和盖度,齐地剪去植物地上部分带回实验室。封育前的草地为沙化草地,植被盖度0%,无植被存活,土壤质地为纯砂土。采用土钻法(根钻直径为5 cm)在每个样方内随机选取3次土壤重复取样,土壤分为3层(0~10 cm,10~20 cm和20~30 cm)采集,每个样方9份土壤样品,土壤风干后过筛,去除草根和小石块等杂物,用于测定土壤理化性质和土壤酶活性等。土壤的各种指标值为土壤分层测定的平均值。容重法测定土壤含水量,pH用酸度计法测定(冠森,PHS-3C),植物地上部与根系放入温度80℃烘箱中烘干至质量恒定,用电子天平(精度0.01 g)称量其干质量,作为地上生物量与地下生物量。
有机碳(soil organic carbon,SOC)用重铬酸钾硫酸外加热法测定[28],速效氮(available nitrogen,AN)采用扩散吸收法测定[29],总磷(total phosphorus,TP)采用硫酸-高氯酸消煮法[30],LAP活性测定采用L-亮氨酸对硝基苯胺盐酸盐法;ALP活性测定采用磷酸苯二钠法;βG和NAG活性测定采用可见分光广度法[31]。
1.2.2数据处理与分析
土壤C∶N酶活性比=lnβG∶ln(NAG+LAP);
土壤C∶P酶活性比=lnβG∶lnALP;
土壤N∶P酶活性比= ln(NAG+LAP) ∶lnALP。
本研究目的是探究土壤酶活性与围栏封育年限之间的关系和这些酶活变化的特征,因此,选择了6种C∶N,C∶P酶活性比的特征值形式,如下:(1)未变换的活性比率(如βG∶ALP),(2)对数变换比率(如ln(βG)∶ln[ALP]),(3)未变换的活性比例(如βG∶[βG+ALP]),(4)反正弦变换的活性比例(如asin[βG∶(βG+ALP)]),(5)反正弦平方根变换比例(如asin[sqrt(βG∶[βG+ALP])]),以及(6)对数变换比例(如ln(p∶[1-p]),其中p=βG∶[βG+ALP]或βG∶[βG+NAG+LAP])。载体长度计算为x和y平方值之和的平方根,其中x表示相对C和P获得酶的活性,而y表示相对C和N获得酶的活性[32]:
Length=SQRT(x2+y2)
(1)
向量的角度计算为从绘图原点到点(x,y)的直线的反正切:
Angle(degrees)=DEGREES[ATAN2(x,y)]
(2)
向量的长度可以相对表征碳的限制,长度越长,碳的限制越强,向量的角度可以表征土壤酶存在氮或磷限制,大于45°表明存在磷限制,小于45°表明存在氮限制。
采用Excel 2016 进行数据统计和比较,使用SPSS 23.0(SPSS Inc,Chicago,IL,USA)对进行Pearson相关性和单因素方差分析,用最小显著差异检验进行检验,P<0.05表示差异显著。利用SigmaPlot (Systat Software,Inc.,Chicago,IL,USA)进行制图。
2 结果与分析
2.1 不同围封年限土壤理化性质和植物群落特征
由表1可知,地上生物量在围栏第4年显著增加(P<0.05)后降低,在围栏第10年时显著增加(P<0.05),整体呈上升趋势。植被覆盖度随着围封年限的增加呈上升趋势,植被覆盖度在围封10年时出现最大值,达到56%。土壤有机碳和全磷含量随围封时间增加出现累积现象,且在围封年限内有显著差异;速效氮含量在围栏第4年显著增加(P<0.05)后继续增加,在围栏第8年时降低,在围栏第10年时显著增加(P<0.05),整体呈上升趋势。土壤含水量随着围栏时间延长表现为增加趋势,在围封8年时达到近10%,与围栏10年土壤含水量无显著差异;pH值随围封年限变化无明显趋势。
2.2 不同围封年限土壤酶活性变化及酶计量学特征
如图2所示,与土壤C,N和P循环关系密切的βG,LAP,ALP和NAG活性均呈升-降-升的变化趋势,且围栏10年时4种土壤酶活性达到最大,显著高于其他围栏年限酶活性。其他围栏年限处理下,4种酶活性有轻微波动,基本无显著差异。
由表2可知,在围栏年限梯度上,C∶N酶活性比及其他转化形式的分布曲线均表现为负偏离,且转化形式下酶活性比偏度和峰值均高于酶活性比。C∶N酶活性比值的6种形式均表现出在围栏6年时出现峰值,C∶P酶活性比值均在围栏第8年出现最大值,比值与对数比值转换的C∶P酶活性比偏度均为正偏离和峰度均较高。由图3可知,不同围栏年限下土壤酶计量比与酶活性变化趋势存在差异。土壤C∶N酶活性比在围栏6年时最高,且显著高于2年,土壤C∶P和N∶P酶活性在围栏8年均高于其他围栏年限(图3)。围栏8年的矢量长度最大,矢量角度表现出差异性,且矢量角度最大值出现在围栏6年(图4)。
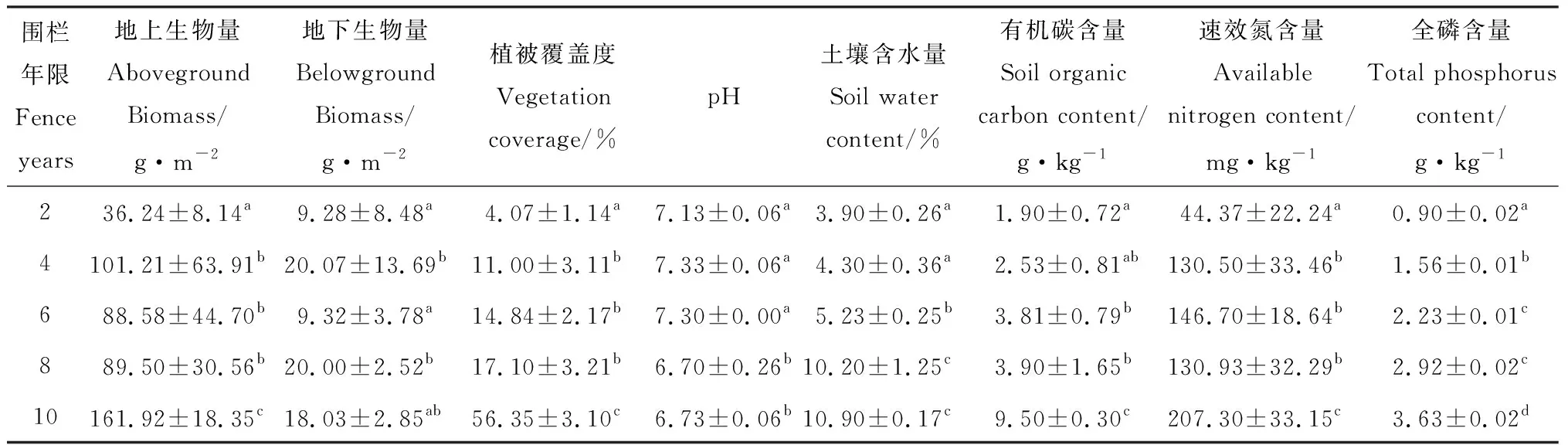
表1 不同围栏年限土壤理化性质与植被特征Table 1 Soil physical and chemical properties and vegetation characteristics under different fence years
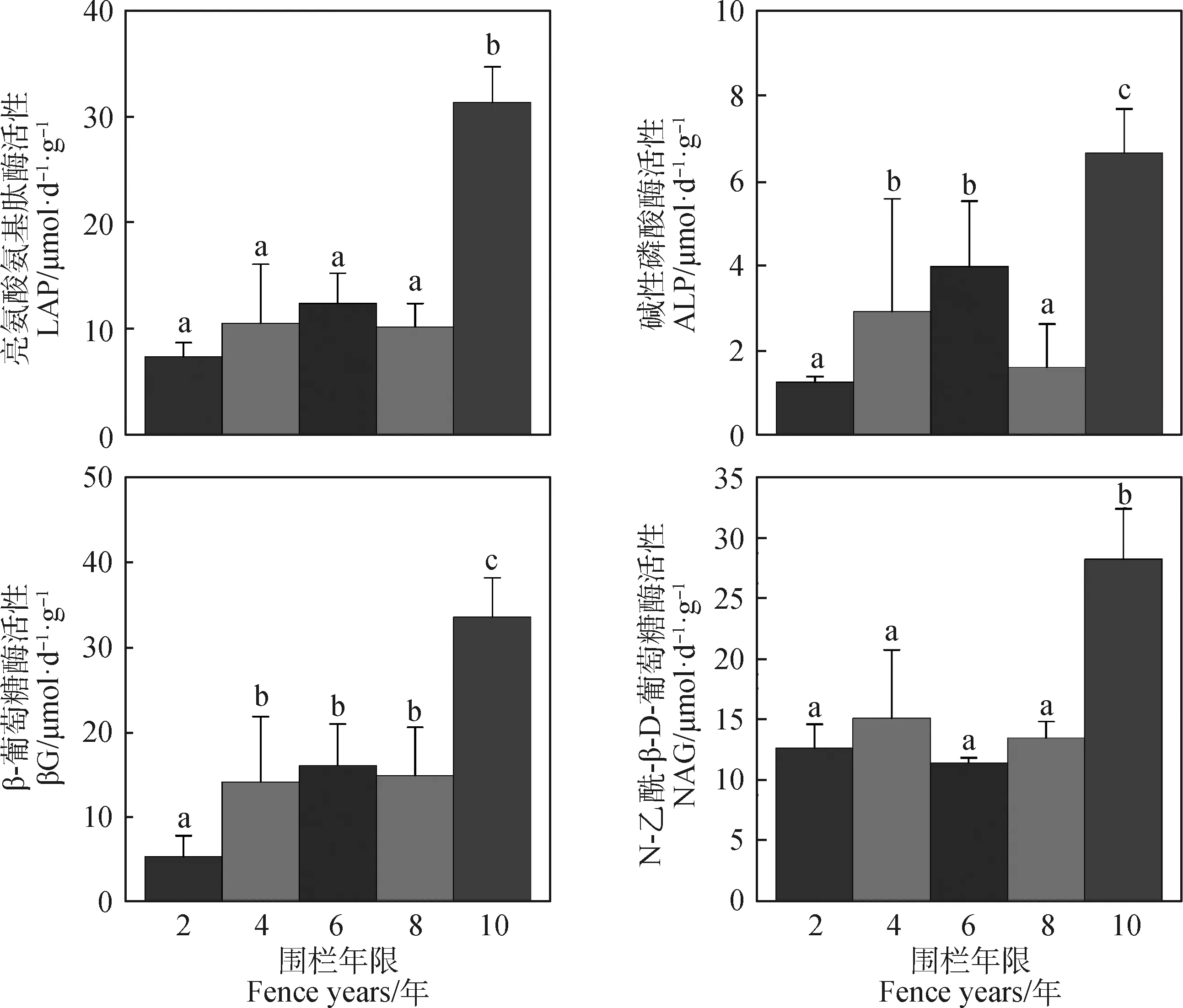
图2 不同围栏年限土壤酶活性Fig.2 Soil enzyme activities under different fence years注:不同字母之间表示不同围栏年限之间差异显著(P<0.05),下同Note:Different letters indicate significant difference under different fence years at the 0.05 level. The same as below
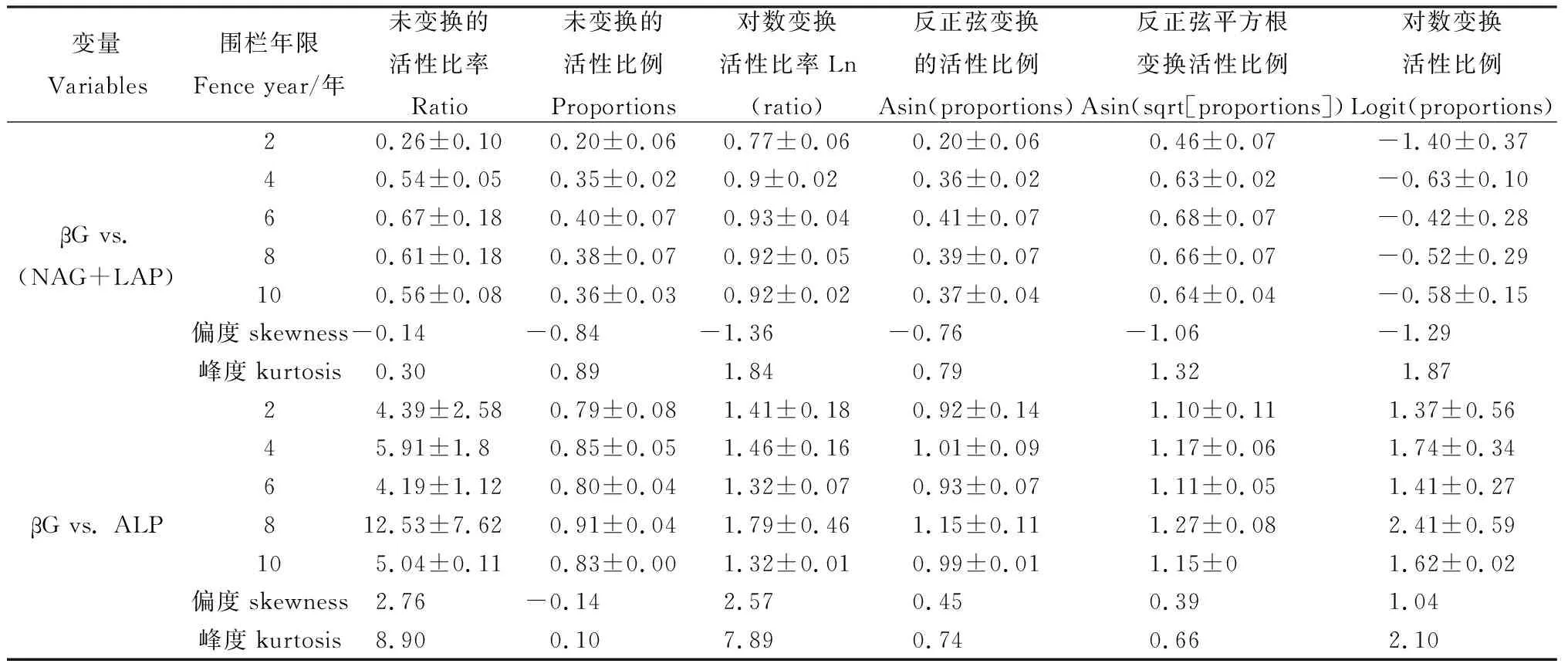
表2 土壤胞外酶活性的计量特征Table 2 Statistical charateristics of extracellular enzyme antibities reported in soil
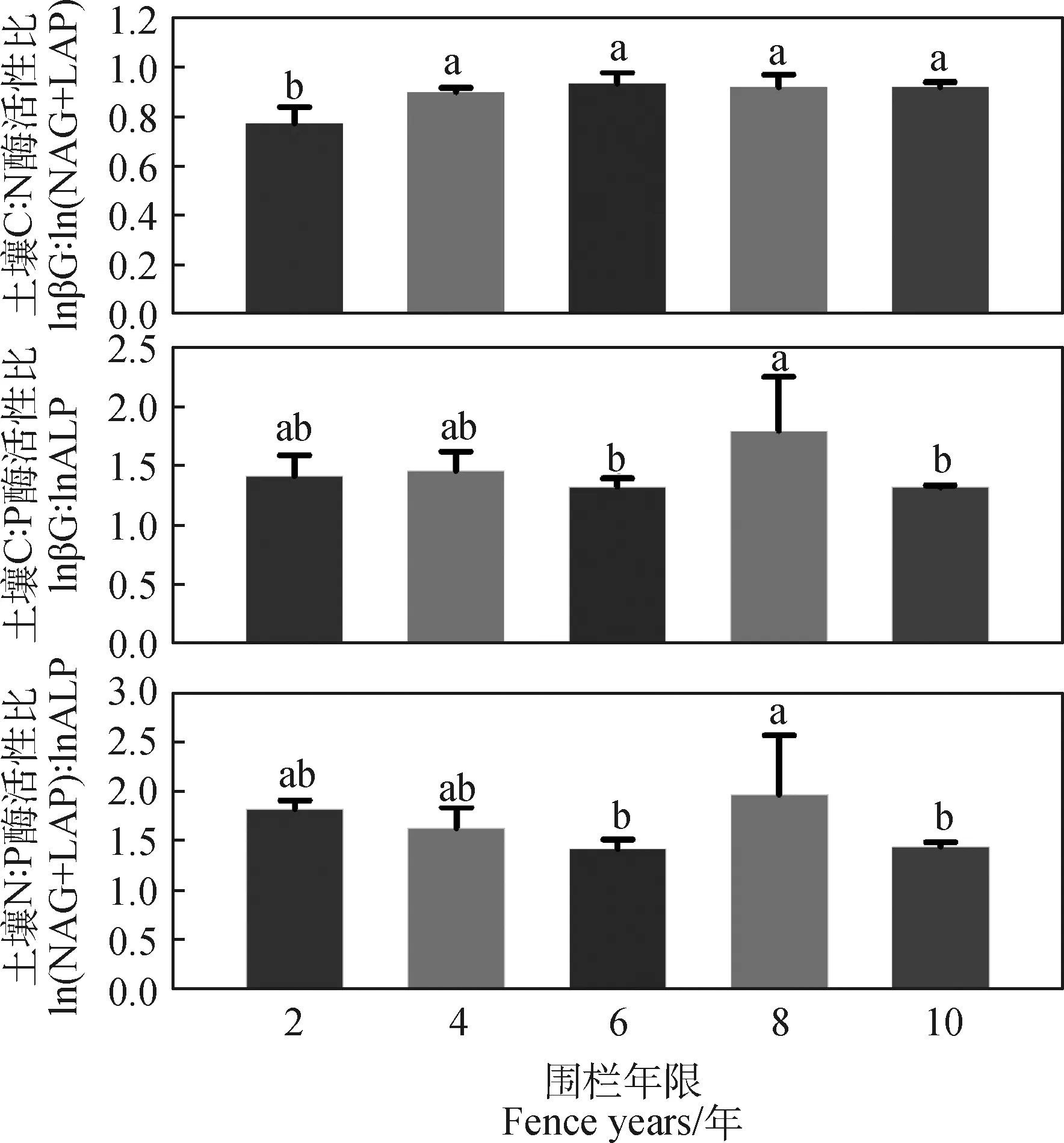
图3 不同围栏年限土壤酶化学计量比Fig.3 The stoichiometric ratio of soil enzymes under different fence years
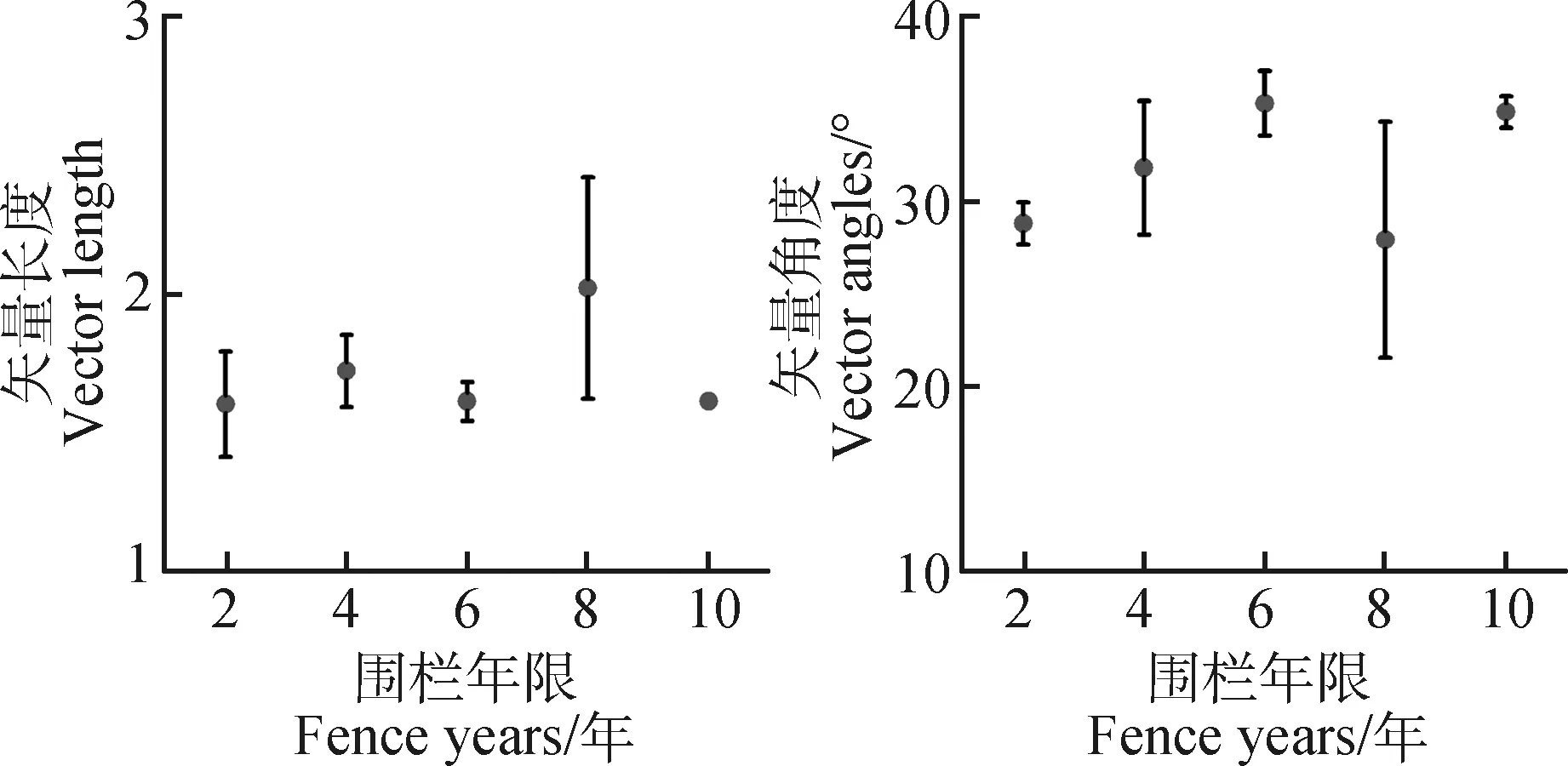
图4 不同围栏年限下基于酶活性比值的矢量长度和角度Fig.4 Vector length and angles under different fence years based on the activity ratios
2.3 土壤酶活性计量比与环境因子的关系
表3表明不同围栏环境因素对青藏高原高寒草甸土壤酶活性和计量比具有一定的影响。4种土壤酶活性变化与植被覆盖度、土壤有机碳呈显著正相关(P<0.05),磷酸酶ALP与土壤含水量表现为显著负相关关系。土壤C,N酶活性比及其转换形式与土壤含水量以及全磷含量均呈显著负相关关系,而与土壤pH表现为正相关关系。土壤C,P酶活性比及其转换形式与土壤有机碳表现为显著负相关关系,其中C∶P酶活性比与植物覆盖度、土壤pH呈显著负相关,与土壤含水量表现为正相关,土壤3类酶活性矢量长度和C∶P酶活性比与植被、土壤环境因子的相关性关系一致,矢量角度与土壤含水量呈显著负相关,与土壤pH呈显著正相关。
3 讨论
3.1 围栏措施下土壤酶活性变化的关键因子
土壤酶的主要来源是土壤微生物与植物根系,土壤有机碳作为土壤有机质中多数微生物碳源,为微生物的活动提供了重要动力[34]。研究结果表明,草地围栏封育后,草地生物量、有机碳和多种土壤酶活性均呈现增加趋势(表1、图2),这和前人研究结果一致。例如有研究发现,随着围封年限的增加,土壤表层枯落物和腐殖质增多、土壤养分积累增加,这会促进微生物活性的增加和植物根系发育,进而导致较高的土壤酶活性[33]。而且封育后土壤有机质积累增多,为土壤微生物群落底物提供多种底物[35],这会促进微生物群落丰富度增加、土壤分解代谢潜能提高、各种酶促反应加强、酶活性提高[36],如βG活性与有机碳存在显著的正相关关系[37]。土壤pH是微生物活性的重要调节剂[16],通过改变酶活性位点构象影响土壤酶活性[38]。本研究结果表明,随着围栏年限增加,土壤pH值减小,不同pH土壤环境下酶促效率存在差异,但本试验中pH与酶活性相关性不显著(表3),这可能与pH对酶活性影响的滞后效应有关。有研究指出,围栏下土壤结构显著改善,土壤有机质、全氮、全磷等含量显著增加[39-40],随着围栏年限的增加,植被盖度和土壤含水量均呈现增长的趋势,且多种关键因子协同增加(表1)。主要是因为较高的植被覆盖度有利于土壤水分的保持,随着围栏的持续,植物-土壤-微生物的养分循环增强,有利于土壤有机质的分解矿化[5]。然而,本研究中碱性磷酸酶与土壤含水量表现为显著负相关,可能是高寒草甸植被中过高的土壤含水量不利于磷元素转化的缘故。

表3 土壤酶活性及计量比与环境因子的相关系数Table 3 Correlation coefficients between soil enzyme activities,stoichiometry of soil enzymes and environmental factors
有研究发现,长期围栏会改变草地功能群多样性[41]和土壤物质循环过程[42]。对于高寒草原,围栏初期(2年),群落结构得到快速恢复,随着围栏时间的增加,群落生产力与盖度均表现为先增后降的趋势[43];但是,高寒草甸在围栏8年后群落结构中杂草类种数增加,群落稳定降低[44]。本研究中,地上生物量在围栏4年后显著增加,围栏6年生物量降低,其后表现为增加趋势(表1),这与群落演替过程中种间结构组成相关。而且,地下生物量与地上生物量随着围栏年限的增加表现为相同趋势[45],具有滞后性。此外,本研究发现,围栏后高寒草甸水解酶βG,LAP,ALP和NAG均呈现增长趋势,但是在围栏8年或6年时出现不同程度的降低(图2)。有研究也得出相似的研究结果,如李玉强等[46]监测到沙质草地在围栏8年时对二氧化碳截存量达到峰值,其土壤酶活性也表现为降低趋势[47]。而且,我们的结果也与高寒草原围封4年时磷酸酶、脲酶和β-葡萄糖苷酶高于围封8年的研究结果一致[48],因为围栏年限达到6~8年后,群落演替可能达到顶峰[49],这将直接影响土壤养分转化、循环过程[50],导致土壤碳周转速效降低[51]。
3.2 不同围封年限土壤酶计量比特征
基于酶生产资源分配理论,微生物通过物质质量和环境条件,将资源分配到相对缺乏的某种元素相关的水解酶来最大限度地提高生产力[52],从而改变相关酶浓度及化学计量[4]。在本研究中,土壤C∶N酶活性比在围栏4年时显著增加,之后随围栏时间的增加无明显趋势(图3);然而,土壤C∶P酶活性与N∶P酶活性比随围栏时间的增加波动趋势较为一致,均在围栏8年出现显著增加趋势(图3)。而且,各围栏年限下土壤C∶N酶活性比均低于全球平均值1.41,土壤C∶P酶活性比值均大于全球平均值0.62,而土壤N∶P酶活性比在各围栏恢复时间也均大于全球平均值0.44[53],这可能是因为研究区在围栏8年时,植物群落受到碳、氮限制[11]。
土壤碳、氮和磷对应需求酶活性比例反映了环境变化下代谢需求和养分利用率之间的生物地球化学平衡[54]。C∶N酶活性比与C∶P酶活性比的矢量分析可量化陆地生态系统中土壤C∶N∶P酶活性比趋近1∶1∶1的收敛范围,其动态分布与植被特征和土壤特性密切相关[55]。研究表明,LAP,NAG酶活性与pH分别呈正相关、负相关关系[56],且当pH<7时LAP酶活性较弱。本研究结果表明,围栏草甸2,4和6年pH保持较高水平(大于7,表1),第8年降为酸性。因此,需氮酶活性对pH的非一致性响应可能是引起碳、氮酶活性比与pH的正相关关系的主要原因(表3)。此外,我们发现C∶N酶活性比与土壤全磷呈现负相关关系(表3),这表明围栏演替过程中微生物对氮、磷的需求具有协同性[57]。
本试验中酶活性比的矢量角度均在45°以下(图4),表明高寒草甸围栏措施下土壤整体存在氮限制,且围栏时间6年内随年限增加氮限制得到缓解。因而,6年后进行合理放牧有利于土壤养分矿化[58]。另外,围栏年限达到8年时,矢量长度增加幅度较大,表明碳限制土壤微生物群落[32]。研究表明,土壤酶活性和微生物对植物特征响应敏感性高于土壤养分累积[59],植物枯落物和根系分泌物通过影响土壤特性和养分可利用性来改变土壤微生物结构和组成[60]。因此,长期围栏造成的群落结构组成和优势种的改变是导致分解速率降低的主要因素[61]。
4 结论
在围栏封育措施下,青藏高原沙化草甸植被状况和土壤特性均得到改善,植被覆盖度和土壤含水量显著增加,土壤养分和酶活性均随着围栏年限整体呈增长趋势。就酶化学计量而言,高寒草甸围栏8年时,土壤C∶N酶活性比的特征值出现降低,而C∶P酶活性比特征值出现上升现象。矢量分析中矢量角度低于45°,矢量长度在围栏8年时出现增加。据此,本研究认为高寒草甸在围栏封育措施下存在N养分限制,而且土壤含水量通过调节pH影响氮矿化过程。围栏6~8年时,环境因子对土壤微生物结构和组成影响显著,且与养分循环相关的酶活性对植被特征和土壤特性的响应敏感。

