宁夏盐池县荒漠草原区不同群落优势植物叶片-土壤生态化学计量特征
聂明鹤,沈 艳,2*,陆 颖,王科鑫,张小菊
(1.宁夏大学农学院,宁夏 银川 750021; 2. 西北土地退化与生态恢复省部共建国家重点实验室培育基地,宁夏 银川 750021)
生态化学计量学旨在解释生物的生活方式、生态系统结构、生态系统功能以及非生物体与有机物之间的元素比值关系[1],主要对不同尺度生态过程中的碳(Carbon,C)、氮(Nitrogen,N)、磷(Phosphorus,P)元素及其比值关系进行探究[1]。C,N,P在植物生长与各种生理调解机能中发挥着重要作用[2],在生态系统中,植物与土壤是相互联系的有机整体,研究植物与土壤的C,N,P含量及其比值关系对生态系统的能量循环与稳定有着重要意义[3]。近些年,国内外学者对不同地域[4-5]、不同生态系统类型[6-11]的植被与土壤的生态化学计量特征进行了大量研究,主要包括森林、草原生态系统中的不同植被类型[5,7,12]、植物器官[12-13]、恢复措施[14]、土地利用类型[15]等的植物与土壤的化学计量特征研究;同时有研究也分析了植物养分含量及土壤生态化学计量特征的影响因素及其之间的关系,有研究表明植物的C,N,P含量与植被特征[6]、季节变化[12]、物种多样性[16]等存在着密切关系;土壤的化学计量特征与气候因素[17]、凋落物[18]、放牧强度[19]、N增加[20]、降雨量[21]等有着密切关系。
对于荒漠草原,已有研究探讨了不同放牧措施[22]、植被类型[23]下植被与土壤的生态化学计量特征等,然而对于荒漠草原不同群落植物与土壤生态化学计量特征及其之间的关系研究较少。宁夏中部干旱带的荒漠草原,位于毛乌素沙地南缘,是宁夏天然草原的主体,占宁夏草地总面积的55.1%,植物群落类型多样,但结构简单,土壤风蚀强烈,生态系统稳定性差[24]。因此本研究选择盐池县荒漠草原为研究对象,对该区的植物群落和土壤养分进行调查,分析不同群落优势植物叶片与土壤的生态化学计量特征及其之间的关系,旨在为揭示土壤C,N,P计量特征对不同群落草地植被生长的影响机理奠定基础,以期为荒漠草原植被恢复和草地合理管理提供科学依据。
1 材料与方法
1.1 研究区概况
研究区位于盐池县,隶属宁夏回族自治区吴忠市,地理位置处于北纬37°04′~38°10′,东经106°30′~107°41′;东西跨度66 km,南北长110 km,面积8 661.30 km2。盐池县属于典型中温带大陆性气候,具有干旱少雨、冬冷夏热、蒸发强烈、日照充分、风沙大等特点。年平均气温为8.1℃。各月平均气温为—13.0~22.7℃,极端最高温度为34.9℃,极端最低温度为—24.2℃,年平均无霜期为165 d,年平均降水量250~300 mm,且从东南向西北递减。研究区土壤以灰钙土为主,其次是黑垆土和风沙土,土壤结构松散,肥力较低、易受侵蚀。南部黄土丘陵区,主要以黑垆土为主,面积占到整个南部地区的80%以上;北部地区则以风沙土和灰钙土为主,面积分别占到整个北部地区的46.5%和45%。土壤结构特点为较松散、肥力低和易侵蚀等。
研究区植被在区系上属于欧亚草原区、亚洲中部亚区,位于我国中部草原区典型草原向荒漠草原的过渡地带,荒漠草原主要分布在北部大部分地区,主要物种包括短花针茅(Stipabreviflora)、赖草(Leymussecalinus)、中亚白草(Pennisetumcentrasiaticum)、牛枝子(Lespedezapotaninii)、猪毛蒿(Artemisiascoparia)、猫头刺(Oxytropisaciphylla)、苦豆子(Sophoraalopecuroides)以及狗尾草(Setariaviridis)等。
1.2 研究方法
1.2.1样地设置 根据该区上世纪80年代调查形成的草原类型图,结合植被遥感影像图,对该区群落类型分布、物种组成等基本情况进行分析,选择甘草(Glycrrhizauralensis)群落、牛枝子群落、苦豆子群落、短花针茅群落、赖草群落、中亚白草群落、白刺(Nitrariatangutorum)群落与油蒿(Artemisiaordosica)群落作为研究样地。
1.2.2样品采集 于2018年7—8月,在不同群落类型的典型地段设置调查样地,每个群落至少设置3个样地,本着高度、坡度、坡向等相对一致的原则,每个样地设置3个样方,观测各样地草地植物的高度、密度、频度、盖度及地上生物量。样方内随机取优势植物30株(若样方内数量不够,则在紧邻样方外选取),齐地剪下,在 65℃下烘干,并将茎叶分离后,粉碎测定植物叶片C,N,P含量。基于植被调查数据,通过计算重要值确定不同群落优势植物(表1)。土壤取样点与植物取样点一一对应,在样地土壤剖面不同层次取原状土(分别在0~5 cm,5~15 cm,15~40 cm处分层取样),并将采集的每个样方同层土壤样品混匀、去杂、风干,研磨过2 mm,1 mm或者0.075 mm筛后备用。
1.2.3养分测定 用全自动凯氏定氮仪(K-360,BUCHI Labortechnik AG,Switzerland)测定植物全氮与土壤全氮[25]。采用HCLO4-H2SO4消煮,流速分析仪(Skalar Analytical B.V.,Netherlands)测定土壤全磷[26]。采用元素分析仪(Elemental rapid CS cube)测定植物总碳与土壤总碳。采用H2SO4-H2O2消煮,钒钼黄比色法,经紫外可见分光光度计(UV755B)测定植物全磷[27]。

表1 不同群落优势植物Table 1 Dominant plants in different plant communities
1.3 数据处理与分析
草地植物和土壤样品数据采用Excel 2010 软件进行数据处理及制图,利用SAS 8.2和DPS软件分析C/N,C/P,N/P与C,N,P之间的相关关系,并采用One-way ANOVA和Duncan法进行单因素方差分析与多重比较。
2 结果与分析
2.1 不同群落优势植物叶片C,N,P生态化学计量特征
在研究区中,不同群落优势植物叶片生态化学计量特征分析结果如表2所示,优势植物叶片C含量变化范围在340.3~436.5 g·kg-1,油蒿群落的优势植物叶片C含量显著高于其余7种群落(P<0.05);短花针茅群落的优势植物叶片C含量最低,与苦豆子群落和油蒿群落的优势植物的叶片C含量存在显著差异(P<0.05);其它群落类型间无显著差异。优势植物叶片N含量变化范围为18.6~30.6 g·kg-1,白刺群落优势植物叶片N含量最高,与中亚白草群落、油蒿群落和短花针茅群落的优势植物叶片的N含量存在显著差异(P<0.05);短花针茅群落优势植物叶片N含量最低,且与其余7种群落的优势植物叶片N含量存在显著差异(P<0.05);其它群落类型间均无显著差异。优势植物叶片P含量变化范围为0.7~2.5 g·kg-1,油蒿群落优势植物叶片P含量最高,与甘草群落、牛枝子群落、白刺群落、赖草群落、苦豆子群落和短花针茅群落的优势植物叶片P含量均存在显著差异(P<0.05);短花针茅群落优势植物叶片的P含量最低,与油蒿群落、中亚白草群落、甘草群落、牛枝子群落、白刺群落、赖草群落优势植物叶片P含量存在显著差异(P<0.05);其它群落类型间均无显著差异。
不同群落优势植物叶片C/N,C/P,N/P分析结果如表2所示,C/N的变化范围是12.1~18.8,短花针茅群落C/N最高,与其余7种群落的优势植物叶片C,N比值均存在显著差异(P<0.05),白刺群落C/N最低,与短花针茅群落、油蒿群落、赖草群落和中亚白草群落的优势植物叶片C,N比存在显著差异(P<0.05);C/P的变化范围是153.6~566.7,短花针茅群落优势植物叶片C/P最高,与其余7种群落优势植物叶片C/P存在显著差异(P<0.05),中亚白草群落地上部分植物叶片C/P最低,与短花针茅群落、苦豆子群落、牛枝子群落和白刺群落的优势植物叶片C/P存在显著差异(P<0.05);N/P的变化范围是9.3~31.0,苦豆子群落优势植物叶片N/P最高,与其余7种群落优势植物叶片N/P均在显著差异(P<0.05),油蒿群落优势植物叶片N/P最低,与苦豆子群落、短花针茅群落、赖草群落、白刺群落、牛枝子群落和甘草群落的优势植物叶片N/P存在显著差异(P<0.05)。
2.2 不同群落土壤生态化学计量特征分析
如图1所示,研究区0~5 cm,5~15 cm,15~40 cm层土壤总C含量变化分别为5.18~12.22 g·kg-1,5.37~11.32 g·kg-1,6.97~13.82 g·kg-1。不同群落土壤总C含量随土层深度变化表现出一致的变化规律。牛枝子群落土壤总C含量最高,且0~5 cm层土壤总C含量与甘草群落、短花针茅群落、赖草群落、中亚白草群落和油蒿群落的0~5 cm层土壤总C含量存在显著差异(P<0.05);5~15 cm层土壤总C含量与其余7种群落的5~15 cm层土壤总C含量均存在显著差异(P<0.05);15~40 cm层土壤总C含量与甘草群落、短花针茅群落、赖草群落、中亚白草群落和油蒿群落的15~40 cm层土壤总C含量存在显著差异(P<0.05)。赖草群落土壤总C含量最低,0~5 cm层土壤总C含量与牛枝子群落、苦豆子群落、短花针茅群落、白刺群落和油蒿群落的0~5 cm层土壤总C含量存在显著差异(P<0.05);5~15 cm层土壤总C含量与短花针茅群落、白刺群落和牛枝子群落的5~15 cm层土壤总C含量存在显著差异(P<0.05);15~40 cm层土壤总C含量与甘草群落、牛枝子群落、苦豆子群落、短花针茅群落和白刺群落的15~40 cm层土壤总C含量存在显著差异(P<0.05)。
表2 不同群落优势植物叶片化学计量特征Table 2 The chemical characteristics of leaves in dominant plants in different communities

图1 不同群落土壤总碳含量Fig.1 Soil total carbon content in different plant communities注:不同小写字母表示0.05水平下差异显著,下同Note:Different lowecase letters indicate significant differences at the 0.05 level,the same as below
由图2可知,研究区0~5 cm,5~15 cm,15~40 cm层土壤全N含量变化分别为0.25~0.38 g·kg-1,0.22~0.38 g·kg-1,0.23~0.44 g·kg-1。土壤全N含量随土层深度的增加表现出不一样的变化规律,苦豆子群落和白刺群落的土壤全N含量随着土层深度增加总体呈现出降低的趋势,甘草群落、牛枝子群落、赖草群落、中亚白草群落与油蒿群落的土壤全N含量随着土层的增加呈波动变化趋势;短花针茅群落的土壤全N含量随着土层深度的增加总体呈增加趋势。在0~5 cm土层,白刺群落土壤全N含量最高,与赖草群落和油蒿群落的0~5 cm层土壤全N含量存在显著差异(P<0.05);赖草群落土壤全N含量最低,0~5 cm层土壤全N含量与牛枝子群落、苦豆子群落和白刺群落的0~5 cm层土壤全N含量存在显著差异(P<0.05);5~15 cm层土壤全N含量与牛枝子群落、短花针茅群落和白刺群落的5~15 cm层土壤全N含量存在显著差异(P<0.05);15~40 cm层土壤全N含量与短花针茅群落15~40 cm层土壤全N含量存在显著差异(P<0.05)。
如图3所示,研究区0~5 cm,5~15 cm,15~40 cm层土壤全P含量变化分别为0.18~0.32 g·kg-1,0.17~0.31 g·kg-1,0.18~0.34 g·kg-1。土壤全P含量随土层深度的增加表现出不一样的变化规律,牛枝子群落土壤全P含量随着土层深度的增加总体上呈降低趋势,其余群落呈波动变化趋势。油蒿群落的土壤全P含量最低,0~5 cm层土壤全P含量与甘草群落、牛枝子群落、短花针茅群落以及白刺群落的0~5 cm层土壤全P含量存在显著差异(P<0.05);5~15 cm层土壤全P含量与牛枝子群落、短花针茅群落和白刺群落的5~15 cm层土壤全P含量存在显著差异(P<0.05);15~40 cm层土壤全P含量与甘草群落、牛枝子群落和白刺群落的15~40 cm层的土壤全P含量存在显著差异(P<0.05)。
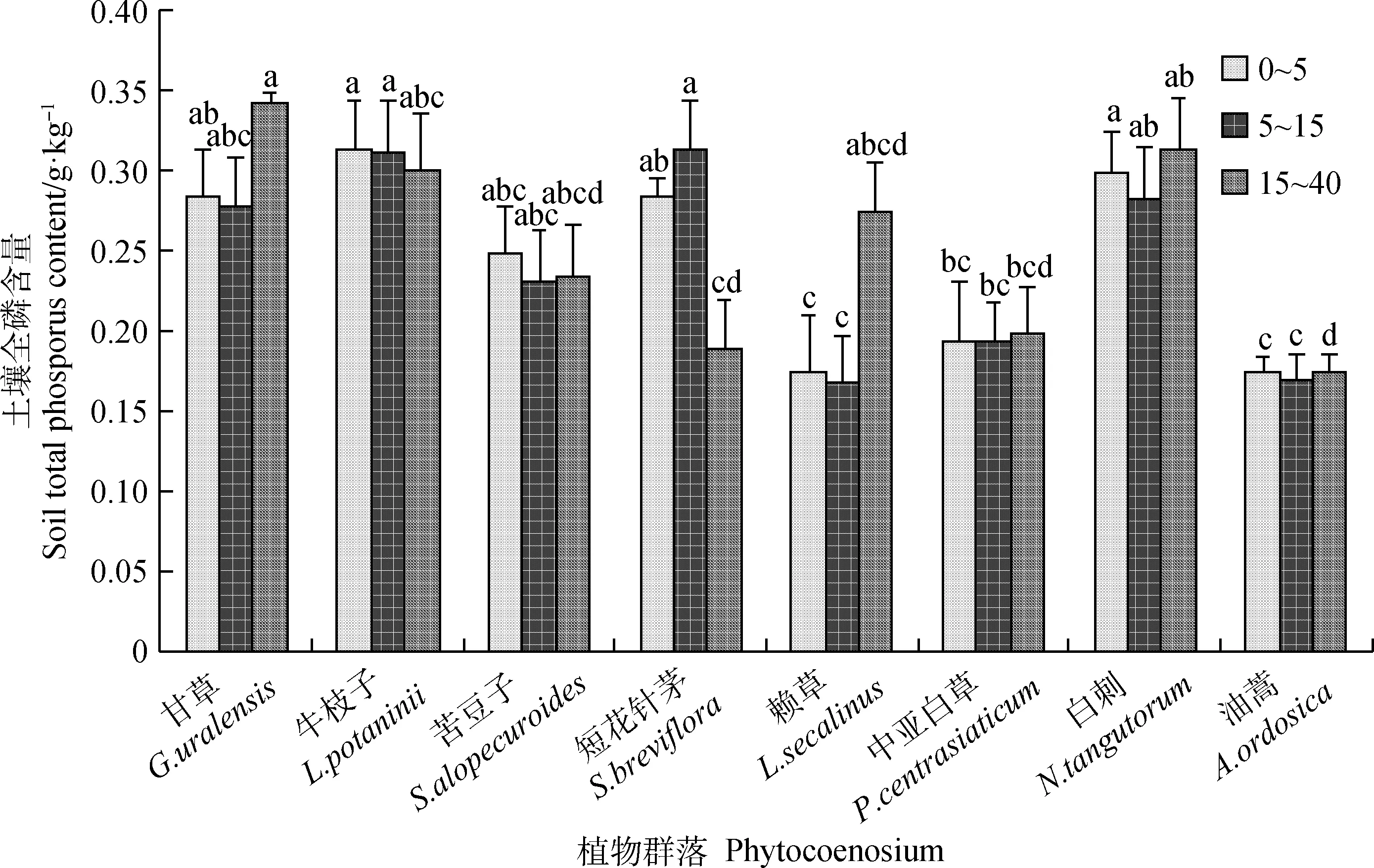
图3 不同群落土壤全磷含量Fig.3 Soil total phosphorus content in different plant communities
如图4所示,0~5 cm,5~15 cm,15~40 cm层土壤C/N的变化范围分别为23.57~36.64,24.13~46.91,27.06~48.92。不同群落土壤C/N随土层深度的增加并没有一致的变化规律,甘草群落、牛枝子群落、赖草群落和中亚白草群落的土壤C/N随着土层深度的增加呈增加趋势,苦豆子群落、短花针茅群落、白刺群落和油蒿群落的土壤C/N随土壤深度的增加总体呈波动变化趋势。在0~5 cm土层,苦豆子群落土壤C/N最大,与甘草群落和赖草群落的土壤C/N存在显著差异(P<0.05);在5~15 cm土层,牛枝子群落土壤C/N最大,与苦豆子群落和赖草群落的土壤C/N存在显著差异(P<0.05);在15~40 cm土层,苦豆子群落土壤C/N最大,与甘草群落、短花针茅群落、赖草群落、中亚白草群落和油蒿群落的土壤C/N存在显著差异(P<0.05)。由图7可知:土壤C/N与土壤总C含量呈显著正相关(P<0.05),与土壤全N含量相关性未达到显著性水平。
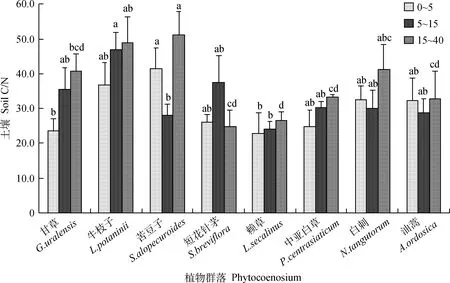
图4 不同群落土壤C/NFig.4 Soil C/N of different plant communities
如图5所示,0~5 cm,5~15 cm,15~40 cm层土壤C/P的变化范围分别为23.25~48.72,31.13~54.21,32.31~54.02。不同群落土壤C/P随土层深度的增加表现出一致的变化规律,甘草群落、短花针茅群落与中亚白草群落的土壤C/P随着土层深度的增加总体呈增加趋势,牛枝子群落、苦豆子群落、赖草群落、白刺群落与油蒿群落的土壤C/P随着土层深度的增加呈波动变化趋势。从整体来看甘草群落的C/P最低,0~5 cm层与苦豆子群落土壤C/P存在显著差异(P<0.05);5~15 cm层与牛枝子群落土壤C/P存在显著差异(P<0.05);15~40 cm层与牛枝子群落和苦豆子群落土壤C/P存在显著差异(P<0.05)。由图7可知:土壤C/P与土壤总C含量及土壤全N含量均无显著相关性。
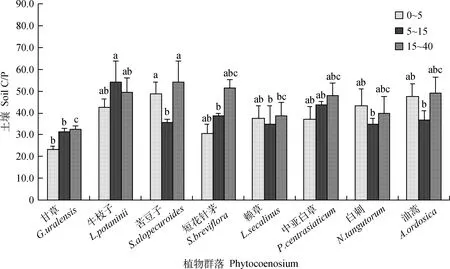
图5 不同群落土壤C/PFig.5 Soil C/P of different plant communities
如图6所示,0~5 cm,5~15 cm,15~40 cm层土壤N/P的变化范围分别为1.03~1.61,0.93~1.28,0.75~1.59。不同群落土壤N/P随土层深度的增加表现出不一样的变化规律,白刺群落的土壤N/P随着土层深度的增加总体呈降低趋势,其余群落土壤N/P随土壤深度的增加总体呈波动变化趋势。在0~5 cm土层,中亚白草群落土壤N/P最大,与甘草群落的土壤N/P存在显著差异(P<0.05);在5~15 cm土层,中亚白草群落的N/P最大,与白刺群落的土壤N/P存在显著差异(P<0.05);在15~40 cm土层,短花针茅群落的N/P最大,与甘草群落、牛枝子群落、苦豆子群落和白刺群落的土壤N/P存在显著差异(P<0.05)。由图7可知:土壤N/P与土壤全P含量呈显著负相关(P<0.05),与土壤全N含量相关性未达到显著性水平。

图6 不同群落土壤N/PFig.6 Soil N/P of different plant communities
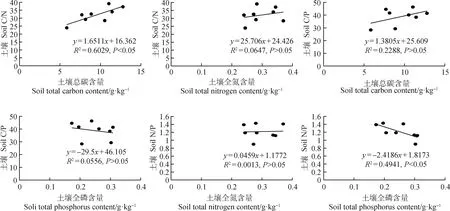
图7 土壤C/N,C/P,N/P与土壤C,N,P含量之间的关系Fig.7 The relationship between soil C/N,C/P,N/P and C,N,P content
2.3 不同群落植物-土壤生态化学计量相关性分析
如表3所示,植物总C含量与土壤总C含量具有极显著的正相关关系(P<0.01),与土壤全P含量与土壤C/N存在显著正相关(P<0.05);植物全N含量与植物C/N呈极显著的负相关关系(P<0.01);植物全P含量与植物C/P和植物N/P呈极显著负相关(P<0.01);土壤总C含量与土壤C/N存在极显著正相关(P<0.01),与土壤全N含量、土壤全P含量和土壤C/P存在显著正相关关系(P<0.05);土壤全N含量与土壤全P含量存在显著正相关性(P<0.05);土壤全P含量与土壤N/P之间存在极显著负相关性(P<0.01);植物C/P与植物N/P存在显著正相关关系(P<0.05);土壤C/N与土壤C/P呈显著正相关关系(P<0.05)。

表3 不同群落优势植物与土壤碳、氮、磷相关性Table 3 Correlation of C,N,P between dominant plants and soil in different plant communities
3 讨论
3.1 不同群落优势植物生态化学计量特征
研究区不同群落优势植物叶片的C,N,P含量的平均值为383.7 g·kg-1,24.58 g·kg-1,1.70 g·kg-1,均低于全球草地生态系统植物叶片的平均C含量461.60 g·kg-1、平均N含量20.11 g·kg-1、平均P含量1.82 g·kg-1[28]。本研究区生态环境较恶劣,土壤养分含量低,而植物所需的部分养分元素会受到外界环境的影响,当研究区水分减少,养分来源受阻时,植物对养分的吸收和利用速率减慢,因此叶片所能积累的有效养分含量将会降低,所以植物C,N,P含量较低,这与牛得草[12]、罗艳等[6]对荒漠区植物叶片化学计量比的研究结果相同。对于植物而言,一般低的C/N对应较高的生长速率[29],在本研究中短花针茅群落的C/N最大,故其生长速率小于其他植物群落;白刺群落的C/N最小,故该群落的生长速率最大。植被养分含量取决于土壤养分供应和植被养分需求间的动态平衡,因此植物的养分比率常常会趋向一固定的比值,目前用N/P阈值作为指示植物生长的限制元素,Koerselman[30]认为N/P<14时,N元素是主要限制性元素;N/P>16时,P元素成为主要限制生长的元素;当14 本研究中土壤整体的C,N,P含量分别为9.54 g·kg-1,0.31 g·kg-1,0.24 g·kg-1,分别低于全国平均水平11.12 g·kg-1,1.06 g·kg-1,0.65 g·kg-1[31],可知研究区土壤C,N,P元素较为贫瘠。由于荒漠地区降水量少和相对较低的分解速度,不利于岩石风化[32],土壤存储有机物质的能力较低,导致养分可利用性显著降低,同时因为荒漠草原地表植被较稀疏,凋落物较少,植物返还给土壤的养分较少,进一步影响了土壤养分的含量,这与安钰[19]、黄菊莹[20]等研究结果一致。一般来说,土壤C/N范围大致处于2~70之间,在此分布范围以外的C/N比在其他分析中应作为特异值处理[25],研究区不同植物群落0~5 cm,5~15 cm,15~40 cm土层C/N的变化范围分别为23.57~36.64,24.13~46.91,27.06~48.92,均处在正常范围之内。在一定范围内C/N比值越小越有利于有机物质的分解,可以看出研究区随着土层的增加有机物的分解速率在降低,这与贾荣[24]等研究结果一致。 根据土壤N/P的大小,可判断出土壤养分限制性元素,较低的土壤N/P更适合群落的生长[32],在本研究中除短花针茅群落外,N/P随着土层的增加呈降低趋势,可知深层土壤更适合植物的生长,这与地表植被情况、人为活动、气候条件有着密切的关系,这与陈开华[32]、丁小慧[33]等研究一致。较低的C/P是磷有效性高的一个指标,在本研究中甘草的C/P最小,可知甘草群落土壤P的有效性最高;在研究区中,群落0~5 cm层土壤的C/P较小,可见0~5 cm层土壤较深层土壤P的有效性高。 植物与土壤是一个相互联系的有机整体,植物体内化学元素来源于土壤,植物又通过凋落物的分解将养分返还给土壤[26]。有研究表明,植物总C,全N含量与土壤总C,全N含量之间存在显著的线性正相关关系[35]。本研究中,植物总C含量与土壤总C含量呈极显著的正相关关系,植物总C含量与土壤全P含量为显著正相关。在本研究中,植物全N,全P含量与土壤全N,全P含量没有显著的相关性,这主要是因为恢复措施、群落特征、土壤特性、人为活动等都会对植物营养元素含量产生一定的影响[24],这在一定程度解释了植物叶片营养元素含量与土壤之间相关性不显著。植物总C含量与土壤C/N存在显著正相关(P<0.05),说明植物养分含量对土壤的影响可以通过生态化学计量比来调节,这与俞月凤[35]、谢锦[34]等研究结果一致。 研究区不同群落优势植物生态化学计量特征不同。白刺群落的生长速率最大,短花针茅群落的生长速率较小,不同群落植物的生长限制元素不同;研究区植物与土壤的C,N,P含量较低;较整体而言,0~5 cm土层的土壤有机物分解速率与P的有效性较高;植物总C含量与土壤总C及土壤全P含量之间存在显著正相关(P<0.05),植物全N和全P含量与土壤全N跟全P含量没有显著相关性,植物全N和全P含量表现出与土壤不完全同步的变化形式,说明土壤生态化学计量格局还与环境等因素有关。3.2 不同群落土壤生态化学计量特征
3.3 不同群落植物-土壤生态化学计量相关性分析
4 结论

