添加芽孢杆菌对豆粕固体发酵的影响
陈倩倩 刘 波 王阶平 刘国红 郑雪芳 李慧敏
(福建省农业科学院农业生物资源研究所1,福州 350002)(福州大学生物科学与工程学院2,福州 350002)
豆粕是大豆提取油脂后的副产品,含其中的粗蛋白含量高达40%~50%,氨基酸丰富,尤其富含其他植物性饲料易缺的的赖氨酸,是理想的植物性蛋白饲料[1,2]。然而,豆粕中含有胰蛋白酶抑制剂等多种抗营养因子,如植酸、胰蛋白酶抑制剂等,阻碍了肠道内蛋白酶的活性,降低消化率,不利于动物消化道吸收,甚至导致动物肠道失衡,造成畜禽养殖损失[3]。微生物在发酵过程中产生多种酶类,如蛋白酶、纤维素酶和植酸酶等,钝化抗营养因子,并可将蛋白质分解为小肽,改善产品品质以及适口性,促进饲料消化吸收,提高饲料转化率[4-6]。
豆粕接种优良微生物菌种进行固态发酵,微生物在发酵过程中分泌度多种酶类对豆粕中的有机物进行分解和利用,同时产生多种维生素和活性物质,提升豆粕营养价值。生产过程能耗低、无废水、成本低、产能高,易于操作[7-9]。用发酵后的豆粕饲喂仔猪等幼畜,可以降低仔猪料重比,改善腹泻症状,提高其生产性能[10-12]。常用发酵微生物包括芽孢杆菌、酵母菌、乳酸菌和曲霉等[13,14]。芽孢杆菌是能够产生芽胞,抗逆性强,耐受高温、高压和强酸碱,可以耐受胃酸和上消化道胆盐和消化液的破坏,抵达下消化道并定植生长。芽孢杆菌生长消耗氧气,维持肠道厌氧环境,促进乳酸菌等厌氧益生菌的生长,抑制好氧病原菌,维持肠道微生态平衡[15]。同时,芽孢杆菌还能够分泌纤维素酶和淀粉酶等胞外酶,添加至饲料中可以改善动物自身消化酶的分泌不足,促进动物营养代谢[16]。王格等[17]采用高通量测序技术分析了芽孢杆菌混合发酵豆粕过程细菌群落结构及演替规律,芽孢杆菌属相对丰度随着发酵进行而降低,乳酸菌先升高后趋于稳定;芽孢杆菌混合发酵抑制有害菌如大肠杆菌和沙门氏菌的生长。
枯草芽孢杆菌是理性的微生物功能饲料添加剂,广泛应用于饲料生产,提升豆粕发酵水平和营养价值[15,16]。然而,枯草芽孢杆菌对发酵豆粕细菌群落的影响还需要进一步研究。基于此,本研究以豆粕作为主要发酵材料,添加枯草芽孢杆菌JK2进行固体发酵,分析发酵过程的理化性质及营养成分;并采用IlluminaMiseq对其中的细菌群落测序分析,研究添加芽孢杆菌对豆粕细菌群落的影响,为豆粕的开发与利用提供参考。
1 材料与方法
1.1 材料
实验菌株:枯草芽胞杆菌FJAT-FB1(BacillussubtilusFJAT-FB1),本实验室分离保藏菌株。
LB培养基:蛋白胨10.0 g,酵母提取物5.0 g,NaCl 5.0 g,蒸馏水1 000 mL,调节pH值至7.0~7.2。豆粕、麸皮(市售)。
1.2 方法
1.2.1 发酵豆粕:以豆粕为主要发酵原料,加入5%麸皮,调整含水量至50%。
选取芽孢杆菌单菌落至LB培养基中,35 ℃摇床180 r/min培养12 h。4 ℃下2 000 r/min离心5 min,用超纯水重悬,调整至OD600为1.0。芽孢杆菌发酵组,添加5%的上述芽孢杆菌菌液;对照组添加等量清水。将各组置于35 ℃温箱中静置发酵7 d。每天进行发酵样品中心温度和pH的检测。B0(添加芽孢杆菌的豆粕)和W0(清水对照初始豆粕)经过7 d的发酵,均呈现较好的发酵气味和色泽。发酵后的豆粕颜色稍深,尤其是对照组W7样本颜色最深,呈黄褐色;添加芽孢杆菌发酵的B7有独特芳香气味。
1.2.2 发酵饲料理化性质分析
取发酵前后的豆粕10 g,加入90 mL纯水,涡旋混匀,5 000 r/min离心10 min,获得发酵上清液。上清液进行梯度稀释后,采用水质仪检测N和C指标。
采用GC-MC检测发酵饲料中的棕榈酸和亚油酸:称取2 g豆粕样品加入4 mL丙酮,于漩涡震荡器振荡混匀后,超声30 min,放于4 ℃萃取3 h,取上清液1.8 mL,离心(10 000 r/min,4 ℃)10 min,倒出上清液,弃沉淀。取上清液,过0.22 μm过滤器于GC小瓶内,进行GC-MS检测,分析豆粕经发酵前后物质组成。
1.2.3 发酵豆粕总DNA的提取及微生物组测序
每个样本称取500 mg发酵豆粕,分别进行总DNA的提取。采用细菌引物338F 和 806R扩增细菌16S rDNA基因,PCR反应重复3次,取相同体积混合后进行目的片段回收。所用胶回收试剂盒为AxyPrepDNA凝胶回收试剂盒。采用QuantiFluorTM-ST蓝色荧光定量系统对回收PCR产物进行定量检测。然后构建插入片段为350 bp的paired-end(PE)文库,经过Qubit定量和文库检测,HiSeq上机测序。
1.2.4 微生物组测序数据质控与分析
对测序得到的原始数据进行拼接、过滤,得到有效数据。采用Mothur软件(version 1.36.1)基于上述有效数据进行OTUs(Operational Taxonomic Units)聚类和物种分类分析。采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析。从各个OTU中挑选出一条序列作为该OTU的代表序列,将该代表序列与已知物种数据库进行物种注释分析;根据每个OTU中序列的条数,得到各个OTU的丰度值。采用QIIME软件的迭代算法,进行主成分分析(PCA)。物种热图利用颜色梯度可以很好反应出样本在不同物种下的丰度大小以及物种聚类、样本聚类信息,可利用R语言的gplots包的heatmap.2函数实现。
2 结果与分析
2.1 发酵饲料理化性质分析
对发酵温度的检测显示,发酵1 d后温度即有明显升高。加入芽孢杆菌发酵在第1 d温度即达到峰值(47 ℃),对照组发酵2 d后,温度达到峰值(42 ℃),添加芽孢杆菌发酵促进豆粕升温。此后温度下降,至第5 d,温度略有回升。豆粕发酵后的pH从初始的6.45降至4.43,对照组的pH在发酵第3 d最低(5.7),而后升高。在降到pH值最低后,各实验组pH值均有升高的趋势,但有部分组后期又降低。这可能是由于刚发酵时,会产生一些有机酸、乳酸等酸性代谢产物,使得发酵豆粕pH值降低,但发酵一定时间后芽孢杆菌在发酵过程中产生蛋白酶,蛋白酶降解豆粕中蛋白质产生胺类物质,甚至产生一些氨气使得产物pH升高。发酵饲料的pH大多在3.6~4.5之间,抑制肠道中致病菌的生长和繁殖。添加芽孢杆菌发酵,促进豆粕中微生物产酸,降低豆粕pH。
发酵起始,C/N、亚油酸和棕榈酸含量基本一致。发酵后,豆粕中的C/N呈现上升趋势,对照组起始值为0.34,发酵7 d后为1.75;芽孢杆菌组起始值为0.33,发酵后为1.97。亚油酸含量随着发酵而降低,芽孢杆菌组B7的亚油酸含量低于W7;芽孢杆菌组发酵后棕榈酸含升高量,对照中棕榈酸含量降低,芽孢杆菌组B7的棕榈酸含量高于W7。豆粕中的亚油酸含量高于棕榈酸。
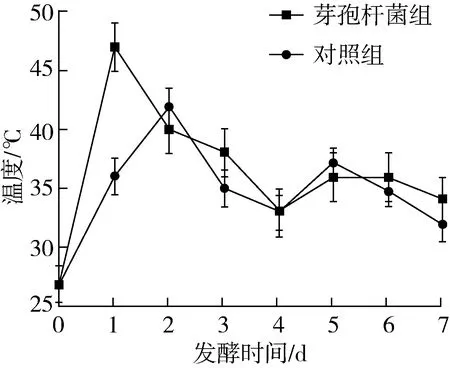
图1 豆粕固体发酵温度变化
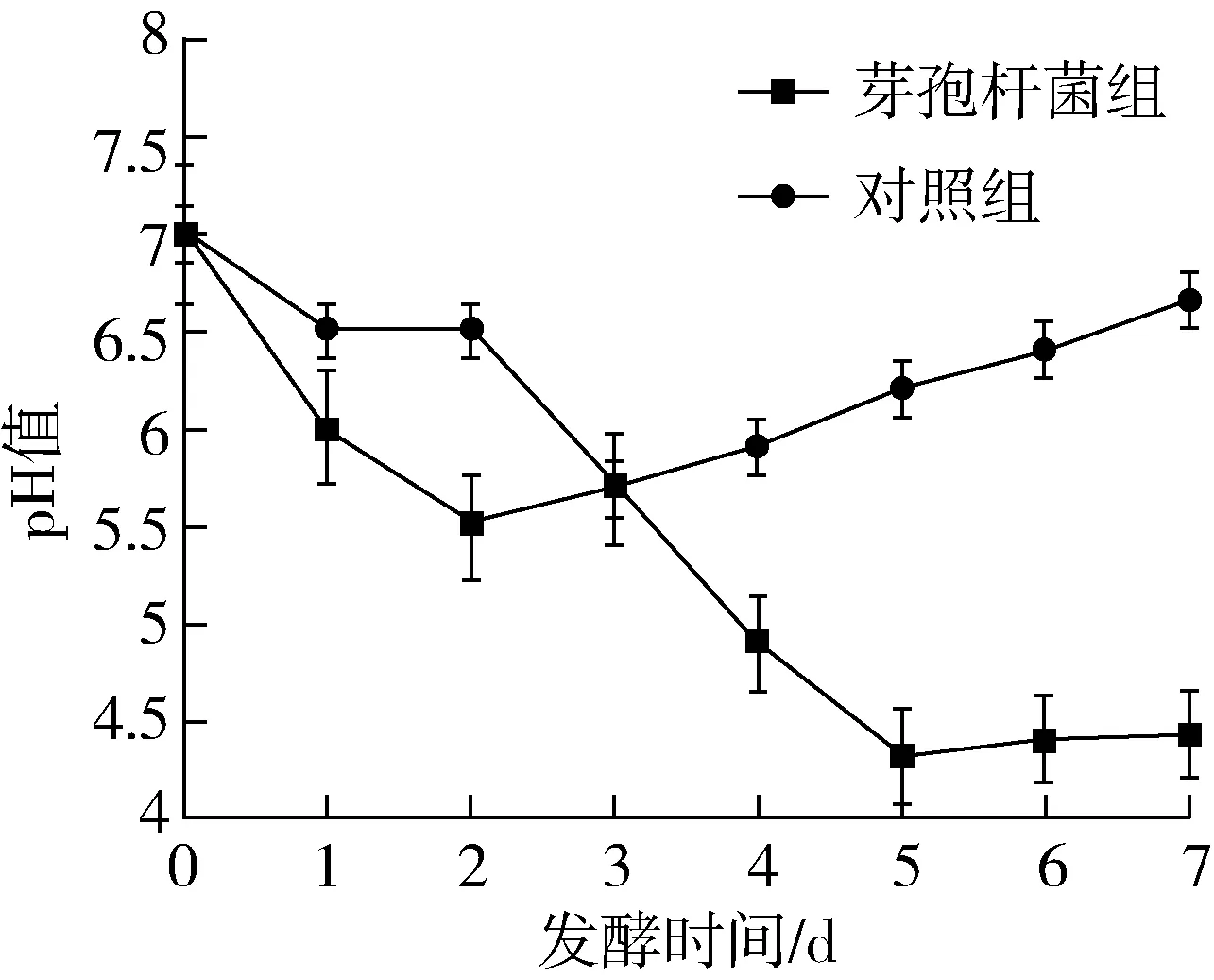
图2 豆粕固体发酵pH变化
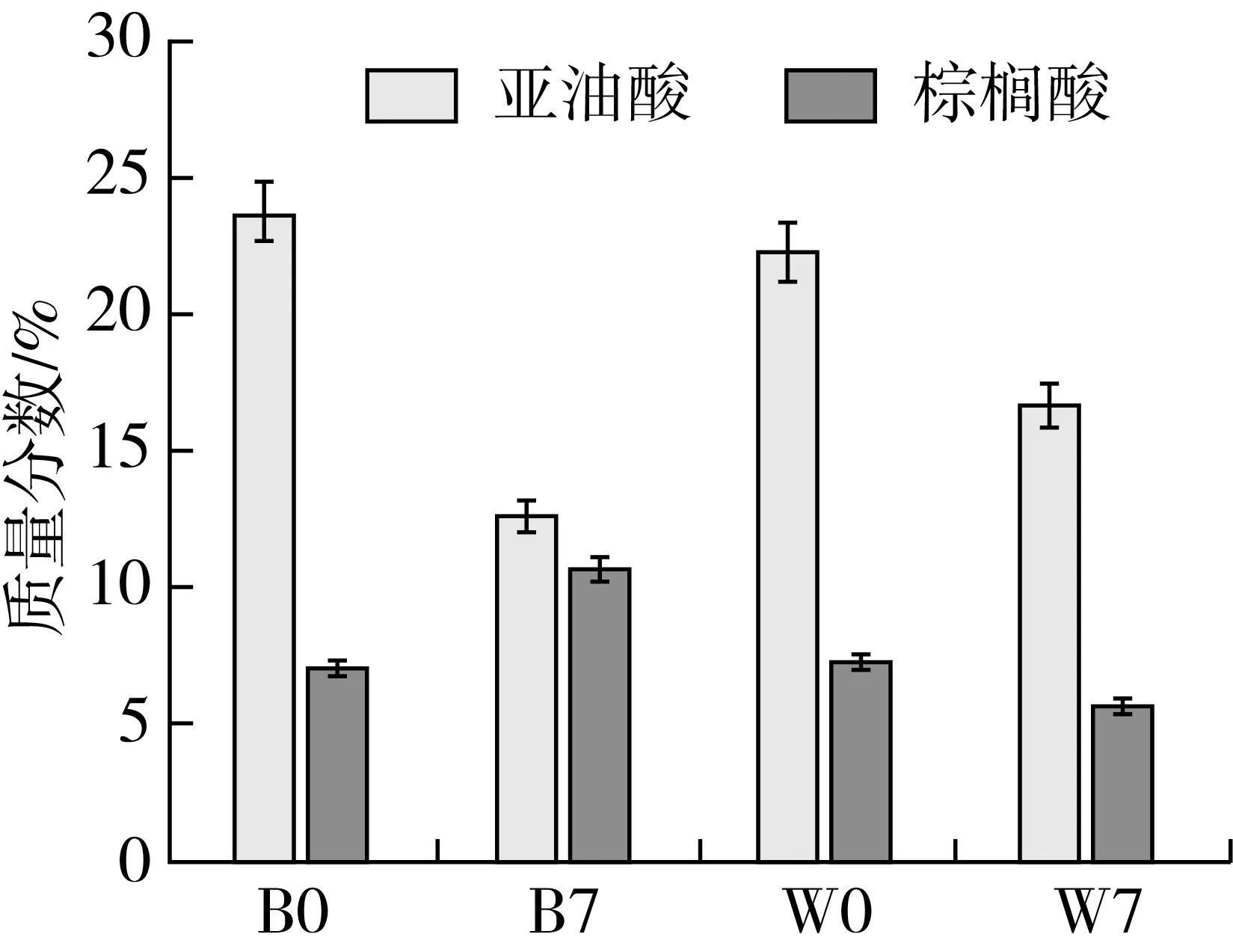
图3 发酵饲料营养成分比较
2.2 不同发酵饲料细菌多样性评估
细菌丰富度和多样细菌最高值为最大值为B7和W7,发酵后豆粕中的细菌种类和数量都有所增加。反映群落丰富度的chao和sobs指数,范围分别为119(B0)-148(W7)和99(W0)-121(W7),数值越大,群落丰富度越高,W7豆粕细菌含量最高;香农指数和辛普森指数反映群落多样性,香农指数越高多样性越丰富,而辛普森指数恰好相反,它们范围分别在2.21(B0)~2.70(W7)和0.102(B7)~0.146(W0),发酵后的豆粕中(B7和W7)细菌更具多样性。测序覆盖率均在99.9%以上,已经基本覆盖样本中的所有物种。
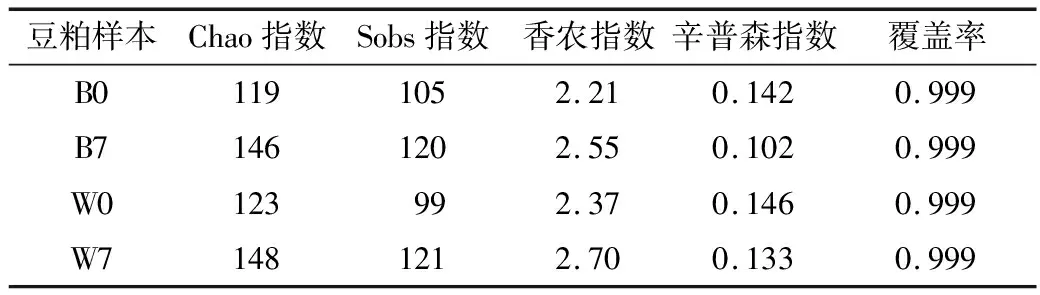
表1 测序数据多样性指数
2.3 发酵饲料中细菌群落结构分析
4种发酵豆粕中共检测到230种OTU类型,包含11个门,17纲,34目,63科,113属细菌。发酵豆粕中的主要细菌为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)(图4)。B0的厚壁菌门的相对质量分数为97.8%,放线菌门为2.3%;发酵后的B7中,变形菌门相对质量分数为10.7%,厚壁菌门质量分数为88.9%。对照样本中,W0的厚壁菌门细菌占比98.3%;发酵后的W7中,厚壁菌门相对质量分数为93.3%,变形菌门相对质量分数为3.9%,放线菌门质量分数为2.7%。在发酵初期豆粕中厚壁菌门相对质量分数高于发酵后的豆粕;发酵后的豆粕中变形菌门和放线菌门细菌相对质量分数增加。
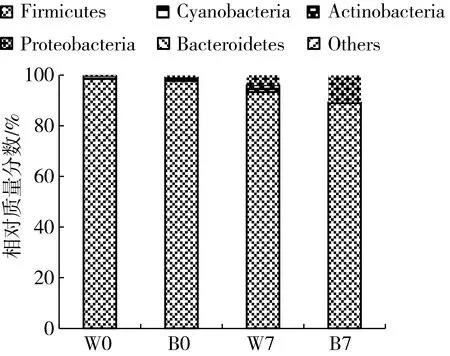
图4 发酵饲料细菌门组成
发酵前的豆粕中,主要细菌为未分类的魏斯氏菌(unclassifiedWeissella)、耐久肠球菌(Enterococcusdurans)和类肠膜魏斯氏菌(Weissellaparamesenteroides)(图5)。其中,未分类的魏斯氏菌的含量最高,在W0和CK0中的质量分数分别为19.4%和23.5%。这3种细菌经过发酵相对质量分数均降低,其中对照组中的未分类的魏斯氏菌由19.4%降至1.7%,耐久肠球菌和类肠膜魏斯氏菌分别降至5.7%和2.3%。在芽孢杆菌组中,未分类的魏斯氏菌和耐久肠球菌和类肠膜魏斯氏菌分别降至14.3%和1.8%;类肠膜魏斯氏菌相对含量略有升高。魏斯氏菌是参与食品发酵的重要微生物,发酵过程产生乳酸、短链脂肪酸和低聚糖等,增加食品风味[18,19]。发酵后的豆粕中,乳杆菌属的鼠李糖乳杆菌(Lactobacillusrhamnosus)、桥乳杆菌(L.pontis)和发酵乳杆菌(L.fermentum)的相对含量升高,成为发酵豆粕的优势菌。W7中的主要乳酸菌为嗜酸乳杆菌(L.acidipiscis),B7主要为发酵乳杆菌和鼠李糖乳杆菌。芽孢杆菌消耗易吸收的营养成分,不利于生长缓慢的嗜酸乳杆菌增殖[20],可能是导致其中嗜酸乳杆菌含量降低的重要原因。B7的乳酸菌种类更为丰富,发酵乳杆菌分布较广,是传统发酵食品中的优势微生物,能够在寡营养条件下增殖[21];桥乳杆菌是豆清发酵液中的主要微生物[22];鼠李糖乳杆菌耐酸性强[23]。这些乳杆菌发酵产生大量乳酸,增加饲料适口性,同时降低饲料pH,抑制病原微生物生长,提高食品的质量和营养,广泛应用于食品发酵、水产养殖和畜牧生产等方面[24,25]。
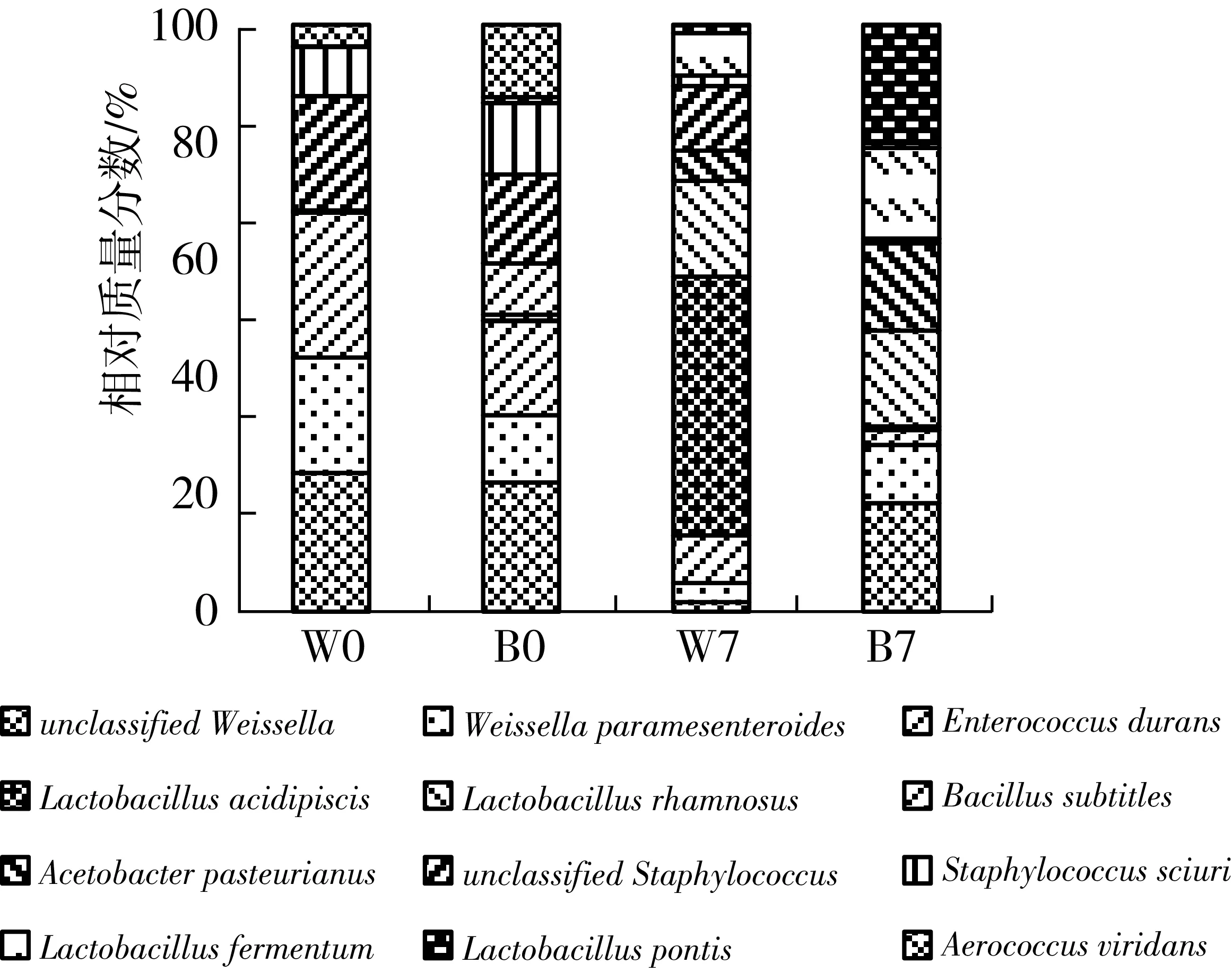
图5 发酵饲料细菌种组成
2.4 发酵饲料中细菌差异分析
在种水平,芽孢杆菌组的发酵乳杆菌、桥乳杆菌、未分类魏斯氏菌、巴氏醋酸杆菌(Acetobacterpasteurianus)、乳酸片球菌(Pediococcusacidilactici)及类肠膜魏斯氏菌含量明显高于对照(图6)。乳杆菌和醋酸菌广泛分布于发酵食品,是一类重要的工业微生物,通常存在于传统发酵食品如酸奶、食醋、开菲尔和红茶菌中,促进功能性化合物的生成,提升产品风味和质量[26,27]。乳酸片球菌是一种乳酸菌,发酵过程产生乳酸,广泛应用于发酵饲料,其代谢产物能够调节胃肠道菌群,提高动物免疫力[28,29]。嗜酸乳杆菌、未分类葡萄球菌(unclassifiedStaphylococcus)、耐久肠球菌、肉葡萄球菌(Staphylococcuscarnosus)及未分类微小杆菌(unclassifiedExiguobacterium)在对照组含量高于芽孢杆菌组。嗜酸乳杆菌培养物能够抑制肠道病原菌生长,促进肠绒毛发育,改善肠道形态结构,促进断奶仔猪生长[11]。耐久肠球菌多存在于动物肠道中,作为肠道微生物产生蛋白酶、纤维素酶等,参与营养成分的水解和吸收[30,31]。但是其中葡萄球菌属和明串珠菌属的某些细菌为条件致病菌,存在于饲料中,对动物安全产生隐患,对养殖业造成巨大经济损失。添加芽孢杆菌发酵则能够降低此类条件致病菌的含量,这与王格等[17]的研究结果一致。
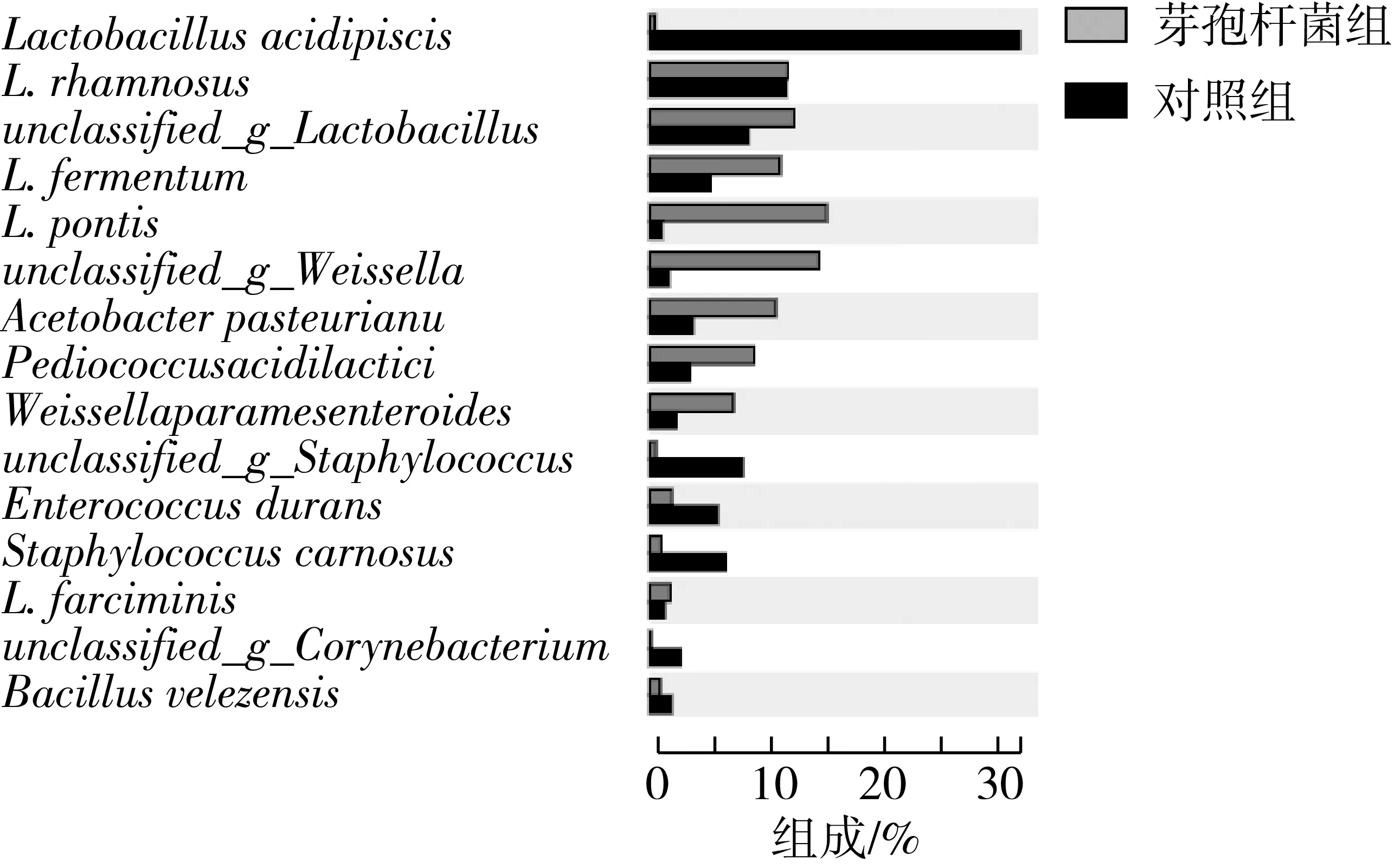
图6 饲料细菌种水平分布差异分析
2.5 理化因子相关性分析
环境因子相关性分析结果可以看出:C/N和棕榈酸对豆粕发酵细菌的影响一致(图7)。棕榈酸的含量与葡萄球菌属含量呈现显著性负相关,棕榈酸含量越高,该属细菌含量越低;此外,醋酸菌属与棕榈酸呈现正相关,高含量的棕榈酸促进醋酸菌的生长。棕榈酸是一种长链脂肪酸,作为化感物质,能够调节环境菌群,前人研究发现棕榈酸能够抑制病原真菌,保持土壤中的微生物多样性[32]。本研究发现棕榈酸含量升高,有助于提高饲料中醋酸菌属细菌的数量,抑制葡萄球菌属细菌的数量,棕榈酸对发酵饲料微生物群落的影响以待进一步研究。高C/N的环境同样促进醋酸菌的生长,同时抑制肠杆菌属、葡萄球菌属和链球菌属细菌的生长。因此,在豆粕发酵中,调节合适的C/N能够抑制疑似病原菌的生长,保持饲料健康发酵。pH与亚油酸对细菌有相似的影响。pH的升高与肠杆菌属和葡萄球菌属呈正相关,尤其是葡萄球菌属的含量与之显著性相关;乳杆菌属和醋酸菌属与pH的升高呈现负相关,含量随pH的降低而升高,醋酸菌属的相关性更为显著。乳杆菌属和醋酸菌生长过程产生乳酸和醋酸等有机酸,降低豆粕pH,赋予其良好的口感[33];同时,产生的有机酸抑制病原菌的生长。气球菌属(Aerococcus)与亚油酸含量显著相关,样本中亚油酸含量越高,该细菌含量越高。亚油酸是一种重要的天然活性脂肪酸,具有抗氧化,降低胆固醇,提高机体免疫力的功能,同时作为饲料添加剂应用与养殖业,提高畜禽品质[34, 35]。高含量的亚油酸促进疑似病原菌气球菌属细菌的含量,因此,使用亚油酸作为饲料添加剂应控制剂量。
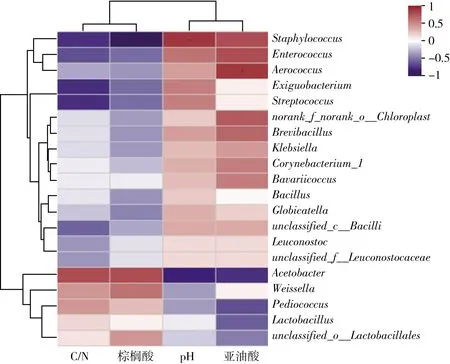
图7 环境因子与发酵饲料细菌群落相关性分析
3 结论
添加芽孢杆菌FJAT-FB1促进豆粕发酵升温,降低pH,提高C/N和棕榈酸含量。4种发酵豆粕中共检测到230种OTU类型,包含11个门,17纲,34目,63科,113属细菌。发酵后豆粕中的细菌多样性和丰富度增加。发酵豆粕中的主要细菌为厚壁菌门、变形菌门和放线菌门,厚壁菌门的魏斯氏菌属和乳杆菌属是优势菌。添加芽孢杆菌发酵提高乳酸菌含量,降低条件致病菌的含量。相关性分析显示乳杆菌属和醋酸菌属与pH降低密切相关;化感物质棕榈酸与醋酸菌属细菌呈正相关,与葡萄球菌属细菌呈负相关。

