小米膳食干预对糖耐量受损患者肠道菌群的影响
任 欣 沈 群
(北京工商大学食品与健康学院;北京食品营养与人类健康高精尖创新中心1,北京 100048)(中国农业大学食品科学与营养工程学院;植物蛋白与谷物加工北京市重点实验室2,北京 100083)
肠道菌群是对寄居在人体肠道内微生物群落的总称,构成复杂、细菌种类繁多,由500~1 000种不同种类的细菌构成[1],其细胞数量约为人体的10倍(1014),基因数量约为人体的100倍[2]。肠道菌群是人体健康的基石[3],近年来,肠道菌群已成为营养与健康等科学研究领域最值得关注的焦点之一,有关肠道微生物的研究正在逐渐改变人们对于膳食营养与疾病的传统观念。大量研究已经证明,肠道微生物与2型糖尿病(T2D)等众多复杂代谢性疾病密切相关[4]。过去50年,人类发现了糖尿病的众多风险因素,而过去10年,科学家发现菌群可能是其中最重要的可变因素[5]。Larsen等[6]通过对比T2D患者与正常人肠道菌群的构成和数量发现T2D患者体内的厚壁菌门和梭菌属所占比例显著降低,拟杆菌门和变形菌门所占比例显著升高。Qin等[4]通过对345份中国T2D患者及正常人群(对照)粪便样本的分析表明,T2D患者的特征为中度肠道微生物失调,即一些常见的产丁酸盐细菌丰度降低,各种条件致病菌以及其他负责还原硫酸盐和抵抗氧化应激的微生物增加。
在能够影响肠道菌群的所有因素中,饮食是最具有影响力且可以改变的因素[7]。基于大规模人群的流行病学研究以及元分析发现,饮食对人类健康的保护作用主要归因于水果、蔬菜和全谷物中的膳食纤维和生物活性物质[8]。
小米是我国典型的全谷物食品。前期研究已经证明小米及其制品的体外淀粉消化速率较慢,体内血糖生成指数较低[9],每日进食50 g小米制品可有效改善IGT患者的血糖代谢[10]。但进食小米是否会影响以及如何影响人体肠道菌群的组成和相对丰度目前尚不清楚。本研究将进一步测定分析IGT患者的肠道菌群在12周小米膳食干预前后的变化,探寻受小米膳食显著影响的肠道微生物,并试图分析肠道菌群在小米膳食干预改善IGT患者血糖代谢过程中的作用。
1 材料与方法
1.1 实验材料
东方亮小米、活性干酵母、泡打粉。DNA抽提试剂盒,PowerSoil-htp 96 Well Soil DNA Isolation Kit;琼脂糖,biowestagArose;扩增试剂盒,GoTaq©Hot Start Colorless Master Mix;纯化试剂盒,QIAquick©PCR Purification Kit。
1.2 仪器与设备
COBAS INTEGRA 800全自动生化分析仪,MultiskanTMGO酶标仪,SYSLG30-IV双螺杆挤压机,NanoDrop2000超微量分光光度计,DYY-6C电泳仪,ABI GeneAmp©9700型PCR仪,Illumina Miseq测序仪。
1.3 实验设计
本实验以前期进行的小米膳食临床营养干预实验为基础,分别采集64名IGT受试者,其中男性27人, 占42.2%,女性37人, 占57.8%;平均年龄(56.0±0.88)岁,平均BMI为(25.98±0.44),在12周干预前后的粪便样本,进行后续肠道菌群的测定分析。小米膳食干预实验的具体步骤参照文献[10]:用50 g生小米制作而成的小米馒头或小米饼代替受试者日常膳食中的部分常规主食(米饭或馒头),不强制要求食用时间,且对受试者其他日常饮食和生活习惯,包括体力活动情况等均不作干预。干预用小米馒头和小米饼由项目组统一制作并真空包装后发放给受试者。本研究得到北京大学生物医学伦理委员会的批准(伦理审查批件号:IRB00001052-14023),并在世界卫生组织国际临床试验注册平台一级——中国临床试验注册中心进行注册(注册号:ChiCTR-OON-16008603)。所有受试者在参与实验前均详细了解实验内容并签署知情同意书。
1.4 粪便样本的收集
分别在基线和末期阶段收集受试者粪便样本进行肠道菌群和短链脂肪酸的检测。粪便样本由受试者在规定时间内按照工作小组提供的采集说明自行采集,采用内含保存液的PSP管进行样本收集,随后置于-80 ℃冰箱保存待检。
1.5 肠道菌群测定
采用16SrRNA进行肠道微生物测序。具体操作如下:基因组 DNA的提取。选用PowerSoil-htp 96 Well Soil DNA Isolation Kit试剂盒对样本的基因组DNA进行提取,之后采用Onedrop仪器和琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样品于离心管中,使用无菌水稀释样品至0.5 ng/μL。PCR扩增。稀释后的基因组DNA为模板;根据测序区域的选择,使用带Barcode的特异引物以及GoTaq©Hot Start Colorless Master Mix进行PCR扩增,以确保扩增效率和准确性。PCR产物的混样和纯化。PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测;根据PCR产物浓度进行等浓度混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物,引物对应区域为16SrRNA的V4区,引物为515F-806R。PCR产物使用QIAquick©PCR Purification Kit试剂盒纯化回收产物。上机测序与下机数据预处理。使用Pico Green荧光定量以及Agilent 2200 TapeStation电泳工作平台检测合格后,使用MiSeq进行上机测序。采用Illumina MiSeq测序平台得到的下机数据存在一定的低质量数据,会干扰分析的结果,因此在进一步分析前,需要对下机数据进行预处理。对高通量测序的原始数据首先根据Barcode的信息,将单个样品数据拆分出来,取出引物序列,进行测序序列质量控制;通过质量检查的序列,应用Ribosomal Database Project(RDP)Classifier 2.3进行序列比对,确定每条序列的分类等级(界、门、纲、目、科、属);最后应用Mothur进行OTUs(Operational Taxonomic Units,分类操作单元)划分,以序列相似性97%为标准,将这些序列划分为OTUs,并按照序列数量生成OTU丰度谱。
1.6 统计分析
数据分析使用SPSS软件,画图使用GraphPad Prism。所有数据以mean±SEM的形式表示。小米膳食干预前后各指标的显著性差异采用配对样本t检验(符合正态分布的指标,LSD)或2相关样本的wilcoxon秩和检验(不符合正态分布的指标)进行判断。P<0.05表示有显著性差异,P<0.01表示有极显著差异。
2 结果与讨论
2.1 小米膳食干预对IGT患者肠道菌群多样性的影响
本次测定共检出2 487种肠道微生物(以序列相似性97%为标准进行OTUs划分),所有样本的稀释性曲线均趋于平缓,Shannon多样性曲线均达到平台期,表明本次测序的数据量较为合理,测序深度足以覆盖样本中的绝大部分微生物,平均覆盖度高达0.998,满足微生物多样性分析要求。物种多样性分析结果见图1,12周小米膳食干预结束后,IGT患者肠道可检测到的OTUs种类与干预前相比显著增加,肠道菌群ACE指数和Chao指数亦显著增加,表明小米膳食干预可以显著提高IGT患者肠道内菌群的物种丰富度。

图1 干预前后IGT患者肠道菌群多样性变化
2.2 小米膳食干预及机体代谢指标对IGT患者肠道菌群的整体影响
从PCA主成分分析图可以看出,经过降维处理后,IGT受试者基线菌群可以与末期菌群较好分开,并且累积贡献率达46.50%(图2a),再次证明12周小米膳食干预可以显著影响受试者肠道微生物的组成及相对丰度。为了进一步明确空腹血糖及胰岛素抵抗指数对受试者肠道菌群的影响,并避免小米膳食干预对结果的干扰,分别以空腹血糖6.1 mmol/L和胰岛素抵抗指数3为界,对基线受试者的肠道菌群进行PCA分析,结果如图2b~图2c所示。无论以空腹血糖还是胰岛素抵抗指数为分类标准,IGT受试者的肠道菌群均可以被明显地分为2个不同的亚群,其累积贡献率分别可达49.13%和51.07%,表明空腹血糖和胰岛素抵抗指数均可以显著改变糖耐量减低患者的肠道微生物相对丰度。类似的,另一项基于糖尿病前期和糖尿病患者的人群横断面研究结果同样表明,IGT、复合性糖耐量受损及T2D患者的肠道菌群总体组成发生变化,基于胰岛素抵抗,可显著区分复合性糖耐量受损/T2D患者与血糖正常者[11]。人类肠道微生物的变化和宿主之间存在复杂的、疾病阶段依赖的相互作用[12]。
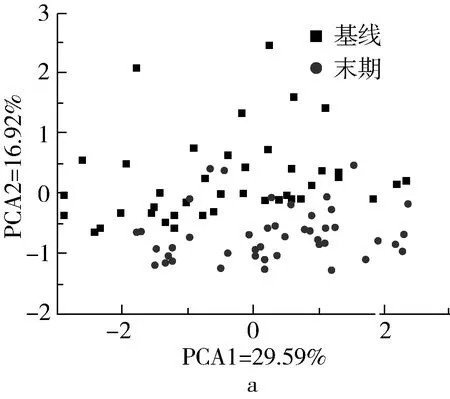
图2 PCA主成分分析图
2.3 小米膳食干预对IGT患者肠道菌群在门水平的影响
本次肠道菌群测序结果显示,厚壁菌门(图3白色所示)是IGT患者肠道内的第一优势菌,其平均相对丰度高达50%以上,位居第二位的是是拟杆菌门(图3灰色所示),二者之和占人体肠道菌群的90%,此消彼长,呈极显著负相关(r=0.94,P=0.00)。其次是变形菌门、放线菌门、梭杆菌门、柔膜菌门(图3)。经过为期12周的小米膳食干预,IGT受试者厚壁菌门的相对丰度显著增加(P=0.01),拟杆菌门的相对丰度显著减少(P=0.03),厚壁菌门/拟杆菌门的比值由干预前的(2.15±0.26)增加到干预后的(3.30±0.46)(P=0.01)。Lee等[13]发现低亚油酸饮食在改善糖尿病肥胖大鼠的代谢反应的同时,提高了厚壁菌门/拟杆菌门的比值,与本研究结果一致。但Li等[14]发现小米在改善肥胖小鼠血脂代谢的同时,降低了厚壁菌门/拟杆菌门的比值。作为人类肠道菌群最重要的两个门,厚壁菌门/拟杆菌门这一指标经常出现在各有关肠道菌群的研究报告中,但结果不一,甚至经常出现相反的结果[5, 15, 16]。与正常人群相比,Larsen等[17]发现T2D患者肠道内厚壁菌门/拟杆菌门显著下降,但Zhao等[18]却发现这一指标在T2D患者中显著上升。据一项汇总了13项病例对照研究结果的研究报道,3项研究结果表明厚壁菌门/拟杆菌门与T2D负相关,即T2D患者肠道内厚壁菌门/拟杆菌门显著下降;4项为正相关,其余6项为无关[5]。研究人员在肥胖患者中同样发现了这一指标的矛盾存在[15]。
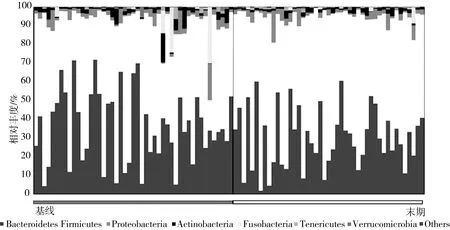
图3 小米膳食干预对肠道菌群门水平相对丰度的影响
2.4 小米膳食干预对IGT患者肠道菌群在纲目科水平的影响
由图4可知,从纲水平而言,糖耐量减低患者的肠道菌群主要由梭菌纲、拟杆菌纲、Negativicutes、γ-变形菌纲、杆菌纲和放线菌纲等组成,并以梭菌纲为优势菌,其相对丰度达50%以上,其次是拟杆菌纲,相对丰度为33%左右。12周小米膳食干预可以显著提高受试者肠道内梭菌纲和杆菌纲的相对丰度,显著降低拟杆菌纲的相对丰度。从目水平而言,糖耐量减低患者的肠道菌群主要由梭菌目、拟杆菌目、Selenomonadales、肠杆菌目、乳杆菌目、双歧杆菌目和梭杆菌目等组成,并以梭菌目和拟杆菌目为优势菌,相对丰度分别为54.1%和31.8%,12周小米膳食干预后,仅梭菌目显著增加,拟杆菌目相对丰度虽有降低但不显著。从科水平而言,糖耐量减低患者的肠道菌群主要由瘤胃球菌科、拟杆菌科、毛螺旋菌科、普雷沃氏菌科、韦荣球菌科、肠杆菌科和乳杆菌科等组成,其中瘤胃球菌科、拟杆菌科和毛螺旋菌科占比较高,相对丰度分别为29.32%、21.92%和21.06%。经12周小米膳食干预后,受试者肠道内的瘤胃球菌科显著增加,普雷沃氏菌科显著减少。瘤胃球菌科属于肠道内有益菌,已有研究将其定义为健康老龄化即长寿的关键指示菌[19]。因此本研究瘤胃菌科相对丰度的显著增加再次证明小米膳食使得糖耐量减低患者的肠道菌群朝着更为健康有利的方向发展。
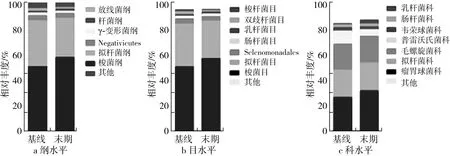
图4 小米膳食干预对肠道菌群纲、目、科水平相对丰度的影响
2.5 小米膳食干预对IGT患者肠道菌群在属水平的影响
从属水平而言,糖耐量减低患者的肠道菌群主要由拟杆菌属、柔嫩梭菌、未分类毛螺菌科、普氏菌属、未分类瘤胃菌科、瘤胃球菌属和毛螺菌属等组成,具体相对丰度如图5所示。Arumugam等根据拟杆菌属、普氏菌属和瘤胃球菌属相对丰度的不同,将人类肠道菌群分为三种菌型[20],本研究受试者均属于以拟杆菌属为优势菌的B型。

注:*代表未分类,右上角小图为干预前后柔嫩梭菌属的相对丰度。
柔嫩梭菌属为糖耐量减低受试者肠道内的第二优势菌,经过为期12周的小米膳食干预后,其相对丰度由干预前的14.42%增加为干预后的19.99%,呈极显著差异。柔嫩梭菌属于厚壁菌门、梭菌纲、梭菌目、瘤胃球菌科。体外培养实验发现柔嫩梭菌能够发酵葡萄糖产生少量的甲酸、D-乳酸以及大量的丁酸[21]。丁酸在维持肠道健康和发挥肠道功能方面占有重要地位,有关丁酸阻止病原菌入侵、维持免疫系统正常功能以及减缓癌症进程等多种生理功能相继被报道[22]。体内研究同样发现柔嫩梭菌属是人体肠道内的关键性功能菌,与宿主多条代谢途径相关[23]。多项研究指出,肠道易激综合症[24]、溃疡性结肠炎[25]、肥胖[26]、乳糜泻[27]等患者肠道内柔嫩梭菌的相对丰度均显著低于健康者。Ramirez-Farias等[28]发现益生元菊粉能够显著增加肠道内柔嫩梭菌的丰度,Sokol等[29]通过体内外实验证实柔嫩梭菌属具有抗炎功效,并且能够降低克罗恩病患者术后复发的几率,Munukka[30]发现与高脂饮食对照小鼠相比,高脂饮食+口服柔嫩梭菌群可改善小鼠的肝脏健康并减少脂肪组织炎症。柔嫩梭菌已成为众多研究者公认的大有可为的二代益生菌[31]。据此推测,小米膳食可能通过增加菌群多样性、改变IGT患者肠道菌群组成,尤其是增加柔嫩梭菌的相对丰度来实现降低血糖的功效。
3 结论
对比12周小米膳食干预前后IGT患者肠道微生物的组成和相对丰度,结果表明,小米膳食干预可显著改变IGT患者的肠道菌群,显著提高菌群多样性、厚壁菌门/拟杆菌门比值和柔嫩梭菌属的相对丰度。据此推测,小米膳食干预可通过改变IGT患者肠道菌群的组成和相对丰度来改善机体血糖代谢。

