T-cadherin通过Wnt/ERK/PI3K-AKT信号通路在胃癌细胞自噬、细胞周期阻滞及上皮间质转化中的作用研究
李立新, 蒲竞, 蔡翠芳, 李文详
胃癌是最常见的恶性肿瘤之一,全球范围内胃癌的发病率在恶性肿瘤中居第五位,死亡率居第三位,给人们的健康带来严重威胁[1]。据报道,全世界范围内,患者在胃癌早期阶段被成功诊断的不到五分之一[2]。在包括中国在内的一些东亚国家,胃癌发病率明显高于其他国家[3]。迄今为止,手术和放、化疗是胃癌的主要治疗手段,但仍达不到理想的治疗效果[4]。因此,探究胃癌的发病机制,对于开发新的治疗方法至关重要。钙黏蛋白超家族(cadherin)是细胞表面糖蛋白,主要调节Ca2+介导的细胞黏附,影响细胞极性、形态发生以及细胞识别和信号转导[5]。T-钙黏蛋白(T-cadherin,T-cad)是钙黏蛋白超家族成员之一,其缺乏跨膜结构域,通过糖基磷脂酰肌醇(glycosyl-phosphatidyl inositol,GPI)结合细胞膜[6]。T-cadherin在多种癌症中显著下调,提示其可能作为抗癌蛋白参与癌症的发生发展过程[7]。已有研究证明,上调T-cadherin可抑制胃癌细胞增殖、迁移和侵袭[8]。锌指蛋白545和青藤碱通过抑制Wnt/β-catenin、PI3K/AKT和MAPK/ERK信号通路活化在大肠癌和胃癌中起抑癌作用[9-10]。目前,还未有关于T-cadherin通过Wnt/ERK/PI3K-AKT信号通路对胃癌细胞作用的研究。本研究旨在探究T-cadherin通过Wnt/ERK/PI3K-AKT信号通路对胃癌细胞自噬、细胞周期阻滞和上皮向间质转化的影响,以期为探讨胃癌发病机制和开发新的治疗靶点提供依据。
1 材料与方法
1.1 主要试剂和仪器 人胃癌细胞系AGS购自美国模式培养物集存库;人胃黏膜上皮细胞系GES-1购自武汉普诺赛生命科技有限公司;T-cadherin和阴性对照(NC)慢病毒液购自武汉金开瑞生物工程有限公司;胎牛血清(FBS)购自美国Invitrogen公司;RPMI 1640培养基购自美国Thermo Fisher Scientific公司;CCK-8购自日本同仁研究所;Annexin V-FITC细胞凋亡检测试剂盒和DNA含量检测试剂盒(细胞周期)购自北京索莱宝科技有限公司;T-cadherin、神经型钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)和上皮型钙黏蛋白(E-cadherin)抗体购自圣克鲁斯生物技术(上海)有限公司;B淋巴细胞瘤-2(Bcl-2)、Bcl-2关联X蛋白(Bax)、Wnt、β-连环蛋白(β-catenin)、细胞外调节蛋白激酶(ERK)和甘油醛-3-磷酸脱氢酶(GAPDH)抗体均购自武汉三鹰生物技术有限公司;cleaved caspase 3、p-ERK和PI3K抗体购自美国Abcam公司;Beclin1、轻链3(LC3)、p-AKT和AKT抗体购自美国Cell Signaling Technology公司;流式细胞仪购自美国贝克曼公司;酶标仪购自美国Thermo Fisher Scientific公司;蛋白电泳仪购自美国Bio-Rad公司。
1.2 细胞培养及慢病毒感染 AGS和GES-1细胞均用含10%FBS的RPMI 1640培养基,于37 ℃、5%CO2条件下培养。将对数期生长的AGS细胞按1×105个/孔数量加入6孔板内,24 h后,将每孔内培养基更换为含5 μg/ml聚凝胺和2%FBS的新鲜培养基,将细胞分为3组:空白组、NC组和T-cad组,向孔内添加25 MOI的NC和T-cad慢病毒液,继续培养24 h后,更换含10%FBS的新鲜培养基,培养48 h后,进行后续实验。另外将细胞分为NC组、HCQ组、T-cad组和T-cad+HCQ组,向孔内添加25 MOI的NC、T-cad慢病毒液和羟氯喹(HCQ,自噬抑制剂),继续培养24 h后,更换含10%FBS的新鲜培养基,培养48 h后,进行后续实验。其中,HCQ终浓度为30 μmol/L。
1.3 CCK-8检测胃癌细胞活力 将对数期生长的AGS细胞接种于96孔板(5×103个/孔),37 ℃、5%CO2条件下培养0、24、48和72 h后,每孔加入10 μl CCK-8,37 ℃、5%CO2条件下孵育3 h。酶标仪测定各孔在450 nm处的光密度(OD)值。
1.4 克隆形成实验检测胃癌细胞的增殖能力 取200个对数生长期的AGS细胞,接种于培养板中,于37 ℃、5%CO2条件下培养2周。无水乙醇固定细胞,1%结晶紫染色10 min,流水洗去染液,空气干燥。
1.5 流式细胞术检测胃癌细胞周期变化和凋亡 细胞周期检测:收集慢病毒感染后的AGS细胞,70%预冷乙醇固定,PBS清洗后,RNase A溶液重悬细胞,37 ℃水浴30 min。加入PI染色液,4 ℃避光孵育30 min,上流式细胞仪检测。细胞凋亡检测:收集慢病毒感染后的AGS细胞,PBS清洗细胞后,Binding Buffer重悬细胞,随后加入Annexin V-FITC室温避光孵育15 min,加入PI室温避光孵育5 min,1 h内用流式细胞仪检测。
1.6 Western blotting检测胃癌细胞T-cadherin、自噬和Wnt/ERK/PI3K-AKT通路相关蛋白的表达 收集慢病毒感染后的AGS细胞,RIPA裂解液裂解细胞,取上清,BCA法检测蛋白浓度。取30 μg蛋白进行SDS-PAGE分离,湿转法将蛋白转至PVDF膜上。10%脱脂奶粉室温封闭3 h,加入T-cadherin(1∶1 000)、Bcl-2(1∶1 000)、Bax(1∶2 000)、cleaved caspase 3(1∶1 000)、Wnt(1∶1 000)、β-catenin(1∶2 000)、p-ERK(1∶1 000)、ERK(1∶1 000)、PI3K(1∶1 000)、p-AKT(1∶1 000)、AKT(1∶1 000)、N-cadherin(1∶1 000)、Vimentin(1∶1 000)、E-cadherin(1∶2 000)、Beclin1(1∶1 000)、LC3(1∶1 000)和GAPDH抗体(1∶2 000)抗体4 ℃过夜孵育,TBST清洗后,HRP标记二抗(1∶2 000)室温孵育1 h。ECL化学发光法检测蛋白条带并拍照。

2 结果
2.1 各组细胞T-cadherin表达、细胞活力及增殖能力比较 Western blotting实验结果显示,与GES-1组相比,空白组的T-cadherin表达显著降低;与NC组相比,T-cad组T-cadherin表达显著升高,差异均有统计学意义(P<0.05,图1A)。CCK-8和克隆形成实验结果显示,T-cad组48 h和72 h的细胞活力低于NC组,细胞克隆数亦显著低于NC组,差异均有统计学意义(P<0.05,图1B、1C)。
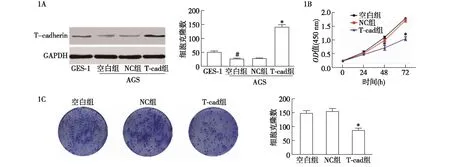
1A:Western blotting检测细胞T-cadherin蛋白表达;1B:CCK-8检测细胞活力;1C:克隆形成实验检测细胞增殖情况;与GES-1组比较,#P<0.05;与阴性对照(NC)组比较,*P<0.05
2.2 各组细胞周期、凋亡和Bcl-2、Bax及cleaved caspase 3蛋白表达水平比较 与NC组相比,T-cad组G1期细胞比例显著升高,S期和G2/M期细胞比例显著降低,差异有统计学意义(P<0.05,图2A);T-cad组的细胞凋亡率、Bax和cleaved caspase 3蛋白表达水平显著高于NC组,Bcl-2蛋白表达水平显著低于NC组,差异有统计学意义(P<0.05,图2B、2C)。
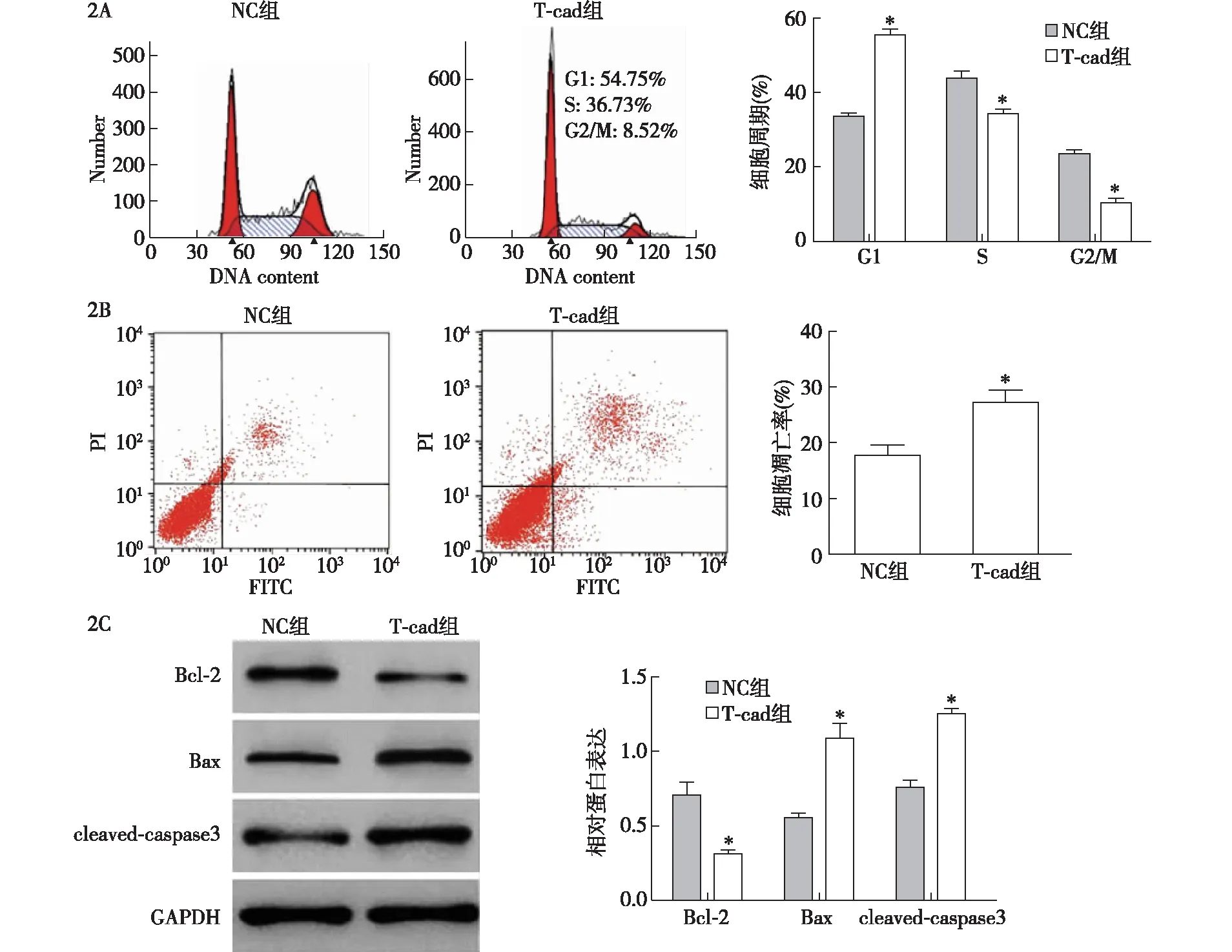
2A:流式细胞术检测细胞周期;2B:流式细胞术检测细胞凋亡;2C:Western blotting检测Bcl-2、Bax及cleaved caspase 3蛋白表达;与阴性对照(NC)组比较,*P<0.05
2.3 各组细胞Beclin1、LC3Ⅰ和LC3Ⅱ蛋白表达及细胞凋亡比较 与NC组相比,HCQ组细胞的Beclin1和LC3Ⅱ/LC3Ⅰ表达水平显著降低(P<0.05),细胞凋亡率无显著变化(P>0.05),T-cad组细胞Beclin1、LC3Ⅱ/LC3Ⅰ表达和细胞凋亡率显著升高,差异有统计学意义(P<0.05);与T-cad组相比,T-cad+HCQ组细胞的Beclin1、LC3Ⅱ/LC3Ⅰ表达和细胞凋亡率均显著降低,差异有统计学意义(P<0.05),见图3A、3B。
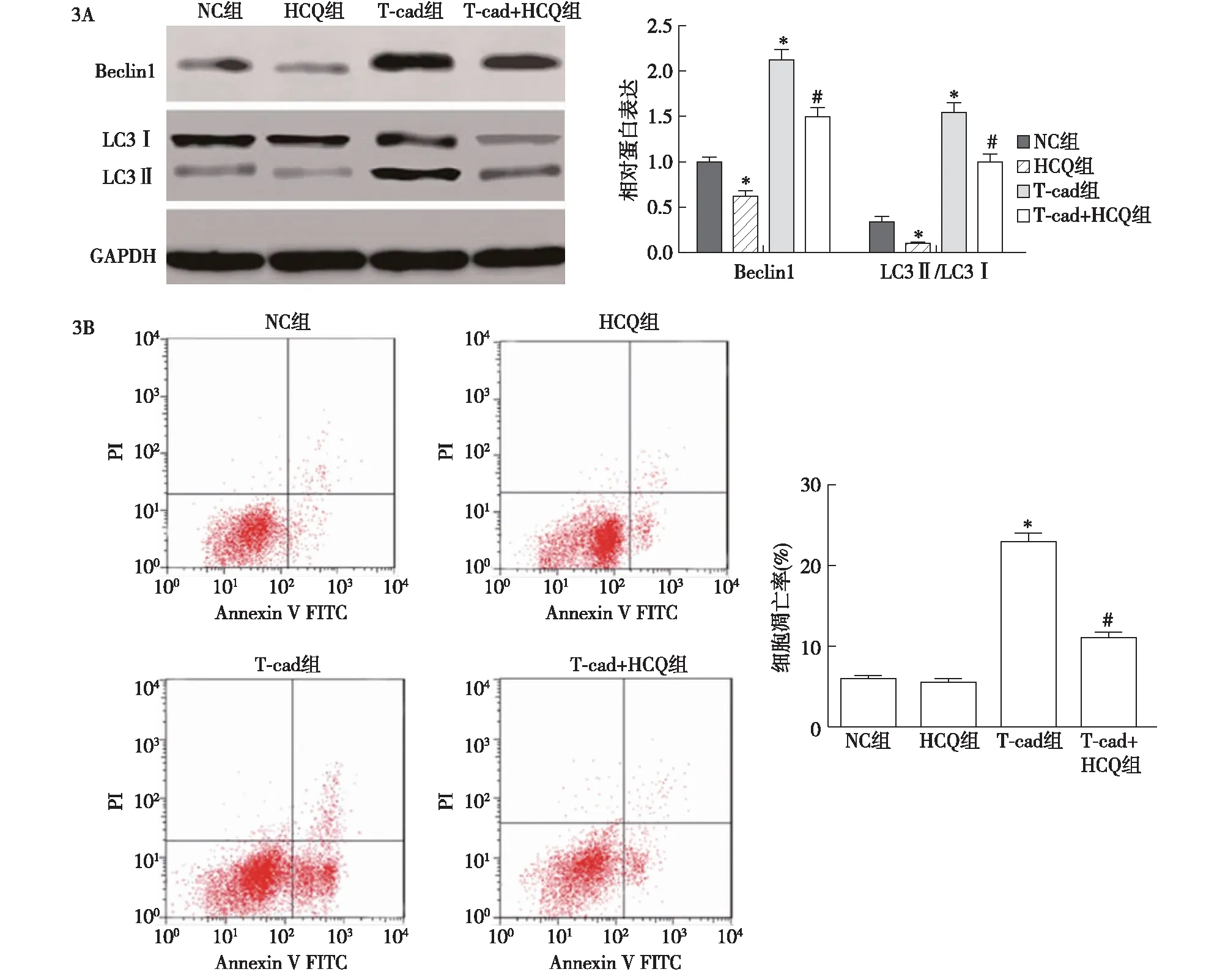
3A:Western blotting检测细胞自噬蛋白Beclin1、LC3Ⅰ和LC3Ⅱ蛋白表达;3B:流式细胞术检测细胞凋亡;与阴性对照(NC)组比较,*P<0.05;与T-cad组比较,#P<0.05
2.4 各组细胞E-cadherin、N-cadherin和Vimentin蛋白表达水平比较 与NC组相比,T-cad组细胞的E-cadherin蛋白表达水平显著升高,N-cadherin和Vimentin蛋白表达水平显著降低,差异有统计学意义(P<0.05,图4)
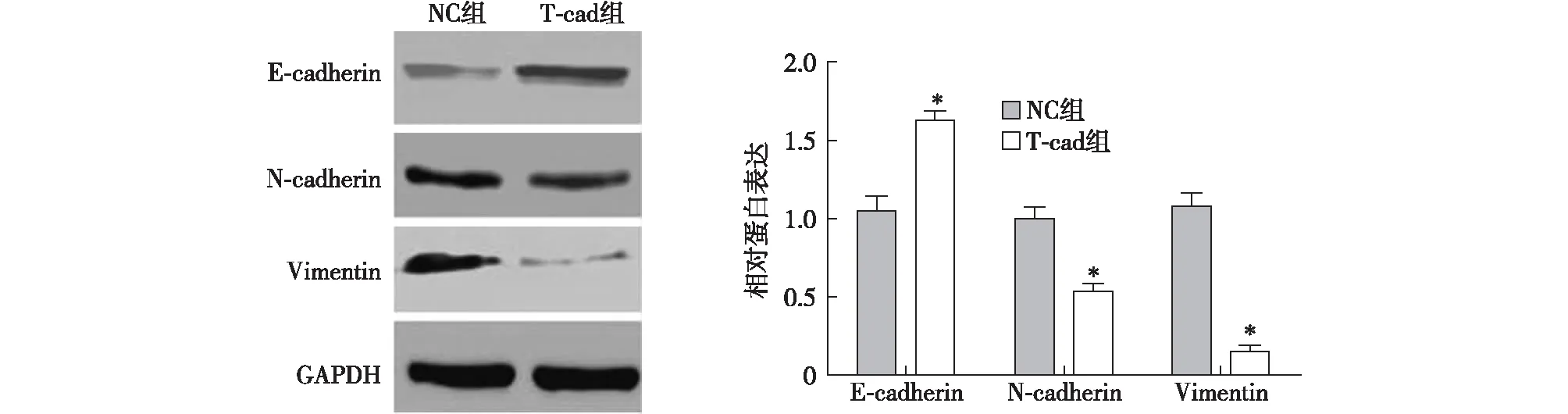
注:与阴性对照(NC)组比较,*P<0.05
2.5 各组细胞Wnt/ERK/PI3K-AKT信号通路相关蛋白表达的比较 与NC组相比,T-cad组细胞的Wnt、β-catenin、p-ERK/ERK、PI3K和p-AKT/AKT表达均显著降低,差异有统计学意义(P<0.05,图5)。
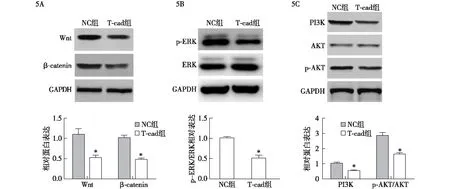
5A:Western blotting检测Wnt和β-catenin蛋白表达;5B:Western blotting检测p-ERK和ERK蛋白表达;5C:Western blotting检测PI3K、p-AKT和AKT蛋白表达。与阴性对照(NC)组比较,*P<0.05
3 讨论
GC是起源于胃黏膜上皮的恶性肿瘤,由于GC的晚期诊断、耐药性和转移等因素,以及对GC发生和发展过程中涉及的分子机制缺乏了解,致使胃癌的治疗效果仍不理想[11-12]。T-cadherin是钙黏蛋白超家族中的成员之一,可以充当信号受体,参与环境识别,并调节细胞运动性、增殖和表型[13-14]。T-cadherin对细胞黏附的调节涉及多种生物学过程,如运动轴突的负向导引,胚胎发育过程中的后肢轨迹、细胞增殖、迁移和肿瘤中的血管重塑[7]。T-cadherin参与调控多种癌症的生物学进展,而关于T-cadherin是否参与胃癌发生发展过程的相关研究寥寥无几。
T-cadherin位于染色体16q24区域,该区域在多种癌症中常受到致癌性修饰,T-cadherin表达的缺失与肿瘤细胞侵袭性和增殖能力的增强有关[15]。研究表明,T-cadherin的缺失和高甲基化可促进人类非小细胞肺癌的致瘤性和进展[16]。T-cadherin还可抑制子宫内膜异位症中子宫内膜基质细胞的侵袭和迁移[17]。乙酰化酶抑制剂Garcinol通过上调T-cadherin的表达,抑制宫颈癌细胞活力、集落形成、侵袭、迁移及细胞周期进程,并促进宫颈癌细胞凋亡,抑制异种移植模型中的肿瘤生长[18]。已有研究表明,上调T-cadherin抑制体外胃癌细胞的增殖、迁移和侵袭[19]。本研究结果显示,T-cadherin在胃癌细胞中表达下调,其过表达可显著抑制胃癌细胞增殖,将细胞周期阻滞于G1期,并促进细胞凋亡。有证据表明,姜黄素通过促进胃癌细胞自噬从而诱导细胞凋亡[20]。本研究结果也显示T-cadherin通过促进胃癌细胞自噬而诱导细胞凋亡。
越来越多的证据表明,上皮间质转化(epithelial-mesenchymal transition,EMT)促进癌症进展[21-22]。EMT是上皮细胞失去其上皮特征并获得间充质表型的过程,该过程使癌细胞与原发肿瘤分离并迁移到其他组织。此外,EMT的特征是E-cadherin的丧失,这与间充质相关蛋白(如Vimentin、N-cadherin)的表达增加有关[23]。本研究结果显示,T-cadherin抑制胃癌细胞上皮间质转化。
Wnt/ERK/PI3K-AKT信号通路与人类癌症的发展密切相关。阻断胃癌细胞中的Wnt/β-catenin信号传导可抑制其生长、增殖、细胞周期进程、迁移、侵袭、EMT和化疗耐受性[24]。激活AKT/ERK通路可促进胃癌细胞增殖和侵袭,并降低胃癌细胞对顺铂和紫杉醇的敏感性[25]。研究表明,下调T-cadherin的表达可通过激活宫颈癌细胞中的P13K/AKT信号通路逆转Garcinol对宫颈癌细胞发育的抑制作用[18]。本研究结果显示,T-cadherin可抑制胃癌细胞中Wnt/ERK/PI3K-AKT信号通路活化。
综上所述,T-cadherin可能通过抑制Wnt/ERK/PI3K-AKT信号通路活化从而抑制胃癌细胞增殖和EMT,促进细胞自噬并进一步诱导细胞凋亡。

