胃癌患者血清sST2水平与病理特征的关系及对预后的预测价值
黄保荣, 刘晓宏, 严玲霞, 张雄
胃癌是我国发病率最高的消化道恶性肿瘤,发病的相关因素包括饮食、环境、遗传等,具体的发病机制尚未完全清楚。虽然随着近些年医疗技术的发展、胃镜检查的普及,胃癌的早期诊断率有所提高,但临床上多数胃癌患者确诊时仍已发展至进展期,手术切除后的复发率及转移率较高、5年生存率较低[1-2]。在临床中,准确判断胃癌的病理特征、早期预测胃癌的远期生存能够为个体化诊疗方案的制定提供依据,也有助于改善患者的预后。
ST2是重要的白介素1受体家族成员,参与免疫应答及炎症反应的调控,能够促进Th2型细胞因子的产生并促进多种恶性肿瘤的发生发展。可溶性ST2(soluble ST2,sST2)是细胞膜受体ST2在蛋白酶水解作用下脱落进入血液循环的产物,乳腺癌、肝癌患者血清中sST2的含量明显升高[3-4]。胃癌相关的研究证实,胃癌组织中ST2的表达明显增加[5],但胃癌患者血清中sST2水平的变化及相应的临床病理意义尚不清楚。因此,本研究将以胃癌患者为对象,具体分析血清sST2水平与胃癌病理特征的关系及对预后的预测价值。
1 资料与方法
1.1 一般资料 选择2014年3月至2016年3月期间在我院接受手术切除的84例胃癌患者作为研究中的胃癌组,入组标准:①经术后病理诊断为胃癌;②临床病理资料完整;③随访资料完整;④术前均留取血清样本。排除标准:①既往有恶性肿瘤病史;②术前接受过放化疗等抗肿瘤治疗;③术后未正规治疗及随访。另取同期在我院体检的100例健康志愿者作为对照组,均经体检证实体健。胃癌组中男性52例、女性32例,年龄39~61岁,平均(49.58±9.92)岁;对照组中男性64例、女性36例,年龄35~60岁,平均(47.85±11.47)岁。两组性别对比(χ2=0.086,P=0.769),年龄对比(t=1.083,P=0.280),差异无统计学意义(P>0.05),具有可比性。
1.2 血清sST2水平的检测 取胃癌组及对照组的血清样本,采用上海西唐公司生成的酶联免疫吸附试剂盒检测sST2水平,均按照试剂盒的说明书进行操作。
1.3 术后随访 采用门诊复诊、电话或网络软件回访等方式对胃癌患者进行术后随访,以手术后第1天作为随访起点,术后前2年每3个月随访1次、术后第3年起每6个月随访1次,随访截至2020年1月或患者死亡。随访内容为总生存期(overall survival,OS)及无病生存期(disease-free survival,DFS)。

2 结果
2.1 胃癌组与对照组血清sST2水平的比较 对照组血清sST2表达水平为(73.39±15.47)pg/ml,胃癌组为(628.13±276.24)pg/ml,两组相比,差异有统计学意义(t=20.055,P<0.001)。
2.2 胃癌组中不同临床病理特征患者血清sST2水平的比较 胃癌组中不同性别、年龄、肿瘤直径患者之间血清sST2水平比较,差异无统计学意义(P>0.05);TNMⅢ期、低/未分化、有淋巴结转移患者的血清sST2水平高于TNMⅠ~Ⅱ期、中/高分化、无淋巴结转移的患者,差异有统计学意义(P<0.05),见表1。
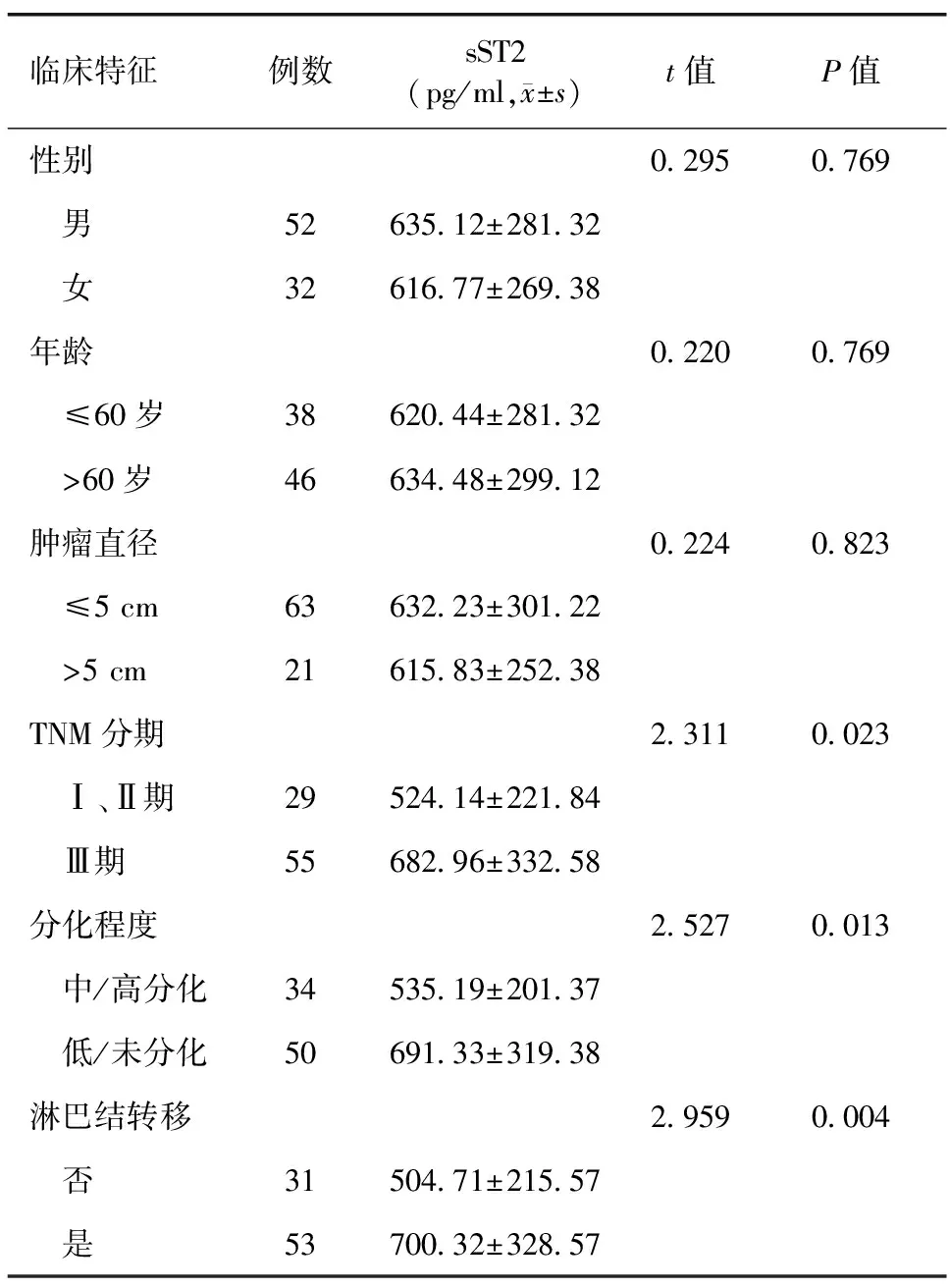
表1 胃癌组中不同临床病理特征患者血清sST2水平的比较
2.3 胃癌组中不同血清sST2水平患者OS和DFS的比较 按照胃癌组患者血清sST2水平的中位数将其分为sST2高水平和低水平患者,绘制OS和DFS的Kaplan-Meier曲线,进行Log-rank检验后发现,高sST2患者的OS和DFS均较低sST2患者缩短,差异有统计学意义(P<0.05),见图1、图2。
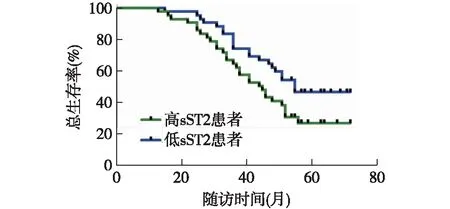
图1 胃癌组中不同血清sST2水平患者OS的Kaplan-Meier曲线

图2 胃癌组中不同血清sST2水平患者DFS的Kaplan-Meier曲线
2.4 血清sST2水平预测胃癌患者OS和DFS的ROC曲线分析 绘制血清sST2水平预测胃癌患者OS和DFS的ROC曲线,曲线下面积分别为0.789[95%CI(0.694,0.884),P<0.001]和0.805[95%CI(0.701,0.908),P<0.001],根据约登指数最大值确定sST2预测OS和DFS的最佳截断值分别为644.0 pg/ml和453.8 pg/ml,该截断值的灵敏度分别为55.77%和63.64%,特异度分别为90.91%和87.30%。见图3、图4。
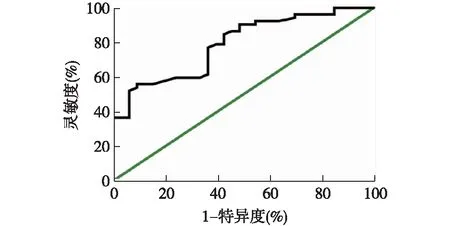
图3 血清sST2水平预测胃癌患者OS的ROC曲线
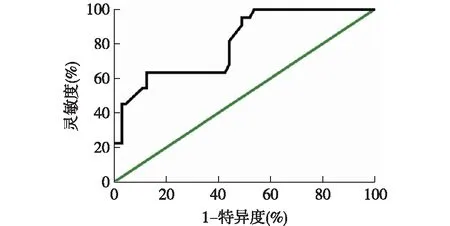
图4 血清sST2水平预测胃癌患者DFS的ROC曲线
3 讨论
胃癌具有发病率高、早期诊断率低、预后差、5年生存率低的特点,多数胃癌患者确诊时已经是进展期,存在TNM分期高、分化程度低、合并淋巴结转移等病理特征[6]。多项胃癌相关的临床研究表明,胃癌患者病理特征的恶化是预后的重要影响因素[7-8]。因此,寻找能够准确评估胃癌病理特征、早期预测胃癌预后的标志物对判断病情、协助制定诊疗方案均具有积极意义。
ST2是白介素1受体家族的新成员,其特异性配体是IL-33,IL-33与ST2结合后能够促进IL-4、IL-5等Th2细胞因子的表达,进而促进癌细胞发生免疫逃逸,有利于癌细胞的增殖、侵袭及血管新生[9]。多项ST2与恶性肿瘤的相关研究表明,ST2在胃癌[5]、结直肠癌[10]、食管癌[11]等组织中均呈显著高表达趋势,且与肿瘤病理特征的恶化有关。细胞膜ST2在蛋白酶的作用下发生水解后脱落,进入血液循环,成为sST2[12],sST2在肝癌[3]和乳腺癌[4]患者血清中的水平明显增加。本研究分析了胃癌患者血清中sST2的变化并发现,胃癌组患者血清sST2的水平高于对照组,这一结果与胃癌病灶内ST2表达上调的结果一致,提示血清sST2可能成为评估胃癌病情的标志物。
与肺癌、黑色素瘤、胶质瘤相关的基础研究发现,IL-33/ST2轴对癌细胞的增殖、侵袭、血管新生具有促进作用[13-15]。在胃癌的发生发展过程中,胃癌细胞表现出极强的增殖、侵袭、血管新生等恶性生物学特征,进而能够促进胃癌出现相应病理特征的恶化,如TNM分期增加、分化程度降低、淋巴结转移。本研究通过分析不同病理特征胃癌患者血清sST2的差异可知:随着胃癌TNM分期的增加、分化程度的降低、淋巴结的转移,患者血清sST2的水平增加,表明sST2的增多与多项胃癌病理特征的恶化有关,这与ST2促进癌细胞增殖、侵袭、血管新生的生物学效应吻合。
胃癌病理特征的恶化是预后的影响因素,国内蒋大平等[7]和顾永娟等[8]的研究表明,浸润深度、淋巴结转移两项病理特征是胃癌患者预后的影响因素。本研究所观察的标志物sST2是癌细胞增殖、侵袭、血管新生的调控分子,其含量增多与胃癌多种病理特征的恶化有关。为了进一步明确sST2在胃癌病情评估中的价值,本研究对胃癌患者的预后进行了随访并分析了sST2对预后的预测价值。经Kaplan-Meier曲线分析,与低sST2胃癌患者比较,高sST2胃癌患者的OS和DFS均明显缩短,提示sST2的升高与远期预后的恶化、生存时间的缩短有关;经ROC曲线验证sST2对预后的预测价值可知:血清sST2水平对OS和DFS具有预测价值。
综上所述,胃癌患者血清sST2水平明显升高,并与肿瘤的TNM分期、分化程度、淋巴结转移等病理特征恶化有关;同时,sST2升高与远期预后的恶化、生存时间的缩短有关,能够预测患者的远期预后。

