蜘蛛香总黄酮对乳腺癌细胞侵袭转移抑制作用的实验研究
姚欢欢,陈思思,邵锦晖,陈 吉
(1湖州市第三人民医院·浙江 湖州 313002; 2杭州市富阳区中医院·浙江 杭州 311400)
乳腺癌已成为当今世界危害女性身心健康最常见的恶性肿瘤,其发病率高居女性恶性肿瘤的首位[1],根据美国国家肿瘤研究所预测,每个女性在其一生中有13.2%的概率患乳腺癌[2-3]。乳腺癌的发病率增长速度很快,采取早期诊断、早期治疗手段能够明显提高乳腺癌的治疗效果,然而,乳腺癌术后复发和转移是乳腺癌的主要死因,因此寻求有效的抑制乳腺癌转移的药物已成为当下的研究热点[4]。蜘蛛香,又被称为马蹄香、老虎七、土细辛等,系败酱科缬草属植物蜘蛛香(ValerianaJatamansiJones)的干燥根茎和根。近年来,关于蜘蛛香提取物在抗焦虑以及抗氧化等方面的作用都有报道[5-6],然而,目前对蜘蛛香抗肿瘤作用的研究主要集中在蜘蛛香中的环烯醚萜化合物[7-8]。蜘蛛香总黄酮(total flavonoids fromValerianaJatamansiJones,TFV)是蜘蛛香中的主要活性成分之一,具有抗炎、抑菌、抗肿瘤等作用[9],然而其在乳腺癌侵袭转移当中的作用及机制少有报道。因此,本文拟以具有强侵袭性的人乳腺癌细胞株MDA-MB-231为研究对象,研究TFV对MDA-MB-231细胞侵袭转移的影响并进一步阐明其作用机制。
1 材料
1.1 细胞 乳腺癌细胞MDA-MB-231购买于中国科学院上海细胞库。
1.2 实验药物 蜘蛛香购于贵州遵义市药材市场;根据文献提供方法[10],采用超生提取法,从干燥粉末中提取TFV,用大孔树脂进行纯化后,经紫外分光光度法测得总黄酮含量为44.38%,将药物至于-20 ℃保存备用。
1.3 试剂 DMEM培养液、胎牛血清:美国Hyclone公司,批号:SH30021.01、SH30084.03;RIPA裂解液、BCA蛋白浓度测定试剂盒:上海碧云天公司,批号:P0013K、P0012;四甲基亚唑蓝(MTT)、DMSO:美国Sigma公司,批号:M2128、D2650;Matrigel胶:北京索莱宝科技有限公司,批号:356234;荧光定量PCR试剂盒PrimeScriptTMRT Master Mix:日本Takara公司,批号:RR036Q;一抗(MMP-2、MMP-9、E-cadherin、N-cadherin、Vimentin、GAPDH):美国CST公司,批号:40994、13667、3194、13116、5741、5174;辣根过氧化物酶标记山羊抗兔二抗、ECL显影液:美国BIO-RAD公司,批号:350003248、102030719。
1.4 仪器 SW-CJ-1FD超净工作台:苏州净化设备有限公司;3111型二氧化碳培养箱:美国Thermo公司;ECLIPSE Ti型荧光倒置显微镜:日本Nikon公司;MDF-U3386S 型超低温冰箱:日本Sanyo公司;X715 XK-8型转移脱色摇床:江苏新康医疗器械有限公司;PowerPac Basic电泳仪:美国BIO-RAD公司;3300 Mini化学发光成像系统:中国CLinX公司;CFX-Connect型荧光定量PCR仪:美国Bio-Rad公司;移液枪(多规格):德国Eppendorf公司。
2 实验方法
2.1 细胞培养 MDA-MB-231细胞株培养于含10%的胎牛血清、青霉素200 U/mL、链霉素200 U/mL的完全培养液,置于37 ℃、5% CO2培养箱中培养。每3 d换液1 次,待细胞密度至80%~90%,以0.25%胰蛋白酶消化,按1∶3传代,置37 ℃、5% CO2培养箱内继续培养,取对数期细胞用于实验。
2.2 MTT法检测细胞相对存活率 收集对数期MDA-MB-231细胞,调整细胞密度为3 000个/孔,每孔100 μL加入到96孔板,置37 ℃含有5% CO2培养箱培养。待细胞贴壁后加入TFV,其药液终浓度分别为0、10、20、30、40、50、60 mg/L,用药组和对照组均设4个复孔继续培养48 h,每孔加入20 μL浓度为5 g/L的MTT溶液,培养箱中继续孵育4 h后每孔加入200 μL三联液,将96孔板放到外用37 ℃恒温培养箱中作用18 h,在570 nm条件下测定吸光度OD值。
2.3 细胞划痕实验检测MDA-MB-231细胞迁移能力 取对数期细胞,1 000 r/min 离心5 min。弃去上清,加入适量完全培养基悬浮沉淀,计数,调整细胞密度。以 6×105个/孔的细胞密度接种于6 孔板中培养。待细胞长成单层即弃去培养液,用200 μL的枪头在24孔板每孔中央划出一道划痕,洗去死细胞后显微镜下拍照。按实验设计分空白对照组、20 mg/L组、40 mg/L组,处理24、48 h 后,在同一观察点处显微镜拍照记录细胞生长情况,实验重复3次。利用Image J软件测量每孔多个点划痕间距,取均值,并用处理前的距离减去处理后的距离即为24 h和48 h细胞迁移距离。
2.4 Transwell实验检测MDA-MB-231细胞侵袭能力 将无血清培养基500 μL,水化基底膜10 min,上室加入200 μL浓度为2×104个/mL的细胞悬液,下室分别加入500 μL 含TFV质量浓度为0、20、40 mg/L的无血清培养基,将细胞置于37 ℃,5% CO2及饱和湿度的细胞培养箱中孵育24 h。从培养箱中取出小室,弃去上室液体,用甲醇固定5 min,PBS洗3次,用苏木素和尹红各染5 min,自来水冲洗,冲去残余的染料。用棉签擦去上室内的细胞,Transwell小室反过来底朝上在正置显微镜下观察,拍照,计数视野内的细胞数,即细胞从小室上室穿越Matrigel胶和聚碳酯膜的细胞侵袭数。
2.5 荧光定量PCR法检测MDA-MB-231细胞MMP-2、MMP-9 mRNA表达水平 将0、20、40 mg/L的TFV处理MDA-MB-231细胞24 h,Trizol法提取各组细胞总RNA,采用荧光定量PCR试剂盒检测MMP-2、MMP-9 mRNA的表达情况,以GAPDH为内参。
MMP-2上游引物:5’-AATGCCATCCCTGATAACCT-3’,下游引物:5’-GCTTCCAAACTTCACGCTCT-3’。MMP-9上游引物:5’-TCCCTGGAGACCTGAGAACC-3’,下游引物:5’-GCCACCCGAGTGTAACCAT-3’。GAPDH上游引物:5’-ACTTTGGTATCGTGGAAGGACTCAT-3’,下游引物5’-GTTTTTCTAGACGGCAGGTCAGG-3’。
2.6 Western blot检测MDA-MB-231细胞MMP-2、MMP-9以及EMT相关蛋白表达 将状态良好的MDA-MB-231细胞以8×105/孔传代于6 cm培养皿中,待细胞贴壁之后,按照分组的情况加入含有不同浓度TFV的完全培养基,作用24 h后加入裂解液,冰上裂解30 min后离心(12 000 r/min)取上清,采用BCA试剂盒测定蛋白浓度后,处理蛋白随后上样。用SDS-PAGE分离总蛋白,随后用湿转法转移至PVDF膜上,一抗4 ℃过夜,二抗室温孵育2 h后显影。
2.7 统计学处理 每组实验重复3次,实验结果用SPSS 22.0统计软件进行分析,采用两独立样本t检验统计学方法,当P<0.05时具有统计学意义。
3 结果
3.1 TFV对MDA-MB-231细胞增殖活性的影响 见图1。随着TFV浓度逐渐升高,其对MDA-MB-231细胞的抑制作用逐渐增强,当浓度达到50 mg/L时出现统计学差异(P<0.05)。表明TFV能够在一定程度上抑制MDA-MB-231细胞的增殖,呈现剂量依赖性。选择低于50 mg/L的TFV浓度作为后续侵袭转移实验的药物浓度,以排除其抗增殖能力对实验结果的影响。
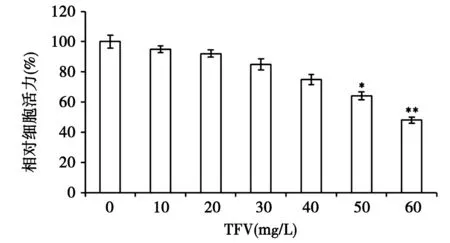
与空白对照组比较,*P<0.05,**P<0.01图1 TFV对MDA-MB-231细胞增殖的抑制作用
3.2 TFV对MDA-MB-231细胞迁移能力的影响 见图2,质量浓度为20、40 mg/L的TFV作用于MDA-MB-231细胞12 h和24 h后,划痕的愈合能力显著低于空白对照组(P<0.05),并呈剂量依赖性。此结果表明,TFV有抑制乳腺癌细胞迁移的能力。

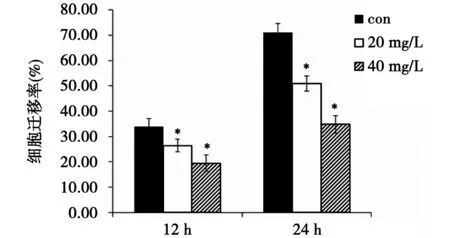
注:与空白对照组比较, *P<0.05图2 细胞划痕实验检测TFV对人乳腺癌细胞MDA-MB-231迁移能力的影响
3.3 TFV对MDA-MB-231细胞侵袭能力的影响 见图3。TFV加药组单个视野下侵袭细胞数量明显小于空白对照组(P<0.01)。表明TFV可抑制乳腺癌细胞MDA-MB-231的侵袭能力。

注:与空白对照组比较,*P<0.05, **P<0.01图3 Transwell侵袭实验检测TFV对人乳腺癌细胞MDA-MB-231侵袭能力的影响
3.4 TFV对MMP-2和MMP-9转录水平和蛋白表达水平的影响 见图4~图5。加药组MMP-2、MMP-9 mRNA蛋白表达量较空白对照组显著降低(P<0.01),表明TFV能够在转录水平和蛋白水平上抑制MMP-2和MMP-9的表达。

注:与空白对照组比较,*P<0.05, **P<0.01图4 qRT-PCR法检测TFV对MMP-2和MMP-9转录水平的影响
3.5 TFV对MDA-MB-231细胞中EMT相关蛋白表达的影响 见图6。相对于空白对照组,加药组中E-cadherin含量显著上升,而N-cadherin和Vimentin含量显著下降(P<0.01),并且均呈现剂量依赖性。表明TFV能够抑制MDA-MB-231细胞发生EMT。
4 讨论
中药蜘蛛香,主要化学成分有挥发油,环烯醚萜类和黄酮类等[11],其中黄酮类化合物抗肿瘤的作用研究已有诸多报道[12]。目前已有报道称,蜘蛛香中总黄酮对肝癌和结肠癌的增殖都具有一定的抑制作用[13-14],而其在抗乳腺癌转移方面的作用及机制尚未阐明。本研究首先通过MTT实验证明了高浓度的TFV对乳腺癌细胞MDA-MB-231生长有抑制作用,因此本实验选择无显著细胞毒性的药物浓度对TFV的抗乳腺癌转移作用进行研究。通过细胞划痕实验、Transwell小室实验证实TFV可以明显抑制MDA-MB-231细胞的迁移和侵袭能力,并呈剂量依赖性。

注:与空白对照组比较,*P<0.05, **P<0.01图5 Western blot实验检测TFV对MMP-2和MMP-9蛋白表达水平的影响
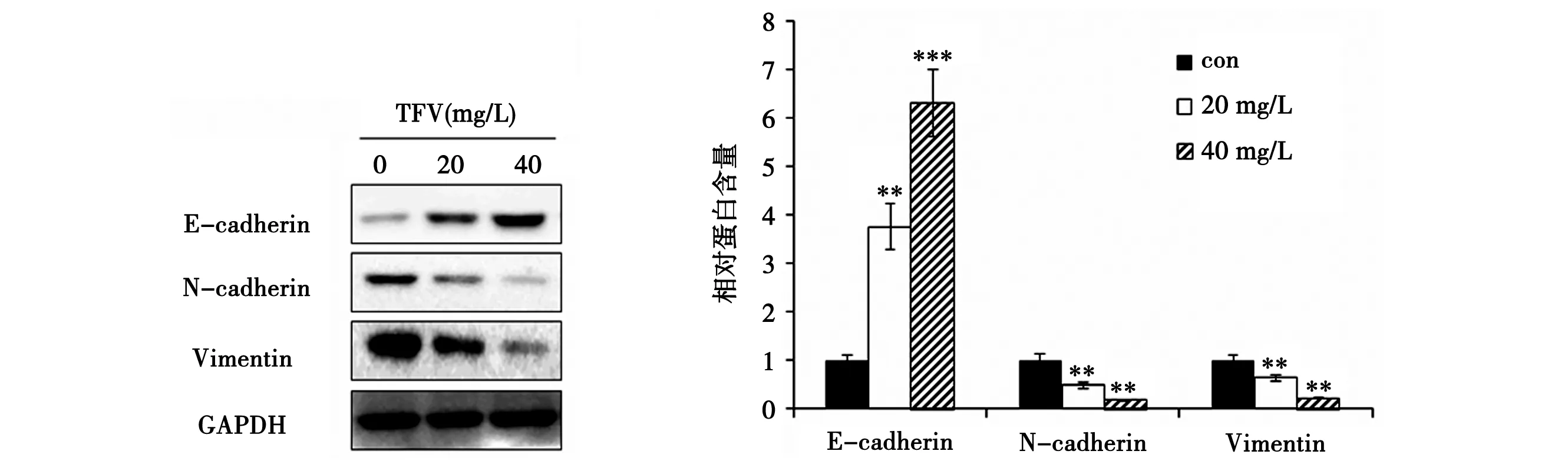
注:与空白对照组比较,*P<0.05, **P<0.01图6 Western blot实验检测TFV对EMT相关蛋白E-cadherin、N- cadherin以及Vimentin表达水平的影响
基质金属蛋白酶(MMPs)家族是一类结构中含锌离子和钙离子的蛋白水解酶,其与多种肿瘤的侵袭和转移密切相关。在MMPs家族中,MMP-2和MMP-9可以通过分解基膜Ⅵ胶原和层黏连蛋白促进肿瘤侵袭和转移[15]。目前已有数据证实,乳腺癌肿瘤中MMP-2和MMP-9表达水平显著高于癌旁正常组织,表明MMP-2和MMP-9的高表达与乳腺癌的转移具有密切的关系[16]。因此,通过检测MMP-2和MMP-9表达水平可以判断乳腺癌患者病情和预后情况。本研究通过qRT-PCR和Western blot实验证实了TFV能够显著抑制MDA-MB-231细胞中MMP-2和MMP-9的转录和蛋白表达水平,进一步从分子和蛋白层面说明TFV能够在体外抑制乳腺癌细胞的侵袭转移能力。
上皮细胞间质转化(epithelial-mesenchymal transition, EMT)是乳腺癌细胞获得侵袭转移能力的主要途径,与恶性肿瘤的侵袭、转移及耐药密切相关[15],其主要特征为上皮细胞的极性丧失,导致细胞间的粘附能力减弱,从而演变成间质细胞的形态和特征,具备了游走的能力[17]。EMT发生的主要标志主要包括上皮性钙粘附蛋白E-cadherin表达下调或消失,以及神经性钙粘附蛋白N-cadherin和波形蛋白Vimentin表达上调[18]。本研究中Western blot结果显示,与空白对照组相比,TFV加药组中E-cadherin蛋白表达显著增加,N-cadherin和Vimentin蛋白表达显著降低,并呈现剂量依赖性。此结果表明TFV能够诱导MDA-MB-231细胞中上皮细胞标志物E-cadherin蛋白表达的增加,从而有效抑制间质细胞标志物N-cadherin和Vimentin蛋白表达,进而抑制MDA-MB-231细胞间极性的丧失,阻止MDA-MB-231细胞形态向间质细胞形态发展,即阻止MDA-MB-231细胞发生EMT。
综上所述,蜘蛛香总黄酮具有明确的抗乳腺癌细胞侵袭转移的作用,其机制可能是通过调控上皮间质转化来实现,本研究为临床使用蜘蛛香总黄酮治疗乳腺癌提供了实验依据。

