影响宫颈鳞癌患者血清鳞状细胞癌抗原表达的因素分析
黎枝,覃晓,李丽玲
(广西百色市人民医院,右江民族医学院附属西南医院妇科,广西 百色 533000)
宫颈癌是常见的妇科恶性肿瘤之一,我国新发病例约为14万例[1]。近年来宫颈癌发病率和死亡率逐年升高,而且越来越趋向于年轻化,因此早期筛查和诊断宫颈癌是十分必要的。大多数宫颈癌患者是鳞癌,所以本研究选择病例均为鳞癌患者。有研究[2-3]表明恶性肿瘤细胞可产生正常组织中含量极少或缺乏的物质,成为肿瘤标志物,通过检测患者血清中肿瘤标志物含量可诊断是否患有肿瘤且对评估预后具有重要意义。血清鳞状细胞癌抗原(squamous cell carcinoma antigen,SCCA)是筛查宫颈癌的标志物之一,本研究从影响宫颈癌患者SCCA值表达的因素来进行分析研究,以期为临床工作提供理论指导,现将研究结果报告如下:
1 资料与方法
1.1 一般资料 选取2015年1月—2019年10月经我院确诊为宫颈癌患者249例为研究对象,年龄为23~73岁,平均年龄为(46.68±8.94)岁。病例纳入标准:病理检查确诊为宫颈鳞癌、临床资料完整的患者。排除标准:合并其他癌症或者恶性疾病、临床资料不完整的患者。
1.2 检测方法 检测患者治疗前、手术后的血清SCCA值。SCCA检测是采用磁微粒化学发光法,按照试剂盒说明书进行操作。人乳头瘤病毒(HPV)检测方法,使用扩阴器充分暴露阴道口,然后使用棉试子插至宫颈口,擦试宫颈口分泌物,单方向旋转4~5周,将收集到的宫颈脱落细胞按照试剂盒说明书进行操作。阴道镜检查异常者行宫颈活检组织病理学检查。
1.3 观察指标 以 SCCA>1.5 ng/ml为阳性,将本次研究患者分为SCCA≤1.5 ng/ml阴性组和SCCA>1.5 ng/ml阳性组进行对比研究,从年龄、是否盆腔淋巴结转移、病理分级、浸润深度、HPV感染、肿瘤大小、脉管浸润等方面来进行分析。
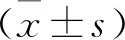
2 结果
2.1 两组一般资料情况 SCCA≤1.5 ng/ml阴性组共127例,年龄为28~63岁,平均年龄为(46.12±7.43)岁,HPV感染率117例,感染率为92.13%,包括HPV类型为16、18、31、33、39、45、51、52、58、59、66、68、CP8304,其中HPV16 79例(62.20%);SCCA>1.5 ng/ml阳性组共122例,年龄为23~73岁,平均年龄为(47.28±10.29)岁,HPV感染率111例,感染率为90.98%,包括HPV类型为16、18、31、33、39、45、51、52、58、59、66、68、CP8304,其中HPV16 90例(73.77%)。
2.2 影响治疗前SCCA值的单因素分析 治疗前两组是否盆腔淋巴结转移、浸润深度、肿瘤大小及脉管浸润等因素差异有统计学意义(P<0.05),而年龄、病理分级及是否HPV感染等因素差异无统计学意义(P>0.05)。见表1。

表1 影响治疗前SCCA值的单因素分析
2.3 影响治疗前SCCA值的多因素分析结果 以血清SCCA是否出现阳性结果为因变量,将肿瘤大小、浸润深度、脉管浸润、是否盆腔淋巴结转移为自变量,采用二分类Logistic进行分析,选择变量进入方程的方法为进入法,以P≤0.05为选入变量的标准,以P>0.10为剔除变量的标准。结果发现肿瘤大小、浸润深度、是否盆腔淋巴结转移为影响宫颈鳞癌患者的独立危险因素。见表2。

表2 影响治疗前SCCA值的多因素Logistic分析结果
2.4 治疗前及手术后SCCA值比较 249例患者中手术后检测SCCA值的一共是172例,由于数据呈非正态分布,所以选用非参数检验中的两个相关样本检验,选择Wilcoxon检验,结果发现手术后SCCA值[0.80(0.60~1.00)]比治疗前SCCA值[1.40(0.80~4.30)]降低,差异有统计学意义(Z=9.633,P<0.001)。有8例(8/172×100%=4.65%)患者手术切除子宫后SCCA值仍然SCCA>1.5 ng/ml。
3 讨论
宫颈癌是妇科常见疾病之一,病死率高,其发病与细菌、病毒、致癌物质、免疫功能抑制等多种因素有关,并且发病早期没有明显的临床症状及体征,大部分患者在就诊时就已经出现相应的临床症状为浸润癌,预后也比较差。一般中晚期宫颈癌患者几乎无手术治疗的可能,多采用放疗。有报道[4]认为30%~40%的中晚期宫颈癌患者对放射治疗反应一般,其主要原因与子宫周围浸润肿瘤组织对放疗的低敏感性及肿瘤体积的大小有关。
SCCA是一种丝氨酸蛋白酶抑制物,为常见肿瘤标志物,可表现宫颈磷癌严重程度,其水平与疾病进展有关。SCCA最早发现于宫颈癌患者肝转移灶细胞胞浆,具有专一的蛋白酶抑制性,可通过参与细胞凋亡控制,由于正常生理条件下外周血几乎不能被测出,良性肿瘤与腺癌患者血清SCCA水平亦偏低,因此已被证实为鳞癌特异性肿瘤标志物。在宫颈癌患者中肿瘤细胞异常高表达,导致了外周血中水平不断增加[5]。
盆腔淋巴结转移主要表现为癌细胞浸入到患者宫颈和盆腔器官周围的淋巴器官,淋巴管受到破坏,癌细胞也进入到淋巴管,最终在淋巴管处形成新的病灶,人体遍布淋巴分布,故患者往往预后较差,手术难以进行。本研究发现随着出现盆腔淋巴结转移患者是不出现盆腔淋巴结转移时SCCA值出现阳性概率的3.398倍,≥1/2肌层浸润是<1/2肌层出现SCCA阳性概率的3.905倍,肿瘤直径≥4 cm是肿瘤直径<4 cm出现SCCA阳性概率的4.362倍,这可能是因为随着肿瘤转移至淋巴结、深度浸润及肿瘤越大,意味着肿瘤细胞数量不断增多,SCCA表达也相应增加,预后也越差。另外就是手术切除子宫后,SCCA值较手术前明显下降,95.35%患者SCCA值出现阴性结果,手术切除肿瘤后,肿瘤细胞大部分被清除,所以SCCA值明显下降。本研究用统计软件做单因素分析的时候,SCCA≤1.5 ng/ml阴性组与SCCA>1.5 ng/ml阳性组在脉管浸润方面是有差异的,存在脉管浸润患者SCCA>1.5 ng/ml的比率高,但是用统计软件做多因素Logistic分析的时候,发现脉管浸润并不是发生宫颈癌鳞癌的独立危险因素,出现这种情况可能原因是将多个因素一起分析的时候,多个因素相互影响,其中某种因素影响概率相对低,所以统计结果显示该因素不是影响因素。
宫颈癌是由宫颈鳞状上皮内病变发展而来的,大约90%的宫颈鳞状上皮内病变和99%的宫颈癌组织中发现有高危型HPV感染[6-7]。但是也有大量研究表明宫颈癌并不是完全是HPV感染引起的[8]。有报道[9]称miRNA影响着宫颈癌的机制是HPV相关致癌蛋白E6及E7。HPV感染往往比细胞形态学改变早,所以筛查高危型HPV比宫颈细胞学检测更有效地浓缩高风险人群,将HPV作为筛查宫颈癌的手段之一,可以有效预防宫颈癌的演变[10]。本研究结果显示249例患者中,HPV感染率为91.57%,但是HPV感染没有影响到SCCA的表达,可能原因是宫颈癌患者感染HPV概率高,所以不影响到SCCA表达。
目前对宫颈癌患者SCCA研究概况:有报道SCCA、肿瘤坏死因子受体-1、肿瘤转移相关基因-1在宫颈癌中表达量显著升高并且与宫颈癌FIGO分期、浸润程度以及淋巴转移关系密切[11]。SCCA、CA153、CA199联合检测能提高宫颈癌诊断率,并且可以预测宫颈癌病理类型、恶性程度和预后复发情况[12]。IL-6、CA125、SCCA在宫颈癌的发生、发展过程中扮演着重要的角色,其水平有助于判断宫颈癌患者肿瘤分级、病理分期等[13]。多期动态增强 (MDCE-MRI) 联合SCCA对宫颈癌具有较高的诊断效率,灵敏度和特异度均较高[14]。磁共振成像(MRI)联合血清SCCA、CA125可较为准确识别宫颈癌宫旁浸润与盆腔淋巴结转移情况[15]。宫颈癌组织中微小RNA-141(miR-141)、长链非编码RNA-H19(lncRNA-H19)与血清SCCA水平显著相关[16]。总之,这两年国内研究宫颈癌SCCA表达主要集中在研究联合其他肿瘤标志物或者影像学,提高宫颈癌诊断的准确度、灵敏度。
综上所述,SCCA可以作为宫颈癌辅助筛查手段之一,肿瘤越大、浸润越深、淋巴结转移SCCA值可能越大,但是本研究样本量不够多,可能会影响到结果,下一步将收集大样本量、联合其他肿瘤标志物或者影像学进行研究,为宫颈癌早期筛查提供帮助。

