谷氨酰胺转氨酶在Pichia pastoris GS115 中的表达及其发酵条件响应面法优化
于 凡,刘 双,陈海清,王红静,马 雯,石 楠,檀建新
(1. 河北农业大学 食品科技学院,河北 保定 071001;2. 河北大学 生命科学学院/河北省微生物多样性研究与应用重点实验室,河北 保定 071002)
谷氨酰胺转氨酶(Transglutaminase,缩写为TGase,EC 2.3.13)是一种重要的食品酶[1],具有催化酰基转移、脱酰胺和蛋白质分子间或分子内的赖氨酸与谷氨酰胺共价交联的活性[2]。后者可以改变蛋白质网络结构、增强保水能力和促进凝胶形成,提高蛋白质营养价值[3]。因此,被广泛应用于蛋白质的修饰,从而改善蛋白质的理化性质和功能[4],在食品、医药、纺织等领域具有重要的应用价值[5]。TGase 在自然界中分布广泛,包括豚鼠肝脏、植物以及微生物[6]。微生物来源的谷氨酰胺转氨酶又称为MTG(Microbial transglutaminase),与动植物来源的TGase 相比,MTG 具有分子量小、Ca2+独立性、较高的反应速率和热稳定性以及较宽的酰基供体底物专一性等优点,更适合工业生产和应用[4]。同时,因为微生物生长快,产量大,效率高,所以达到工业规模的用于食品改性的商业化MTG 都是由微生物发酵生产的[7]。然而,MTG 也存在一些缺点,如天然宿主链霉菌的发酵培养基相对昂贵,发酵工艺复杂,增加了大规模生产的成本和复杂程度[8]。因此,异源重组表达则成为生产MTG 的一种可行的技术手段[9]。
巴斯德毕赤酵母(Pichia pastoris)表达系统已被广泛用于外源重组蛋白质的表达,可同时生产分泌蛋白和细胞内蛋白[10]。目前,已有500 多种来自哺乳动物、植物、酵母和细菌的外源蛋白在毕赤酵母中获得了成功表达[11]。毕赤酵母具有操作简单、生物量和蛋白产量高的优点,并且它是甲醇营养型酵母,具有强启动子AOX1,可严格调控和驱动高水平的蛋白表达,能够进行蛋白质水解、折叠、二硫键形成和糖基化等翻译后修饰。这些特点使毕赤酵母成为大规模生产重组酶的理想宿主[12]。许多在原核系统中以非活性形式表达的蛋白质在毕赤酵母中都实现了活性形式的表达[13]。
利用毕赤酵母高效表达外源蛋白的特性,本研究将含有吸水链霉菌TGase 基因的pPIC9K-prokex-TGase 重组分泌表达载体在毕赤酵母GS115 中表达,并通过Plackett-Burman(PB)设计和响应面法Response surface methodology(RSM)评价并优化了TGase 的发酵条件,以期为后续大规模发酵提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒 巴斯德毕赤酵母GS115 及pPIC9K 空载质粒由本实验室保存;吸水链霉菌TGase 基因克隆来自本实验室保存的吸水链霉菌 (Streptomyces hygroscopicus)菌株107.3,pPIC9K- pro-kex-TGase 由本实验室前期构建保存。
1.1.2 培养基及试剂 参考Invitrogen 毕赤酵母表达手册,配制YPD 培养基、MD 培养基、生长培养基BMGY、诱导培养基BMMY。DH5α 感受态、 Solution Ⅰ购自北京博迈德基因技术有限公司;SalⅠ等酶购自大连宝生物公司;PCR Mix、Super Marker(100-10 kb)、质粒提取试剂盒、胶回收试剂盒购自北京全式金生物技术有限公司;引物合成及测序由通用生物系统(安徽)有限公司完成。
1.1.3 仪器与设备 SPX-250B-Z 型生化培养箱,上海博迅公司; H-1850R 台式高速冷冻离心机,长沙湘仪公司;PCR 仪德国Biometra 公司;756P 紫外可见分光光度计,上海光谱公司;Gene Pulser Xcell电穿孔仪,美国Bio-Rad 公司。
1.2 试验方法
1.2.1 重组毕赤酵母GS115 的构建 取-80 ℃保存含pPIC9K-pro-kex-TGase 重组载体的大肠杆菌甘油保藏管,按1%接种量接种于5 mL 含0.1%(v/v)氨苄抗性的LB 液体培养基中,37 ℃、200 r/min 培养过夜,收集菌体并使用质粒提取试剂盒提取质粒。用salⅠ酶切处理重组质粒pPIC9K-pro-kex-TGase使之线性化,再电转化至GS115 感受态细胞内并整合到基因组中,利用菌落PCR 及酶活性比色法对转化子进行筛选,获得阳性转化子。
1.2.2 重组GS115/pPIC9K-pro-kex-TGase 摇瓶培养基诱导表达 挑取阳性转化子GS115/pPIC9K-prokex-TGase,活化后按1% 接种量接种于含25 mL BMGY 生长培养基的250 mL 三角瓶中,30 ℃、200 r/min 培养25 h。参照毕赤酵母表达手册方法,4 ℃、5 000 r/min 收集菌体并转接到BMMY 诱导培养基中,23 ℃、200 r/min 继续培养72 h,每24 h补加100%甲醇至终浓度0.5%。取诱导结束后的发酵液,12 000 r/min 离心10 min 收集上清液,即为粗酶液。
1.2.3 酶活测定及十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 酶活测定使用经典氧肟酸比色法[14],取50 μL 粗酶液置于1.5 mL 离心管中,加入50 μL A 液(CBZ、 盐 酸 羟 胺、GSH、0.2 mol/L Tris-HAc)混和均匀,放入37 ℃水浴锅温浴10 min,加 50 μL B 液(3 mol/L HCL、5% FeCl3、CCL3COOH)终止反应并显色。反应体系经12 000 r/min 离心1 min 后,取100 μL 转入96 孔酶标板中,在525 nm 波长下测定上清液的吸光值;另取50 μL 粗酶液煮沸灭活,其余步骤同上,作为对照用于样品测定吸光度值时调零。dispase Ⅱ处理粗酶液在37 ℃水浴锅温浴20 min[15]。
根据L- 谷氨酸-γ- 单羟肟酸标准曲线,y= 0.031 8x+0.042 4(x为L- 谷 氨 酸-γ- 单 羟 肟 酸 浓 度mmol/L,y为OD525下的吸光值A,R2=0.999 8), 计算酶活力值。酶活单位定义为37 ℃下每分钟催化形成1 μmol 的L-谷氨酸-γ-单羟肟酸所需要的酶量。使用12%分离胶对酶提取液进行SDS-PAGE 凝胶电泳分析[16]。
1.3 数据统计分析
数据统计分析旨在寻找显著变量及其与实验结果的关系,以便对变量水平进行管理以获得期望的结果输出[17]。因此根据TGase 酶活力的实验结果,分析了TGase 酶活力和诱导表达发酵参数的关系,通过Design-Expert V8.0.6 专业实验设计软件,设计实验方案、进行分析和预测。
1.3.1 Plackett-Burman(PB)设计 PB 设计[18]可 以快速、有效的从本试验的多个发酵条件中筛选出主要因素。根据前期单因素预实验结果,采用PB设计对接种密度、温度、初始pH、甲醇浓度、诱导时间共5 个因素对TGase 生产的影响进行研究,试验次数N=12,每个因素选取高低两个水平(表1)。
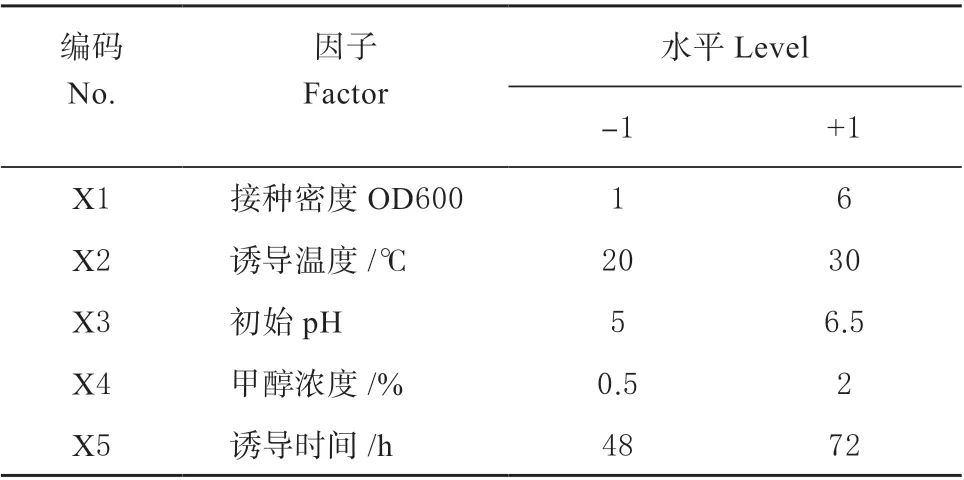
表1 PB 设计的因素和水平Table 1 Factors and levels of PB design
1.3.2 Box-Behnken 设计(BBD)和响应面方法(RSM)在PB 设计结果的基础上,通过RSM 进一步优化具有显著影响的因素。通过Box-Behnken 设计3 因素2 水平的响应面试验,再以粗酶液的酶活为响应值。使用二次多项式模型来探索显著因素变量和响应变量之间的关系。最终目标是通过建模和分析影响响应值的多个独立变量来优化发酵参数[19]。数学模型如下:
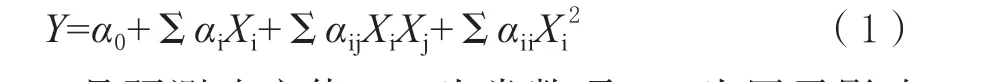
Y是预测响应值,α0为常数项,αi为因子影响系数,αij为因子间交互响应系数,αii为二阶影响系数因子。XiXj自变量的水平。
2 结果与分析
2.1 重组毕赤酵母GS115/pPIC9K-pro-kex-TGase 诱导表达及SDS-PAGE 分析
将构建并筛选出的阳性转化子菌株进行诱导表达后收集粗酶液进行酶活检测,粗酶液可直接检测出较低的酶活性,说明粗酶液中含有正确折叠且有活性的成熟酶TGase(mTGase),推测可能是由于GS115 菌株自身的kex2 酶识别Lys-Arg 位点并对酶原pro-kex-TGase 酶切形成了mTGase 所致。粗酶液经dispase Ⅱ处理后酶活力达到(0.314±0.002)U/mL, 而GS115 空白菌株、GS115/pPIC9K 空载菌株在相同条件下发酵上清液中没有检测到MTG 酶活,说明两者不表达TGase,而含有酶原pro-kex-TGase基因的阳性转化子菌株能够很好地表达酶原且具有TGase 活性。
对收集的粗酶液进行SDS-PAGE 电泳分析,结果见(图1)。泳道1、2 分别是GS115、GS115/pPIC9K 发酵上清液,未见蛋白条带,说明GS115、GS115/pPIC9K 本身不表达TGase 酶蛋白;泳道3为GS115/pPIC9K-pro-kex-TGase 发酵上清液,在约45 kD 处出现明显蛋白条带,这与S. hygroscopicus谷氨酰胺转氨酶酶原的蛋白分子理论大小基本一致,说明TGase 获得了很好地表达且不存在糖基化修饰。然而,在胞外粗酶液中直接检测到了TGase 酶活力,说明该表达系统也直接生成了分泌到胞外的折叠正确的mTGase,理论上其分子大小约为38 kD,但在SDS-PAGE 图中只有1 条45 kD 的TGase 酶原条带(图1),说明可能只有很少的酶原经过kex2 酶活化成mTGase,故在SDS-PAGE 胶图中未出现相应条带。
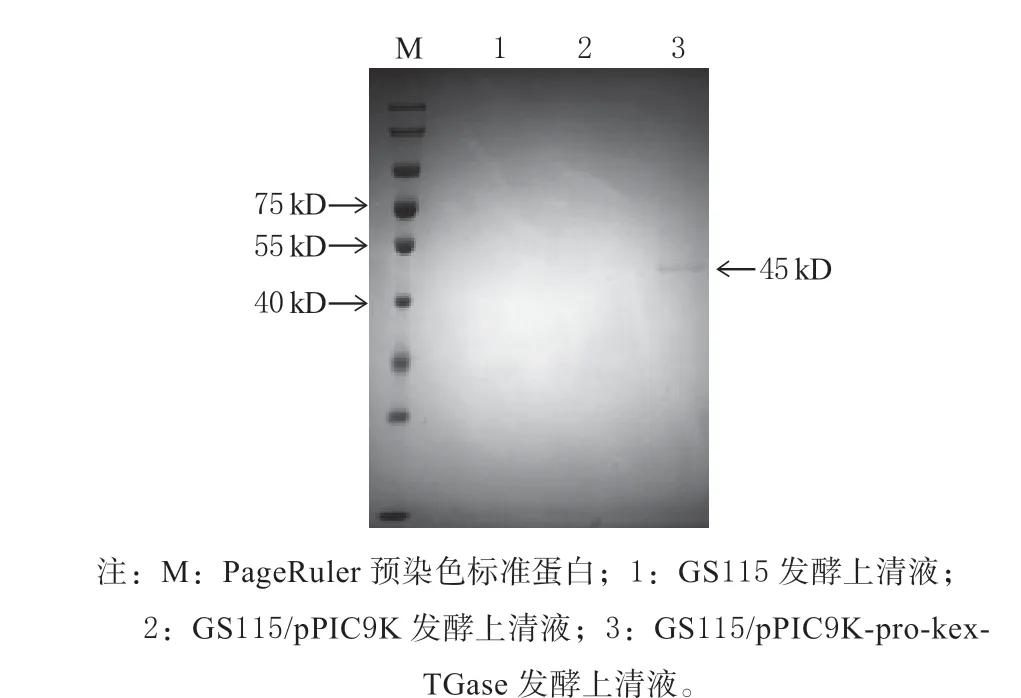
图1 TGase 粗酶液的SDS-PAGE 电泳分析Fig. 1 SDS-PAGE electrophoresis analysis of TGase crude enzyme solution
2.2 用PB 设计筛选TGase 表达的主要因素
所有试验除研究因素外其它条件均保持一致,PB 实验设计与结果见表2。
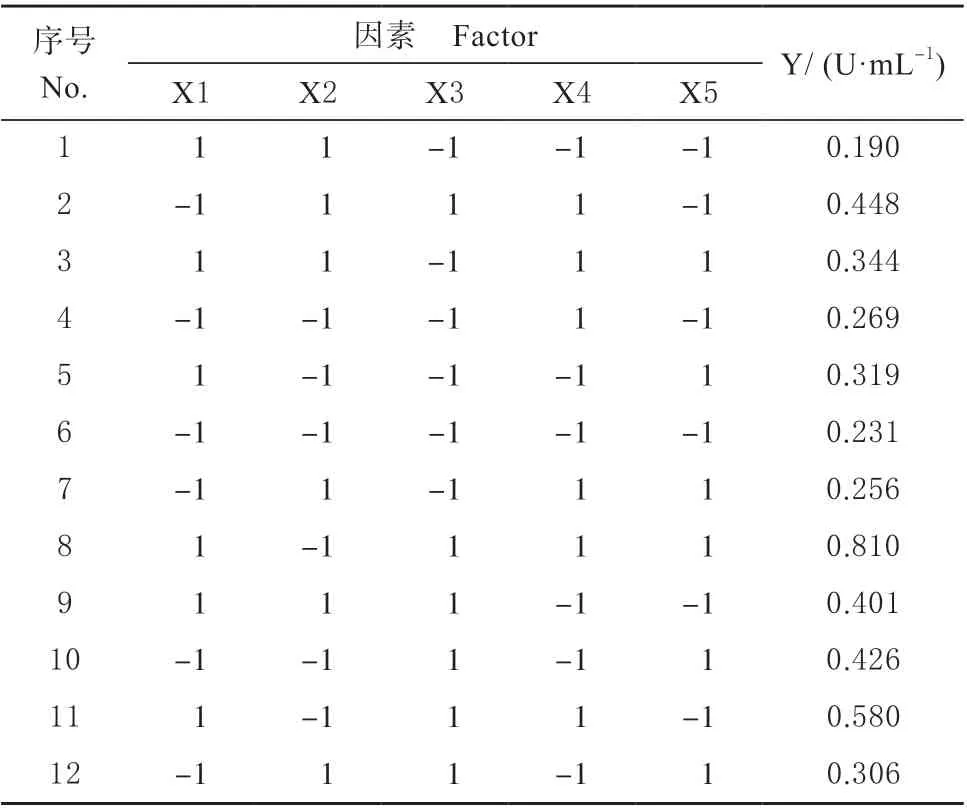
表2 PB 实验设计与结果Table 2 PB experimental design and results
确定显著性因素并进行方差分析(见表3)。“Prob >F”(P值)值表明模型和因子的显著性水平。“Prob>F”值小于0.050 0 表示显著,大于0.100 0表示不重要。PB 结果分析5 个因素对TGase 的生产影响,按重要性排序为:X3>X4>X1>X2>X5。其中X3、X4 对TGase 酶活力有显著影响(P<0.01),选择X3、X4 和X1(诱导pH、甲醇浓度、接种密度)进一步优化。
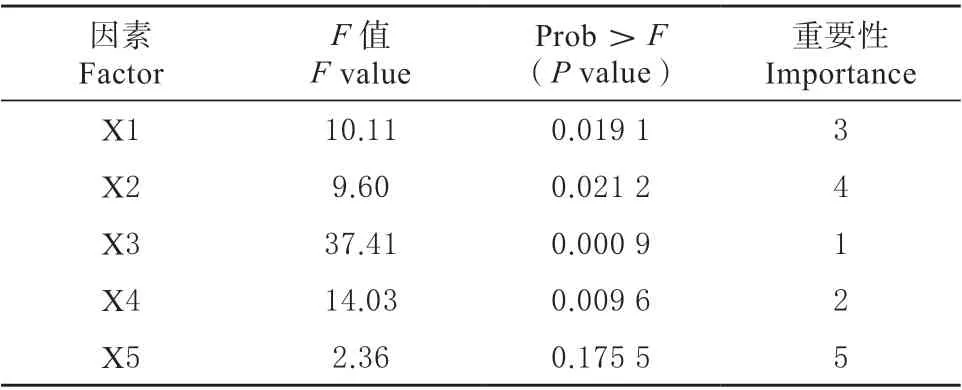
表3 PB 设计结果分析Table 3 Analysis of PB design results
2.3 用RSM 优化显著因子
2.3.1 RSM 试验设计 使用响应面中的BBD 法对显著因子编码,诱导起始pH(A)、甲醇浓度(B)和诱导起始接种密度(C)进行优化试验,研究3 个因子的相互作用和最佳水平。获得多元二次方程如下所示:

Y为预测TGase 酶活力,A、B 和C 分别为3 个显著因子的编码值。每个因子有3个编码水平(1,0,-1),共进行了17 次运行。响应面试验设计见表4。
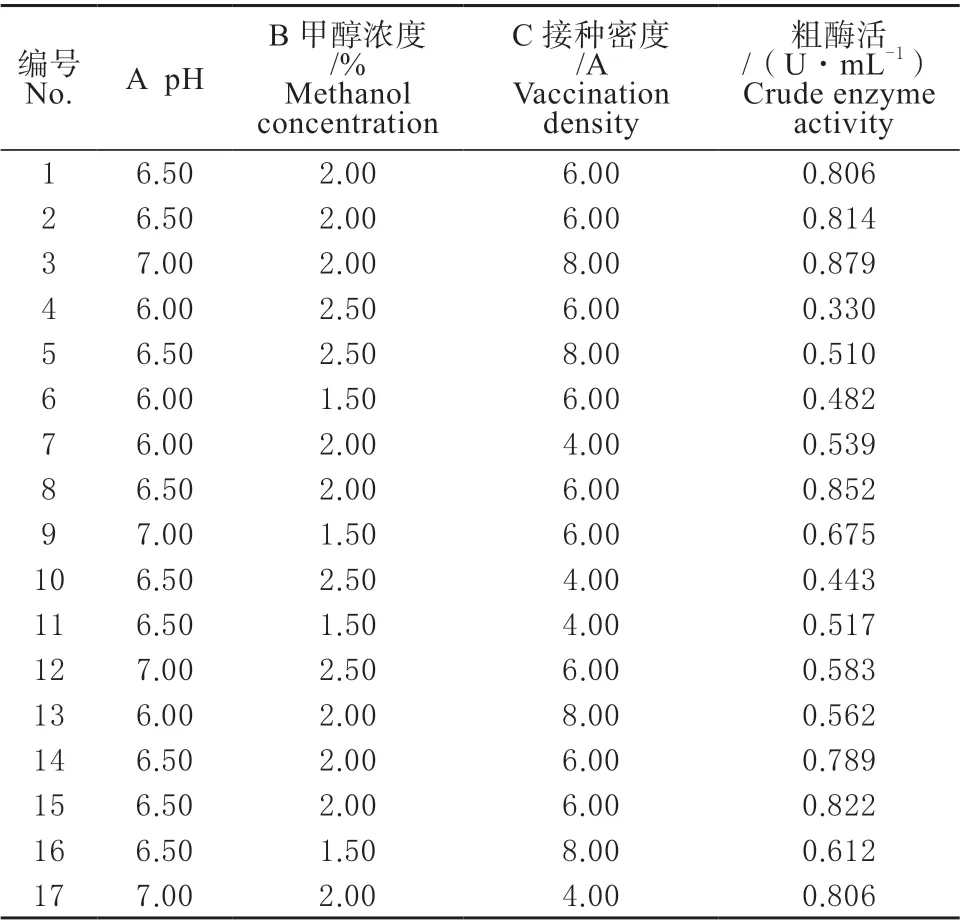
表4 响应面试验设计Table 4 Experimental design of response surface
2.3.2 回归分析 对该方程2.3.1(2)进行回归系数显著性检测和方差分析。
表5 结果表明,模型F值为61.69 意味着该模型具有显著性,只有0.01%的可能性,因为噪音而产生较大的“F值”。“P值”即小于0.050 0 表示模型项是有效的,在这种情况下,A、B、C、A2、B2、C2是重要的因子项。大于0.100 0 的值表示因子项不重要,AB、AC、BC 不重要。失拟项为2.16.意味着缺乏拟合相对于纯误差不显著,有23.55%的可能性出现这样大的失拟值是由于噪声。对可信度进行分析,模型R2=0.987 5,变异系数(C.V. %)为4.3,说明模型的拟合程度和可信度较高。“Adeq Precision”测量信噪比,比率大于4 是所期望的。该模型25.987 的比率表明信号充足。说明此模型可用于模拟TGase 酶活力的理论预测。
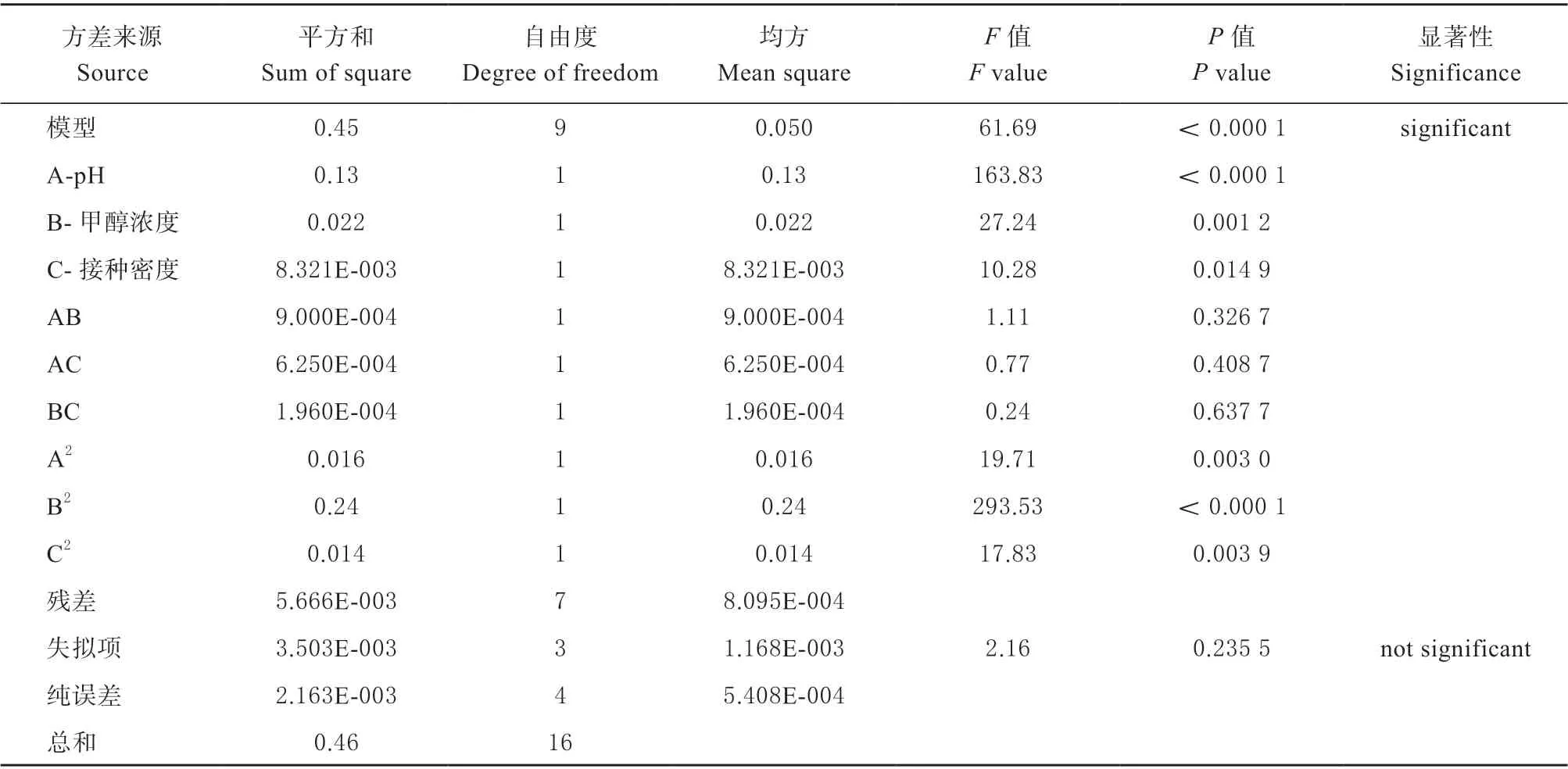
表5 响应面二次模型的方差分析Table 5 ANOVA of the quadratic model of response surface
2.3.3 响应面各因子相互作用的关系 为了更好地理解各因子对TGase 生产的影响,使用Design-Expert.V8.0.6 获得了各因子的2D 等高线图和3D 响应曲面(见图2 ~4)。通过响应曲面和等高线图直观地观察到AB,AC 和BC 之间相互作用。等高线图呈椭圆时,表示两因子间具有显著的交互作用,其它则不显著。图2(b)图4(b)的曲面较陡,说明pH 和甲醇浓度、甲醇浓度和接种密度的交互作用对酶活性影响较显著。图3(b)曲面较平缓,说明pH 和接种密度的交互作用对酶活性影响不显著。图2(a)图4(a)的等高线趋向椭圆形,说明pH和甲醇浓度、甲醇浓度和接种密度的交互作用明显。通过沿轮廓的长轴和短轴移动来获得变量的统计最优值。在等高线图中最小的椭圆中得到最高的预测值。预测最佳发酵条件:诱导初始pH 7,甲醇浓度2.07%,接种密度OD6006.27,预测响应值为1 U/mL。
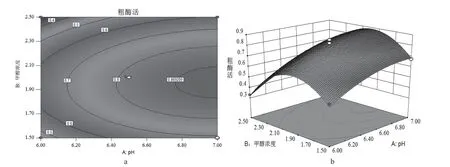
图2 诱导pH 值和甲醇浓度影响酶活力的等高线a 和响应面曲图bFig. 2 The contour a and response surface plot b of induced pH and methanol concentration affecting enzyme activity

图3 诱导pH 值和接种密度影响酶活力的等高线a 和响应曲面bFig. 3 The contour a and response surface b of induced pH density affecting enzyme activity
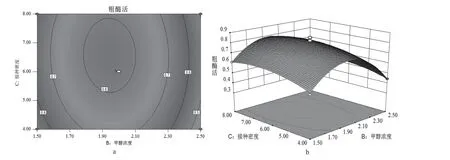
图4 甲醇浓度和接种密度影响酶活力的等高线a 和响应曲面bFig. 4 Contour a and response surface b of methanol concentration and inoculation density affecting enzyme activity
2.3.4 发酵条件的优化验证 经响应面优化,结合实际情况调整最佳诱导条件为诱导接种密度OD600为6,pH 为7,甲醇浓度为2.0%,温度23 ℃,诱导时间72 h,进行3 组平行发酵试验,在此条件下获得的粗酶液经dispase Ⅱ处理,检测到TGase 酶活力为(1.03±0.075 )U/mL;与响应面优化设计所得预测值相近,证明该模型较好的预测了试验结果。
3 讨论与结论
到目前为止,人们尝试了不同来源的TGase 在P.pastoris中的表达,但酶活力普遍不高,例如2019 年,Yang 等[20]试验表明,表达弗氏链霉菌TGase 酶活力达到0.7 U/mL,且证明TGase 活性能够引起于猪肉、鸡肉和大豆蛋白的交联重构。2019 年Li 等[13]研究表明,表达玉米TGase 获得可溶性TGase 酶活力达到0.889 U/mg。而来源于S. hygroscopicus的TGase 的在酵母中异源表达研究较少,万丹研究报道的重组吸水链霉菌TGase 在解脂耶氏酵母中表达酶活力为1.06 U/mL[15]。P. pastoris作为应用最广泛的真核表达系统,对MTG 的大量表达还有巨大的发展潜力。本研究构建的重组吸水链霉菌TGase的P. pastoris表达系统,既可以产生大量酶原蛋白,又可以直接产生具有酶活性的mTGase,其原因可能是GS115 菌株自身的kex2 蛋白酶识别KR 位点并酶切了表达的TGase 酶原形成了有活性的mTGase,这在一定程度上实现了本研究的设计目标。Bader et al[21]研究发现,毕赤酵母可产生kex2 蛋白酶,该酶的存在为mTGase 形成提供了可能性。但在发酵条件优化前后,SDS-PAGE 电泳中均未出现明显的mTGase 蛋白条带,说明优化前后被kex2 酶活化的TGase 酶原仍然只是一小部分,还有很大的改造潜力。目前关于提高毕赤酵母TGase 表达量的方法,报道较多是启动子改造、信号肽替换、高拷贝菌株筛选等[22],该重组表达系统未来可以通过共表达kex2 酶、使用专一性切割TGase 酶原区的TAMEP蛋白酶、发酵培养基优化等方法来获得更高的酶活力,有助于其工业化应用。
本 研 究 经 过Plackett-Burman(PB) 和Box-Behnken(RSM)试验设计优化发酵条件,结果表明优化后获得的TGase 酶活力比未优化发酵条件前提高了近3.6 倍,说明将PB 设计和RSM 试验方法相结合,用于筛选显著影响因子并揭示因子间的相互关系的优化方法可行,Yu et al[19]曾使用该方法优化生产胞外溶菌酶的发酵条件,使该酶得到了高效表达。
本研究构建了表达吸水链霉菌TGase 的重组毕赤酵母菌株GS115/pPIC9K-pro-kex-TGase,在接种密度OD600为6,pH 为7,甲醇诱导浓度为2.0%,温度23 ℃,诱导时间72 h 的优化条件下,TGase 最大酶活力达到1.1 U/mL,并实现了有活性mTGase 的胞外分泌表达,为MTG 生产和分子改造提供了新思路。

