苯磺贝他斯汀滴眼液中苯扎氯铵含量分析方法研究
方夏琴,檀华进,靳雯臻,姜 栋,谭晓川,张宇佳,郑稳生
(北京协和医学院,中国医学科学院药物研究所 药物传输技术及新型制剂北京市重点实验室,北京 100050)
苯磺贝他斯汀(bepotastine besilate)是一种组胺受体拮抗剂,属于第二代H1抗组胺药,主要特点是使用后起效迅速,具有良好的临床效果与安全性[1-2]。该药滴眼液剂型于2009年9月获美国FDA批准上市,商品名为Bepreve,用于过敏性结膜炎相关性眼瘙痒的治疗;目前尚未在国内获批上市。另有研究报道苯磺贝他斯汀在治疗过敏性鼻炎方面的有效性与安全性[3]。滴眼剂作为临床上广泛使用的一类高风险眼用制剂,在多剂量的眼用制剂中一般应加入适宜抑菌剂,以防止在制剂使用过程中微生物的污染;而不规范地添加抑菌剂会导致眼上皮细胞损害,给使用者造成安全风险;因此应尽量选用安全风险小的抑菌剂[4]。有研究人员通过专项评价发现,近年国产滴眼液中抑菌剂的应用逐渐得到重视[5]。抑菌剂的合理使用和质量控制在保证眼用制剂安全性、有效性方面具有十分重要的意义。
苯扎氯铵是一种具有杀菌作用的季铵盐类阳离子化合物,广泛用于复方消毒剂、化妆品、滴眼液、滴鼻液等,主要由正烷烃基取代的二甲基苄基氯化铵的同系物组成,其中最常用的同系物有十二烷基二甲基苄基氯化铵(C12-苯扎氯铵)、十四烷基二甲基苄基氯化铵(C14-苯扎氯铵)。苯扎氯铵在水溶液显中性或弱碱性,振摇时易产生泡沫,属消毒防腐剂类;且国内外苯扎氯铵质量存在较大差异[6]。目前,国内药典收载的滴眼液品种中对抑菌剂的质量标准尚不完善,查阅发现,2015年版《中国药典》收载了约43个滴眼液品种,其中仅11 个品种在质量标准中列入了抑菌剂含量检查;且缺乏使用剂量和含量的控制研究,一定程度上造成抑菌剂选择和使用不规范,存在一定的潜在安全风险。本文建立了苯磺贝他斯汀滴眼液中苯扎氯铵含量测定分析方法,为本类产品的质量控制研究提供参考。
1 仪器与材料
1.1 仪器
Waters 2695高效液相色谱仪(美国Waters公司);Agilent 1100高效液相色谱仪(美国Agilent公司);AB-204型电子天平(Mettler);PHS-3CW型pH计(上海般特仪器);TGL-16G型离心机(上海安亭科学仪器厂)。
1.2 材料
苯扎氯铵对照品(批号:100549-201504,纯度12.19 mg/ml,中国食品药品检定研究院);苯磺贝他斯汀滴眼液(自制,规格为1.5 %);乙腈(赛默飞世尔);苯磺贝他斯汀(江西阿尔法高科药业);磷酸二氢钠一水合物(南京化学试剂);氯化钠(河北华晨药业);苯扎氯铵(江西阿尔法高科药业);氢氧化钠(湖南尔康制药);甲醇(赛默飞世尔);三乙胺(西陇化工);醋酸铵(北京化工厂);磷酸(北京化工厂);蒸馏水(广州屈臣氏)。
亲水性PTFE针式过滤器,疏水性PTFE针式过滤器,尼龙针式过滤器,水相聚醚砜针式过滤器(上海安谱实验科技);PTFE针式过滤器,尼龙针式过滤器,水相聚醚砜针式过滤器(津腾试验设备公司);芯硅谷混纤膜针式过滤器,芯硅谷PVDF针式过滤器,芯硅谷亲水性PVDA针式过滤器(Aladdin Industrial Corporation)。
2 方法与结果
2.1 色谱条件与系统适用性
色谱柱:Agilent TC-C C18(4.6 mm×250 mm,5 μm);流动相为乙腈-5 mmol/L乙酸铵溶液(含1 %三乙胺,用磷酸调节pH值至5.0)=65:35,检测波长214 nm,进样20 μl,苯扎氯铵峰与相邻峰的分离度应不小于1.5,拖尾因子0.8~1.5,理论塔板数3000以上;供试品中如含苯扎氯铵,按外标法以峰面积计算苯扎氯铵含量。
2.2 样品的制备
2.2.1 供试品溶液的制备 取苯磺贝他斯汀滴眼液(含苯扎氯铵约0.05 mg/ml),过滤,弃去初滤液,取续滤液作为供试品溶液。
2.2.2 对照品储备液的制备 取苯扎氯铵对照品适量,精密称定,置入10 ml量瓶,加流动相溶解并定容至刻度,制成每1 ml中含苯扎氯铵1.219 mg溶液,作为苯扎氯铵对照品储备液。
2.2.3 阴性溶液的制备 按处方量称定磷酸二氢钠一水合物和氯化钠,加适量蒸馏水溶解,另取处方量苯磺贝他斯汀原料药,加入上述溶液中,搅拌使溶解,用1.0 mol/L氢氧化钠溶液调节上述溶液的pH至6.8,加蒸馏水至处方量,搅拌均匀;取适量过滤,弃去初滤液,取续滤液作为阴性对照溶液。
2.3 方法学验证
2.3.1 专属性考察 精密吸取空白溶剂、阴性对照溶液、对照品溶液和供试品溶液各20 µl,分别注入高效液相色谱仪,按2.1项下色谱条件分析,记录色谱图(见图1),结果供试品溶液在对照品溶液主峰位置上有相同的色谱峰,溶剂和辅料与苯扎氯铵峰分离度符合要求,均对苯扎氯铵峰无干扰(见图1),表明本方法专属性良好。
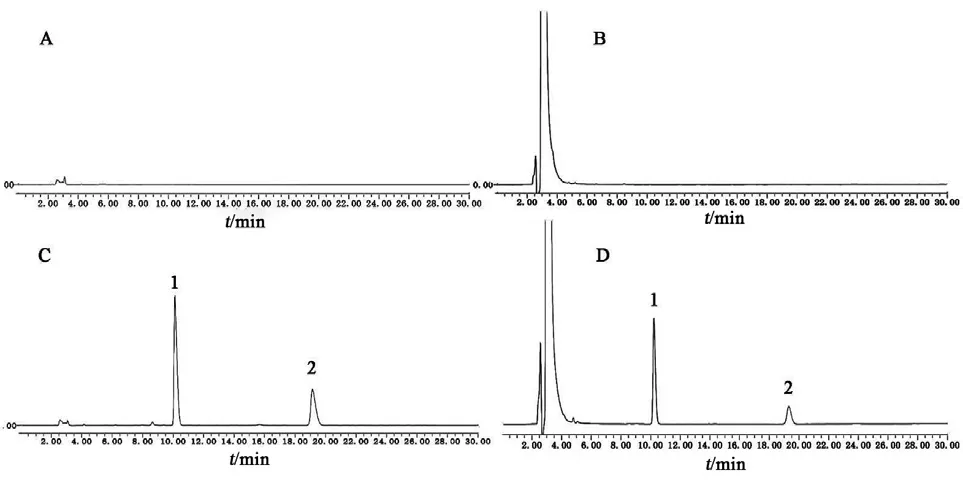
图1 苯扎氯铵专属性HPLC图谱
2.3.2 线性关系考察 精密量取2.2.2项下对照品储备液1,3,1,5和3 ml,分别置入50,100,25,100和50 ml量瓶,均用流动相稀释至刻度,摇匀,配制成浓度为0.02438,0.03657,0.04876,0.06095和0.07314 mg/ml系列苯扎氯铵对照品溶液;精密量取各20 µl,分别注入液相色谱仪,记录色谱图;以峰面积之和(A)为纵坐标,浓度(x)为横坐标线性回归,苯扎氯铵的线性回归方程:A=2.453×107x+2.173×104,R2=1;表明拟定色谱条件下,苯扎氯铵在0.02438 ~ 0.07314 mg/ml范围内,浓度与峰面积呈良好的线性关系。

图2 线性试验HPLC图谱
2.3.3 检测限与定量限 在214 nm波长下,当苯扎氯铵峰1信噪比为3时,检测限为8 ng;当苯扎氯铵峰1信噪比为10时,定量限为23 ng。当苯扎氯铵峰2信噪比为3时,检测限为39 ng;当苯扎氯铵峰2信噪比为10时,定量限为117 ng。
2.3.4 稳定性试验 取本品供试品溶液,室温放置,0,3,6,12,18,24 h,分别精密量取20 µl,注入液相色谱仪中,记录色谱图中的峰面积;峰面积之和的RSD为0.81 %(n=6)。表明供试品溶液稳定性良好。
图3 稳定性试验HPLC图谱
2.3.5 仪器精密度 取本品对照品适量,加流动相制成每1 ml中含0.04876 mg的溶液。精密量取20 µl,分别注入液相色谱仪,记录色谱图,结果峰面积RSD为0.44 %(n=6),表明方法仪器精密度良好。
图4 仪器精密度试验HPLC图谱
2.3.6 重复性 按2.2.1项下方法,分别平行配制6份供试品溶液,按色谱条件进样分析,记录色谱图,6份供试品溶液的苯扎氯铵峰面积RSD为1.3 %(n=6),显示本方法重复性好。
2.3.7 中间精密度 为考察随机变动因素对精密度的影响,在不同的时间,由本实验室另一名分析人员独立操作,按2.2.1方法,配制6份供试品溶液,使用不同的高效液相色谱仪进行检测分析,中间精密度试验结果与重复性试验的结果,12组数据合并计算RSD为1.70 %(n=12),结果表明,方法中间精密度良好。
2.3.8 回收率试验 在阴性溶液中分别加入不同体积的苯扎氯铵对照品溶液,配制相当于苯磺贝他斯汀滴眼液处方中苯扎氯铵标示量(0.005 %)浓度的低、中、高3个浓度的回收率样品溶液,并采用HPLC进行测定,以外标法计算样品中苯扎氯铵含量及回收率(见表1);结果表明,低、中、高3个浓度下苯扎氯铵含量测定方法回收率与RSD(n=9)均符合要求。

表1 回收率试验
2.3.9 耐用性试验 通过微调本试验色谱条件中的流速、柱温、色谱柱型号、流动相比例、检测波长及pH等变动因素,以考察色谱条件中参数的微小变动对苯扎氯铵含量检测方法主要色谱参数系统适用性的影响,评价该方法的耐用性。结果,在色谱条件微小波动情况下,苯扎氯铵色谱峰1与色谱峰2保留时间变化较小;其中相对其他条件的变动,色谱柱的改变对保留时间影响较大;但均符合系统适用性要求,表明本方法耐用性良好。
2.4 苯扎氯铵含量测定结果
取3批苯磺贝他斯汀滴眼液,按供试品配制方法,照2.1项下色谱条件, 采用HPLC分析苯磺贝他斯汀滴眼液中苯扎氯铵含量;按苯扎氯铵峰面积,以外标法计算,结果见表2。

表2 含量测定结果
结果表明,3批苯磺贝他斯汀滴眼液中苯扎氯铵含量均在80 %~120 %的标准范围内,符合滴眼液中抑菌剂常规含量要求;表明本方法可用于检查本品中苯扎氯铵含量。
2.5 滤膜强吸附性物质的检测分析特性
2.5.1 滤膜材质吸附差异 采用不同厂家生产的不同材质的针式过滤器分别过滤不同体积的苯磺贝他斯汀滴眼液,按2.1项下色谱条件进行HPLC分析,按苯扎氯铵峰面积,以外标法计算苯磺贝他斯汀滴眼液中苯扎氯铵含量,考察滤膜来源、材质与过滤体积对苯扎氯铵的吸附差异。
以离心样品为对比,采用安谱亲水性PTFE、安谱疏水性PTFE、安谱尼龙、安谱水相聚醚砜、津腾PTFE、津腾聚醚砜、芯硅谷混纤膜、芯硅谷PVDF、芯硅谷亲水性PVDF为滤膜过滤不同体积滤液样品含量的RSD分别为:0.37 %,1.1 %,2.7 %,0.32 %,1.2 %,2.0 %,1.5 %,3.0 %,0.94 %。结果表明,安谱亲水性PTFE、安谱水相聚醚砜、芯硅谷亲水性PVDF针式过滤器对苯磺贝他斯汀滴眼液中苯扎氯铵吸附作用随体积变化差异较小,吸附精密度较好;安谱疏水性PTFE、津腾PTFE、芯硅谷混纤膜吸附作用随体积变化差异次之;安谱尼龙、津腾聚醚砜、芯硅谷PVDF针式过滤器随体积变化表现出较强的吸附差异。结合含量数据分析发现,安谱亲水性PTFE组平均含量与离心样品相差0.93 %,而安谱水相聚醚砜组或芯硅谷亲水性PVDF组平均含量与离心样品相差2.3 %,2.5 %。
2.5.2 苯扎氯铵同系物吸附差异 在方法探究过程中,发现苯扎氯铵峰同系物的峰面积出现不同程度的吸附情况;故设计试验进行吸附差异对比验证。将同一批次的苯磺贝他斯汀滴眼液,分别采用不同材质的滤膜过滤不同体积的初滤液,并收集滤液作为待测样品,照2.1项下色谱条件,进行HPLC分析,考察滤膜材质与过滤体积对苯扎氯铵两种同系物的吸附差异。结果,亲水性PTFE、疏水性PTFE、尼龙或水相聚醚砜过滤不同体积的苯扎氯铵两种同系物峰面积之比的RSD分别为:1.9 %,3.5 %,11.2 %,2.0 %,亲水性材质的PTFE或聚醚砜吸附差异可控约2 %,疏水性材质的PTFE或尼龙具有较强的吸附差异,且尼龙差异相比更高。表明,各滤膜对苯扎氯铵两种同系物吸附作用不同,C链越长吸附作用越强,导致两峰面积比例发生显著变化;因此滤膜吸附情况评估,还需关注同系物类别。
综上分析,提示采用安谱亲水性PTFE为滤膜过滤,滤膜吸附可控性好。以尽可能排除滤膜吸附影响。
3 讨论
国内关于苯磺贝他斯汀制剂及分析方法研究方面的文献报道目前较少,包括苯磺贝他斯汀片的研制及体外评价[7]、苯磺贝他斯汀片剂的含量测定方法[8]及苯磺酸贝他斯汀滴眼液中异构体分析方法研究[9]等。本研究参照《中国药典》2015年版中多个滴眼液品种中抑菌剂的常规检查方法及文献报道的抑菌剂含量分析经验[10-11],经方法摸索与优化,建立了苯磺贝他斯汀滴眼液中苯扎氯铵分析方法并进行方法学验证。结果表明,该测定方法专属性好,灵敏度较高,能有效控制本品中抑菌剂含量。
通常,为防止液相系统堵塞,HPLC样品大多数情况下需经滤膜过滤才可进样分析;其中针式过滤器由于使用方便快捷,在实验室中应用广泛。但苯扎氯铵可被多种滤膜吸附,特别是疏水或阴离子型滤膜[12];上述试验也提示本品种中苯扎氯铵可被滤膜吸附。因此,对苯磺贝他斯汀滴眼液中苯扎氯铵含量测定样品的处理需注意其滤膜吸附作用,并确定滤膜材质与来源。多篇关于液体制剂中苯扎氯铵含量检测的文献均未重视滤膜吸附问题,且未列明所使用的的滤膜材质与来源;若滤膜选择不当与不固定,可能导致“吸附不可控”造成的检测结果“忽高忽低”的现象,存在较大的检测风险。
通过互联网检索与了解其他厂家在研项目,发现滴眼液中苯扎氯铵检查或生产线滤器的吸附情况具有一定的普遍性。在中试或生产过程中苯扎氯铵检测结果若出现异常,需排查是生产过程滤器吸附问题,还是检测样品过滤环节的问题,分析异常原因,谨慎采取“过量投料”苯扎氯铵的措施,防止实际抑菌剂浓度过高,出现安全风险。因此,针对各品种抑菌剂使用的实际情况,需在质量标准中纳入抑菌剂含量检查项目,以控制高风险制剂滴眼液产品中抑菌剂含量符合要求及生产工艺重现性,保障人体用药安全,具有一定的理论与实际意义。

