毛竹APX基因系统进化与表达分析
章妮 陈克龙 崔博亮 杨阳






摘 要: 抗壞血酸过氧化物酶(aseorbate peroxidase, APX)是植物活性氧代谢中重要的抗氧化酶之一,尤其是叶绿体中清除H2O2的关键酶,也是维生素C代谢的主要酶类。该文基于生物信息学方法,利用毛竹的基因组及转录组数据鉴定毛竹中的APX基因家族成员,并对其编码的蛋白基本理化性质、基因结构、启动子元件、系统进化及共线性关系、重复串联基因、GO注释及表达模式进行综合分析,共鉴定出21种编码APX的基因。结果表明:(1)PeAPX基因家族成员多为不稳定疏水蛋白,基因结构、基序及结构域相对较为保守,大多数APX基因具有高度保守的内含子模式。(2)系统进化关系显示毛竹APX基因与水稻APX基因有着较高的同源性关系,PeAPX具有较高的进化保守性。(3)Ka/Ks分析表明PeAPX基因都经历了纯化选择压力,此外在每个APX基因的启动子序列中发现有许多与应激反应和植物激素相关的顺式作用元件,结合表达量分析,表明毛竹APX基因在毛竹生长发育中起着正向促进作用。该研究为进一步了解毛竹APX基因家族基本功能及其抗氧化机制提供了一定的参考,为毛竹APX基因功能的深层次鉴定提供了重要依据。
关键词: 毛竹, APX基因家族, 生物信息学, 系统进化, 基因表达
中图分类号: Q945.78
文献标识码: A
文章编号: 1000-3142(2021)12-1964-10
收稿日期: 2020-09-25
基金项目: 国家自然科学基金(41661023) [Supported by the National Natural Science Foundation of China (41661023)]。
作者简介: 章妮(1997-),硕士研究生,主要从事湿地生态学研究,(E-mail)1581146264@qq.com。
通信作者: 陈克龙,二级教授,博士研究生导师,主要从事生物地理与湿地生态研究,(E-mail)ckl7813@163.com。
Phylogenetic evolution and expression analysis of APX gene in Phyllostachys edulis
ZHANG Ni1,2, CHEN Kelong2,3*, CUI Boliang2, YANG Yang1,2
( 1. College of Life Science, Qinghai Normal University, Xining 810008, China; 2. Qinghai Provincial Key Laboratory of Physical Geography and Environmental Processes, Xining 810008, China; 3. Science and Technology Department, Qinghai Normal University, Xining 810008, China )
Abstract: Aseorbate peroxidase (APX) is one of the important antioxidant enzymes in the active oxygen metabolism of plants, especially the key enzyme to remove H2O2 from chloroplasts, and also the main enzyme in vitamin C metabolism. In this study, a total of 21 species encoding APX gene were identified based on bioinformatics methods, useing Phyllostachys edulis in the genome and transcriptome data to identify of PeAPX gene family members, through comprehensively analyzing its coding protein, basic physical and chemical properties, gene structure, promoter element, system evolution and the collinearity relationship, repeat the tandem, GO annotation and expression pattern. The results were as follows: (1) Most members of the PeAPX gene family were unstable hydrophobic proteins, and the gene structure, motif and domain were relatively conservative, and most APX genes have a highly conserved intron pattern. (2) Phylogenetic relationship showed that APX gene of P. edulis had high homology with APX gene of Oryza sativa, and PeAPX had a high evolutionary conservatism. (3) Ka/Ks analysis showed that all PeAPX genes experienced purified selection pressure. In addition, many cis-acting elements related to stress response and plant hormones were found in the promoter sequence of each APX gene. Combined with expression analysis, it was indicated that APX gene played a positive role in the growth and development of Phyllostachys edulis. This study provides a reference for further understanding of the basic functions of the APX gene family and its antioxidant mechanism, and provides an important reference for the in-depth identification of the functions of APX genes.
Key words: Phyllostachys edulis, APX gene family, bioinformatics, phylogenetic evolution, gene expression
植物的生长发育、信号转导以及生物或非生物胁迫过程均有活性氧(ROS)的产生(Wu & Wang, 2019)。ROS为植物细胞内氧化还原反应或O2活化衍生的代谢产物,在调节植物对环境因素的细胞反应中起重要作用(Vaahtera et al., 2014; Mignolet-Spruyt et al., 2016; Pandey et al., 2017)。其存在形式為自由基及非自由基,主要包含过氧化氢(H2O2)、羟基自由基 (-OH)、单线态氧 (1O2)、超氧阴离子自由基 (O2-)、有机氧自由基 (RO·和ROO·) 等(Fernandez-Garcia et al., 2010; 王福祥等,2019)。而H2O2作为一类主要的ROS,也是唯一能通过质膜水通道蛋白跨膜的分子,参与着植物细胞发育和抗逆性的调控过程,在植物代谢中起着双重作用(Panchuk et al., 2005; Pinheiro et al., 2011; Ozyigit et al., 2016)。而高水平的H2O2会导致植物氧化应激并对生物大分子造成损害(Bailey-Serres et al., 2006; Mignolet-Spruyt et al., 2016)。因此,植物体内开发出抗氧化系统通过抗氧化剂酶作用来保护细胞免受氧化损害,例如抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)、过氧化物酶(PRXs)、谷胱甘肽过氧化物酶(GPX)等酶维持平衡是H2O2保持稳态水平的关键所在(Imahory et al., 2008;于飞, 2013)。
APX广泛存在于植物体内,对H2O2有着高亲和力,能通过抗坏血酸-谷胱甘肽循环 (ASA-GSH) 催化H2O2转化为H2O,可能在H2O2清除方面发挥着特殊作用(Passardi et al., 2007; Qin et al., 2008; Huang et al., 2017)。目前,拟南芥 (Arabidopsis thaliana)(Chew et al., 2003; Panchuk et al., 2002)、水稻 (Oryza sativa)(Teixeira et al., 2006)、陆地棉 (Gossypium hirsutum)(Tao et al., 2018)、玉米 (Zea mays)(任瑛等, 2014)、番茄 (Solanum lycopersicum)(Najami et al., 2008)等多种植物中的APX基因已经进行了家族成员的鉴定和功能验证方面的研究。有研究表明,APX基因参与植物生长发育及非生物胁迫响应的过程,逆境响应过程中,有特定的一种或几种APX发挥着主要作用,保护植物体细胞免受伤害(Khanna-Chopra et al., 2011; 李泽琴等, 2013, 2019)。
毛竹(Phyllostachys edulis)栽培历史悠久、面积分布广泛,是我国亚热带地区重要的经济竹种(Peng et al., 2013)。由于其对高盐、干旱、冷热及病虫害等胁迫的较强敏感性,从而导致毛竹品质受到严重影响。目前对毛竹APX基因鲜有研究,本文基于已经公布的毛竹基因组及转录组数据库通过生物信息学分析方法鉴定毛竹APX基因家族成员,并通过分析它们的进化关系、基因结构、保守结构域、顺式作用元件以及在不同非生物胁迫下的表达模式,借以了解毛竹的应激耐受性,并为进一步研究毛竹APX的功能提供基础。
1 材料与方法
1.1 毛竹APX基因家族成员的鉴定
从竹子基因组数据库 (BambooGDB,http://www.bamboogdb.org/) 下载毛竹的基因组数据。以拟南芥APX 基因序列作为种子序列,通过BLASTp软件检索本地毛竹蛋白数据库,筛选E值为1×e-20,从而获得候选基因家族成员。进一步通过seqtk软件提取候选基因序列,提交PFAM(https://pfam.xfam.org/)、KEGG (https://www.genome.jp/kegg/) 和 NCBI-BLASTCDD (https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi) 三大数据库进行基因鉴定,从而确定毛竹APX基因家族成员。
1.2 APX基因家族基序与基因结构分析
利用本地版MEME软件预测APX基因的基序(motif),通过R中的ggplot2包绘制基序数目统计图和基序分布图,ggtree包绘制进化树,依据毛竹基因组数据库中的GFF注释文件获得PeAPX基因位置信息,gggenes包绘制基因结构图。
1.3 APX基因家族进化关系与保守结构域分析
通过NCBI下载拟南芥、水稻、陆地棉等物种的APX基因序列,利用mafft软件进行多序列比对,通过fasttree软件以最大似然法 (ML) 构建多物种间系统发育树,bootstrap设置为1 000,并通过Pfam数据库预测全部APX基因的蛋白保守结构域,evolview(https://www.evolgenius.info/evolview/#login)在线网站进行数据可视化。
1.4 APX基因家族GO注释
利用在线软件eggnog-mapper (http://eggnog-mapper.embl.de/) 对PeAPX基因的生物学功能进行GO (Gene ontology) 注释,并通过R中的ggplot2包绘制GO注释图。
1.5 APX基因家族启动子特征分析
从毛竹全基因数据库中提取每个APX基因起始密码子上游2 kb DNA序列,运用在线数据库PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/search_CARE.html)预测每条基因所含有的顺势作用元件,通过ggplot2包绘制顺势作用元件分布图与作用元件数目统计图。
1.6 APX串联重复基因分析
使用MCscanx筛选PeAPX基因家族中的串联重复基因,并根据gff基因注释信息运用Circos软件绘制串联重复基因的Circos圖,用KaKs_Calculator软件计算串联重复基因的Ka/Ks值,用ggpubr包进行数据可视化。
1.7 APX基因家族染色体定位及共线性分析
通过Mcscanx分析拟南芥、毛竹、水稻之间的共线性关系,并进行数据可视化,R中的circlize包绘制毛竹的染色体定位图。
1.8 APX基因家族的组织特异性表达热图绘制
通过NCBI SRA 数据库下载毛竹幼苗根组织经萘乙酸(naphthalene acetic acid, NAA)处理的6组转录组数据(登录号:SRR5710702, SRR5710701,
SRR5710700,SRR5710699,SRR5710698,SRR5710697),并根据转录组数据库提供的基因表达矩阵利用R中的pheatmap包绘制APX基因表达热图。
2 结果与分析
2.1 毛竹PeAPX基因家族成员鉴定及理化性质分析
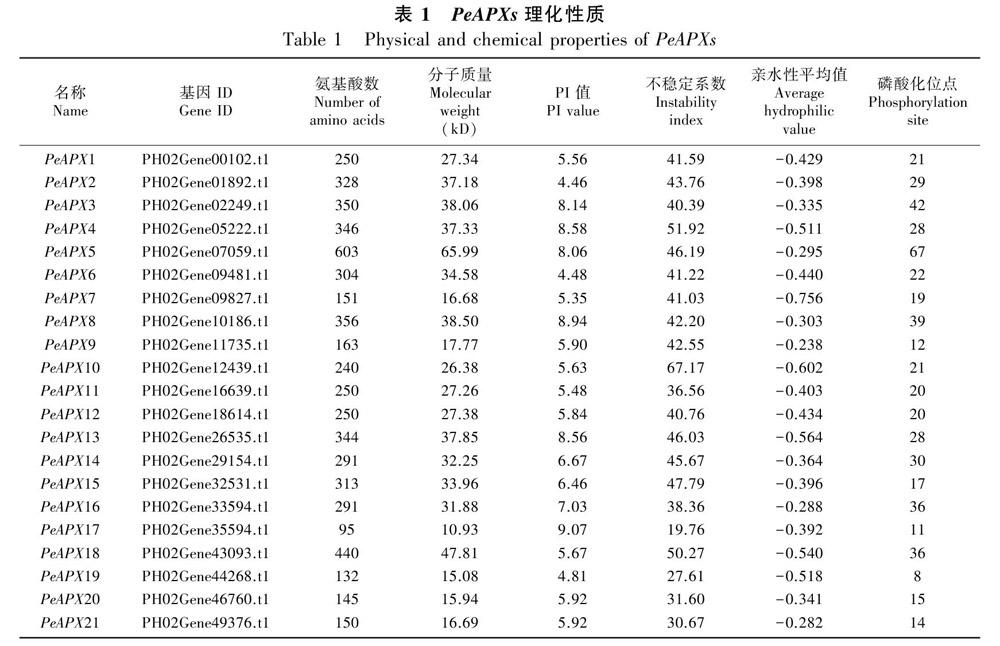
在毛竹基因组数据库中检索到21个非冗余的PeAPX基因,该基因所编码的蛋白序列理化性质分析发现,21个PeAPXs成员的蛋白序列存在较大差异(表1)。毛竹PeAPX蛋白序列长度在95 (PH02Gene35594.t1)~603个 (PH02Gene07059.t1)不等,蛋白分子量为 10.9~66.0 kDa,其中以PeAPX5最大, PeAPX17最小。等电点在4.46~9.07之间, 其中14个PeAPXs成员的等电点小于7,偏酸性;6个PeAPXs成员的等电点大于7,偏碱性;PeAPX16等电点为7.03,偏中性。不稳定指数在19.76~67.17之间,其中有6个PeAPXs蛋白为稳定蛋白,其余15个成员均为不稳定蛋白。亲水性平均值为-0.756~-0.238,均小于0,PeAPX家族成员均为疏水蛋白。磷酸化位点个数在8~67之间。TMHMM检测毛竹PeAPXs跨膜结构域,有五个PeAPX家族成员均含有1个跨膜结构域,分别为PeAPX14、PeAPX16、PeAPX18、PeAPX20、PeAPX21。
2.2 毛竹PeAPXs基因家族成员基因结构及保守基序分析
如图1所示,毛竹21条PeAPXs内含子-外显子结构存在较大差异,内含子数目在1~14间不等,多数基因含有7~8个内含子,其中PeAPX4基因长度与其余20个成员差异较大,存在一段约17 kb的非编码序列,可能存在基因的大片段复制。通过MEME软件对PeAPXs中的保守基序进行搜索,以进一步了解基序组成的多样性和演化关系,共发现10个保守基序。PeAPX家族成员所含基序数量(图2)在2~7之间,所含基序数较多的PeAPX基因家族成员N端的首个基序均为motif 4。PeAPX5的motif位置较远可能是由于该蛋白定位于内质网,属分泌蛋白。具有motif 7的蛋白均为碱性蛋白,具有motif 8的蛋白均为线粒体PeAPXs;17个PeAPX基因家族成员均有motif 5,motif 1在15个PeAPX家族成员中均有出现,表明这两个基序为PeAPX家族的高度保守结构。PeAPX14、PeAPX16、PeAPX20、PeAPX21的保守基序相差较大但仍聚为一支,可能是由于这四个成员均存在跨膜结构域,但PeAPX18同样存在跨膜结构域但未能聚在一起,可能是由于缺少motif 10,表明存在motif 10的APX蛋白可能具有功能特异性。且motif 10存在跨膜结构域,表明PeAPX18的跨膜结构与其余存在跨膜结构的毛竹PeAPXs跨膜序列存在差异。
2.3 毛竹PeAPXs与其他植物系统进化树及同源关系分析
为进一步明确不同物种间APX基因的亲缘关系,基于来自7种植物的83条序列构建植物APX系统进化树(图3),拟南芥(Arabidopsis thaliana)、水稻(Oryza sativa)、陆地棉(Gossypium hirsutum)、毛果杨(Populus trichocarpa)、毛竹均为绿色种子植物,莱茵衣藻(Chlamydomonas reinhardtii)为一种单细胞真核绿藻,小立碗藓(Physcomitrella patens)则为葫芦藓科的一类苔藓植物。结果显示,83条APX蛋白序列共分为6个亚家族,毛竹PeAPXs家族中有15个成员均分别与水稻OsAPXs家族的8个成员在第Ⅰ、第Ⅳ、第Ⅵ亚家族聚在一起,可能是由于毛竹与水稻均为单子叶植物,且同属禾本科,两物种间有着高度同源性。PeAPXs另6个成员分别处于第Ⅲ、第Ⅴ亚家族。第Ⅱ亚家族的成员仅有陆地棉这一物种,表明这几个成员可能存在种特异性。结构域分析显示, 所有序列均含有B1. 过氧化氢代谢过程; B2. 解毒; B3. 氧化-还原过程; B4. 活性氧代谢过程; B5. 对氧化应激的反应; B6. 对刺激的反应; B7. 对压力的反应; B8. 对有毒物质的反应; B9. 信号; B10. 对化学物质的反应; B11.抗生素分解代谢过程; B12. 抗生素代谢过程; B13. 细胞分解代谢过程; B14. 细胞代谢过程; B15. 细胞对化学刺激的反应; B16. 细胞对氧化应激的反应; B17. 细胞对刺激的反应; B18. 细胞对压力的反应; B19.细胞对有毒物质的反应; B20. 药物分解代谢过程; B21. 药物代谢过程; B22. 过氧化氢分解过程; B23. 废弃的辅因子分解过程; B24. 废弃的辅助因子代谢过程; C1. 细胞内的细胞器; C2. 废旧的细胞部分; C3. 细胞器小班; C4. 光合膜; C5. 质体; C6. 质体类囊体; C7. 质体类囊体膜; C8. 类囊体; C9. 制备类囊体膜; C10. 细胞组分; C11. 叶绿体; C12. 叶绿体类囊体; C13. 叶绿体类囊体膜; C14. 细胞质; C15. 胞内; C16. 胞内膜内的细胞器; C17. 膜; C18. 膜-有界的细胞器; C19. 过时的细胞; C20. 废弃的叶绿体部分; C21. 过时的胞质部分; C22. 过时的细胞内细胞器部分; C23. 细胞内废弃部分; C24. 残余的细胞器部分; C25. 废弃的质体部分; C26. 陈旧的类囊体部分; C27. 细胞器; M1. 抗氧化活性; M2. 催化活性; M3. 细胞色素-c过氧化物酶活性; M4. 分子功能; M5. 氧化还原酶活性; M6. 过氧化物酶活性。
B1. Hydrogen peroxide metabolic process; B2. Detoxification; B3. Oxidation-reduction process; B4. Reactive oxygen species metabolic process; B5. Response to oxidative stress; B6. Response to stimulus; B7. Response to stress; B8. Response to toxic substance; B9. Signaling; B10. Response to chemical; B11. Antibiotic catabolic process; B12. Antibiotic metabolic process; B13. Cellular catabolic process; B14. Cellular metabolic process; B15. Cellular response to chemical stimulus; B16. Cellular response to oxidative stress; B17. Cellular response to stimulus; B18. Cellular response to stress; B19. Cellular response to toxic substance; B20. Drug catabolic process; B21. Drug metabolic process; B22. Hydrogen peroxide catabolic process; B23. Obsolete cofactor catabolic process; B24. Obsolete cofactor metabolic process; C1. Intracellular organelle; C2. Obsolete cell part; C3. Organelle subcompartment; C4. Photosynthetic membrane; C5. Plastid; C6. Plastid thylakoid; C7. Plastid thylakoid membrane; C8. Thylakoid; C9. Thylakoid membrane; C10. Cellular component; C11. Chloroplast; C12. Chloroplast thylakoid; C13. Chloroplast thylakoid membrane; C14. Cytoplasm; C15. Intracellular; C16. Intracellular membrane-bounded organelle; C17. Membrane; C18. Membrane-bounded organelle; C19. Obsolete cell; C20. Obsolete chloroplast part; C21. Obsolete cytoplasmic part; C22. Obsolete intracellular organelle part; C23. Obsolete intracellular part; C24. Obsolete organelle part; C25. Obsolete plastid part; C26. Obsolete thylakoid part; C27. Organelle; M1. Antioxidant activity; M2. Catalytic activity; M3. Cytochrome-c peroxidase activity; M4. Molecular function; M5. Oxidoreductase activity; M6. Peroxidase activity.
GARE-motif. 赤霉素响应元件; AuxRE, TGA-element, AuxRR-core. 生长素响应元件; CGTCA-motif, TGACG-motif. 茉莉酸甲酯响应元件; ABRE. 脱落酸响应元件; TCA-element. 水杨酸响应元件; LTR. 低温响应元件; MBS. 干旱诱导元件; ARE. 厌氧诱导元件; TC-rich-repeats. 防御及胁迫响应元件; GC-motif. 缺氧诱导元件; WUN-motif. 机械损伤响应元件; O2-site. 蛋白代谢调控元件; RY-element, plant_AP-2-like. 种子特异性调控元件; circadian. 昼夜节律控制元件; Box-Ⅱ-like-sequence. 顺式作用监管元件; GCN4_motif. 胚乳表达元件; MBSI. 黄酮生物合成调控元件; 3-AF3-binding-site. 部分保守DNA序列元件。
GARE-motif. Gibberellin response element; AuxRE, TGA-element, AuxRR-core. Auxin response element; CGTCA-motif, TGACG-motif. Methyl jasmonate response element; ABRE. Abscisic acid response element; TCA-element. Salicylic acid response element; LTR. Low temperature response element; MBS. Drought-inducing element; ARE. Anaerobic-inducing element; TC-rich-repeats. Defense and stress response elements; GC-motif. Anoxic-inducing element; WUN-motif. Mechanical damage response element; O2-site. Regulatory elements of protein metabolism; RY-element, plant_AP-2-like. Seed-specific regulatory elements; circadian. Circadian rhythm control elements; Box-Ⅱ-like-sequence. Cis-acting supervisory element; GCN4_motif. Endosperm expression element; MBSI. Regulatory elements for flavonoid biosynthesis; 3-AF3-binding-site. Partially conserved DNA sequence elements.Peroxidase這一蛋白结构域,毛竹PeAPX家族成员中存在结构域长度的变化,结构域较短的PeAPX家族成员分子量均较小。
2.4 毛竹PeAPX GO注释分析
毛竹PeAPX的GO注释(图4)表明,所有基因被注释到3大类,分别为生物过程(biological process)、细胞组分(cellular component)和分子功能(molecular function),以分子功能注释结果占比最少,生物过程和细胞组分注释结果居多。生物过程分类主要聚集于细胞物质代谢过程,细胞组分分类中多为细胞器和类囊体,分子功能分类则表现为酶活性富集。由此可推断PeAPX在毛竹的生长发育及代谢过程中发挥了较大作用。
2.5 毛竹PeAPXs顺式作用元件分析
分析PeAPXs基因家族编码区起始密码子上游2 kb区域内的启动子序列,结果表明PeAPXs启动子序列上游均含有典型的TATA-box这一核心顺式作用元件,同时存在大量信号转导相关的激素响应元件、非生物逆境胁迫响应元件及生长发育相关的表达调控元件(图5),可能参与相应的表达调控过程。其中非生物逆境胁迫响应元件包括低温、厌氧、缺氧、防御及胁迫等响应元件,表明毛竹PeAPX基因家族成员在毛竹抗逆过程中与各类应激反应息息相关。不同的毛竹PeAPX基因所含的顺式作用元件类别及数量存在差异(图5:B),脱落酸响应元件 (ABRE) 在毛竹PeAPX基因家族的大多成员中数量占比较大,表明PeAPXs主要在毛竹的成熟过程中起到了促进作用,PeAPX7的激素响应元件为茉莉酸甲酯响应元件,可促进植物体成熟,其余元件多为非生物胁迫响应元件,表明其主要在毛竹抗逆过程中发挥作用。
2.6 不同物种串联重复基因分析及毛竹PeAPX家族染色体定位、共线性分析
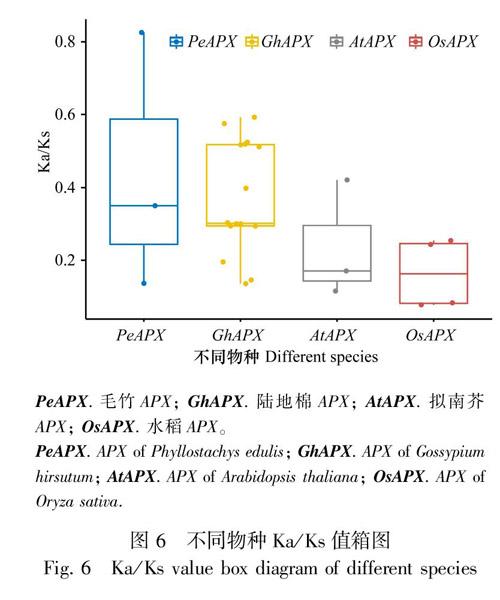
利用Ka/Ks值 [非同义替换位点替换次数(Ka)与同义替换位点替换次数(Ks)的比值]来估计毛竹(PeAPX)、陆地棉(GhAPX)、拟南芥(AtAPX)、水稻(OsAPX)的APX基因家族成员的进化选择模式,比值均小于1(图6),表明各物种的APX基因家族成员都为纯化选择。毛竹PeAPX基因家族21个家族成员定位于13条染色体上(图7:A),不同染色体基因分布密度存在差异,以s13密度居高,PeAPX6、PeAPX16均定位于该染色体;以单染色体来看,s23分布的家族成员最多,出现了4个PeAPX基因。毛竹、拟南芥、水稻的共线性关系表明(图7:B),仅有5个APX同源蛋白基因出现在拟南芥染色体中,水稻染色体中的APX同源蛋白基因为12个,表明毛竹与水稻的亲缘关系更近。拟南芥中的APX家族成员部分在毛竹中有对应的多个同源拷贝,可推断APX基因家族在演化过程中可能存在全基因组多倍化事件。
2.7 毛竹APX基因家族的组织特异性表达
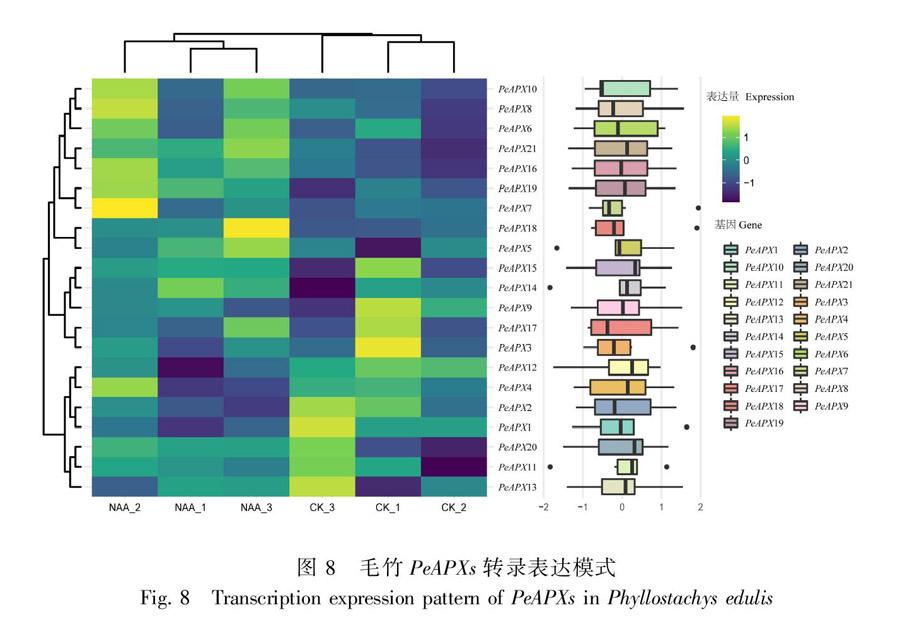
依据不同PeAPX蛋白的转录表达数据绘制热图 (图8) 以探究毛竹APX基因的潜在功能。21个PeAPX基因家族成员经萘乙酸处理后,大部分成员呈现上调表达趋势,仅PeAPX1、PeAPX2、PeAPX4及PeAPX12表达显著下调,表明萘乙酸处理下,能够促进毛竹PeAPX家族成员的表达,PeAPX家族成员在毛竹的生长发育过程中可能起到了重要的正向促进作用。
3 讨论与结论
APX基因,作为一类普遍存在的抗氧化酶类基因,在植物生长发育和胁迫耐受性等方面的各种生物学过程中均起着重要作用(Fryer et al., 2003; Davletova et al., 2008; Pandey et al., 2017)。毛竹基因组及转录组的成功破译为研究毛竹中APX基因的进化和趋异奠定了坚实基础。本文旨在鉴定毛竹中APX基因特定的细微变化,从而更全面地了解PeAPXs的各项功能并揭示其调控机制。本研究中,经分析鉴定得出毛竹APX基因家族成员共21个,定位在13条scaffold上。相较于拟南芥、水稻等植物只有8条APX(Panchuk et al., 2002; Chew et al., 2003; Teixeira et al., 2006),种间数量差异极为明显,可推测毛竹APX基因可能存在大量串联重复序列和大片段复制。系统发育分析表明,毛竹中的APX基因遵循与其植物相似的分布模式, 根据系统发育树分析PeAPX分布于5个亚家族,同组内PeAPX基因间亲源关系较近,这可能是由于其基因结构高度保守所导致;基因结构分析结果也表明PeAPX基因存在着高度保守的内含子-外显子结构。不同组间其亲源关系较远,表明PeAPX基因家族具有明顯的功能多样性。长期的进化过程中,选择压力在塑造基因家族中起着重要作用,从而导致基因家族之间的进化模式不同(Teixeira et al., 2006),对毛竹的研究表明PeAPX串联重复基因的Ka/Ks比值均小于1,这表明PeAPX基因家族已经经历了纯化选择压力。
从PeAPX基因家族启动子元件的预测结果可知,所有成员的启动子区域均含有大量与逆境胁迫相关的顺式作用元件,如GARE-motif、ABRE等,表明它们广泛参与了毛竹生长发育过程中的逆境胁迫应答,对调控植物生长发育、抵抗逆境胁迫过程起着重要作用。王兵等(2020)对毛白杨APX的过表达研究表明APX的高表达量提高了植物体的抗逆能力。Pnueli et al.(2003)的研究也表明APX基因的缺乏致使拟南芥植物体生长受限。基因表达模式通常与其功能密切相关,对差异表达谱的分析可以为研究基因家族提供重要信息(Guo et al., 2008)。通过NAA对毛竹进行胁迫处理与对照组相比,发现大部分基因的表达量均处于上升趋势,这有可能源于逆境激活了某种潜在的转录因子,而这种转录因子又作用于APX基因,诱导其大量表达来促使植物更好地适应外界环境。APX基因的表达对植物抗逆及生长发育能力均存在一定程度的影响,已有研究表明APX基因突变会严重影响蛋白稳定性(Wu et al., 2018),另有研究表明APX基因可保护细胞器免受损伤(Davletova et al., 2005),推测植物激素可能与抗逆基因的表达息息相关。
毛竹的生长发育与抗逆基因的表达密切相关。通过对毛竹进行APX基因家族的鉴定和详细分析发现,毛竹的APX基因家族在进化过程中发生了分化,并对各种非生物胁迫产生了广泛的响应。这种发现有利于了解毛竹在应对恶劣环境的适应性,并为PeAPX进一步的功能分析提供基础,未来可从蛋白质组学和代谢组学等方面对基因功能进行更详尽的研究。
参考文献:
BAILEY-SERRES J, MITTLER R, 2006. The roles of reactive oxygen species in plant cells [J]. Plant Physiol, 14(2): 311.
CHEW O, WHELAN J, MILLAR AH, 2003. Molecular definition of the ascorbate-glutathione cycle in Arabidopsis mitochondria reveals dual targeting of antioxidant defenses in plants [J]. J Biol Chem, 278(47): 46869-46877.
DAVLETOVA S, RIZHSKY L, LIANG H, et al., 2005. Cytosolic ascorbate peroxidase 1 is a central component of the reactive oxygen gene network of Arabidopsis [J]. The Plant Cell, 17(1): 268-281.
FERNANDEZF-GARCIA N, GARMA JG, OLMOS E, 2010. ROS as biomarkers in hyperhydricity [J]. Reactive Oxygen Species Antioxidants Higher Plants: 249.
FRYER MJ, BALL L, OXBOROUGH K, et al., 2003. Control of Ascorbate Peroxidase 2 expression by hydrogen peroxide and leaf water status during excess light stress reveals a functional organisation of Arabidopsis leaves [J]. Plant J, 33(4): 691-705.
GUO JK, WU J, JI Q, et al., 2008. Genome-wide analysis of heat shock transcription factor families in rice and Arabidopsis [J]. J Genet Genom, 35(2): 105-118.
HUANG L, JIA J, ZHAO X, et al., 2018. The ascorbate peroxidase APX1 is a direct target of a zinc finger transcription factor ZFP36 and a late embryogenesis abundant protein OsLEA5 interacts with ZFP36 to co-regulate OsAPX1 in seed germination in rice [J]. Biochem Biophy Res Comm, 495(1): 339-345.
IMAHORI Y, TAKEMURA M, BAI J, 2008. Chilling-induced oxidative stress and antioxidant responses in mume (Prunus mume) fruit during low temperature storage [J]. Posthar Biol Technol, 49(1): 54-60.
KHANNA-CHOPRA R, JAJOO A, SEMWAL VK, 2011. Chloroplasts and mitochondria have multiple heat tolerant isozymes of SOD and APX in leaf and inflorescence in Chenopodium album [J]. Biochem Biophy Res Comm, 412(4): 522-525.
LI ZQ, LI JT, BING J, et al., 2019. Effect of APX family genes on plant growth and abiotic stress response [J]. Genetics, 41(6): 534-549. [李澤琴, 李锦涛, 邴杰, 等, 2019. 拟南芥APX家族基因在植物生长发育与非生物逆境胁迫响应中的作用分析 [J]. 遗传, 41(6): 534-549.]
LI ZQ, LI JX, ZHANG GF, 2013. Expression regulation of plant ascorbate peroxidase and its tolerance to abiotic stresses [J]. Hereditas, 35(1): 45-54. [李泽琴, 李静晓, 张根发, 2013. 植物抗坏血酸过氧化物酶的表达调控以及对非生物胁迫的耐受作用 [J]. 遗传, 35(1): 45-54.]
MIGNOLET-SPRUYT L, XU E, IDNHEIMO N, et al., 2016. Spreading the news: subcellular and organellar reactive oxygen species production and signalling [J]. Exp Bot, 67(13): 3831-3844.
NAJAMI N, JANDA T, BARRIAH W, et al., 2008. Ascorbate peroxidase gene family in tomato: its identification and characterization [J]. Mol Genet Genom, 279(2): 171-182.
OZYIGIT II, FILIZ E, VATANSEVER R, et al., 2016. Identification and comparative analysis of H2O2-scavenging enzymes (ascorbate peroxidase and glutathione peroxidase) in selected plants employing bioinformatics approaches [J]. Front Plant Sci, 7: 301.
PANDEY S, FARTYAL D, AGARWAL A, et al., 2017. Abiotic stress tolerance in plants: myriad roles of ascorbate peroxidase [J]. Front Plant Sci, 8: 581.
PANCHUK II, ZENTGRAF U, VOLKOV RA, 2005. Expression of the APX gene family during leaf senescence of Arabidopsis thaliana [J]. Planta, 222(5): 926-932.
PANCHUK II, VOLKOV RA, SCHOFFL F, 2002. Heat stress-and heat shock transcription factor-dependent expression and activity of ascorbate peroxidase in Arabidopsis [J]. Plant Physiol, 129(2): 838-853.
PASSARDI F, BAKALOVIC N, TEIXEIRA FK, et al., 2007. Prokaryotic origins of the non-animal peroxidase superfamily and organelle-mediated transmission to eukaryotes [J]. Genomics, 89(5): 567-579.
PENG ZH, LU Y, LI LB, et al., 2013. The draft genome of the fastgrowing non-timber forest species Moso bamboo (Phyllostachys heterocycla) [J]. Nat Genet, 45(4): 456-461.
PINHEIRO C, CHAVES MM, 2011. Photosynthesis and drought: can we make metabolic connections from available data? [J]. Exp Bot, 62(3): 869-882.
PNUELI L, LIANG H, ROZENBERG M, et al., 2003. Growth suppression, altered stomatal responses, and augmented induction of heat shock proteins in cytosolic ascorbate peroxidase (Apx1)-deficient Arabidopsis plants [J]. Plant J, 34(2): 187-203.
QIN YM, HU CY, ZHU YX, 2008. The ascorbate peroxidase regulated by H2O2 and ethylene is involved in cotton fiber cell elongation by modulating ROS homeostasis [J]. Plant Signal Behav, 3(3): 194-196.
REN Y, ZHAO MA, GUO XM, et al., 2014. Cloning and prokaryotic expression analysis of APX gene from maize [J]. Acta Agric Boreal-Sin, 29(4): 49-55. [任瑛, 趙美爱, 郭新梅, 等, 2014. 玉米APX基因的克隆及其原核表达研究 [J]. 华北农学报, 29(4): 49-55.]
TAO CC, JIN X, ZHU LP, et al., 2018. Genome-wide investigation and expression profiling of APX gene family in Gossypium hirsutum provide new insights in redox homeostasis maintenance during different fiber development stages [J]. Mol Gene Genom, 293(3): 685-697.
TEIXEIRA FK, MENEZES-BENAVENTE L, GALVAO VC, et al., 2006. Rice ascorbate peroxidase gene family encodes functionally diverse isoforms localized in different subcellular compartments [J]. Planta, 224(2): 300.
VAAHTERA L, BROSCHE M, WRZACZEK M, et al., 2014. Specificity in ROS signaling and transcript signatures [J]. Antioxid Redox Signal, 21(9): 1422-1441.
WANG B, CHENG ZY, ZHANG L, et al., 2020. Tobacco overexpression Populus tomentosa mitochondria ascorbate peroxidase improving stress resistance [J]. Beijing For Univ, 42(7): 33-39. [王兵, 程子义, 张蕾, 等, 2020. 过表达毛白杨线粒体APX基因烟草提高抗逆能力的研究 [J]. 北京林业大学学报, 42(7): 33-39.]
WANG FX, XIAO KZ, JIANG SF, et al., 2019. Mechanism of reactive oxygen species in plants under drought stress [J]. Chin Sci Bull, 64(17): 1765-1779. [王福祥, 肖开转, 姜身飞, 等, 2019. 干旱胁迫下植物体内活性氧的作用機制 [J]. 科学通报, 64(17): 1765-1779.]
WU BM, WANG BB, 2019. Comparative analysis of ascorbate peroxidases (APXs) from selected plants with a special focus on Oryza sativa employing public databases [J]. PLoS ONE, 14(12): e0226543.
WU BM, LI L, QIU TH, et al., 2018. Cytosolic APX2 is a pleiotropic protein involved in H2O2 homeostasis, chloroplast protection, plant architecture and fertility maintenance [J]. Plant Cell Reports, 37(6): 833-848.
YU F, 2013. Subcellular localization of antioxidant system in leaves of cypress under low temperature stress [D]. Lanzhou: Lanzhou Jiaotong University. [于飞, 2013. 低温胁迫下圆柏属植物抗氧化系统在叶片中的亚细胞定位 [D]. 兰州: 兰州交通大学.]
(责任编辑 周翠鸣)

