胃食管反流病患者CYP2C19基因启动子的遗传变异和功能分析
王珏磊,南寿山,王柏清,王超,李朝霞,窦广仙,孙光斌,天津市第五中心医院消化内科 天津市 300450
0 引言
胃食管反流病(gastroesophageal reflux disease,GERD)是一种常见的慢性进行性消化系统疾病,主要表现为胃内容物反流而引起的不适症状或并发症.近些年,GERD的发病率在世界范围内呈上升趋势[1,2].一项基于全球范围内GERD发病率的系统性回顾分析显示,北美发病率为18.1%-27.8%,欧洲8.8%-25.9%,东亚2.5%-7.8%,中东8.7%-33.1%,澳大利亚11.6%,南美23.0%[3].我国因上消化道症状于消化科门诊就诊的GERD患者占13%[4].
GERD的诊断主要依赖于上消化道内镜检查、食管高分辨测压、食管24 h pH-阻抗监测等[5].GERD典型症状为反酸、烧心,常伴有胸痛、嗳气、恶心、吞咽困难等,亦可伴有食管外症状如胸痛、咳嗽、哮喘、喉炎、牙蚀症等,常见的并发症为反流性食管炎、消化道出血、消化道狭窄、Barrett食管和腺癌[6].GERD的危险因素复杂,可大致分为环境因素和遗传因素,包括吸烟、饮酒、幽门螺杆菌感染、心理因素、肥胖、年龄、性别、基因突变等[7-9].
质子泵抑制剂(proton pump inhibitors,PPIs)是临床上用于GERD治疗的主要药物,其中奥美拉唑、兰索拉唑、泮托拉唑等第一代PPIs,通过抑制胃壁上分泌胃酸的质子泵发挥抑酸作用,经肝脏中CYP2C19代谢后,血药浓度逐渐降低[10].既往研究表明,CYP2C19基因具有高度多态性,已发现超过25个单核苷酸多态性(single nucleotide polymorphisms,SNPs)[11].CYP2C19基因多态性与药物代谢能力相关,显著影响PPIs如奥美拉唑、兰索拉唑、泮托拉唑等,抗血小板药物氯吡格雷和部分抗抑郁药物的疗效和安全性[11-14].CYP2C19基因分型不同的患者,其PPIs的药代动力学改变较大,进而影响了GERD的治疗[15].中国人群中CYP2C19基因多态性位点主要包括*2 (G681A)、*3 (G636A),这两个突变位点均可导致CYP2C19酶活性降低;没有突变的野生型以*1表示.按照药物代谢动力学特征,不同基因型对应的代谢类型分别为正常代谢型(*1/*1;normal metabolizers,NMs),中间代谢型(*1/*2,*1/*3;intermediate metabolizers,IMs),慢代谢型(*2/*2,*2/*3,*3/*3;poor metabolizers,PMs)[16].但是在临床上,我们发现部分正常代谢型GERD患者,经PPIs诊断性治疗后效果不明显,说明可能还有其他因素发挥作用.
基因启动子区是控制基因表达的重要调控元件;CYP2C19启动子区如发生基因变异,可能影响基因表达,进而改变其生物学功能.在本研究中,我们将筛选正常代谢型GERD患者CYP2C19基因启动子区的潜在变异,并在细胞水平验证基因变异对CYP2C19启动子功能的影响,进而分析CYP2C19启动子区功能改变与GERD患者经PPI治疗效果的相关性,为中国人群中GERD患者的临床用药和治疗提供了新的思路.
1 材料和方法
1.1 材料 研究对象:收集2019-01/2020-06来我院治疗的经胃镜或24 h食管pH-阻抗监测确诊的散发性GERD患者全血163例,经奥美拉唑2倍剂量治疗2 wk,按烧心症状的严重程度及频率评分.其中实验组患者经 PPIs诊断性治疗后,症状积分降低>50%,症状未完全消失(n=82);对照组患者治疗后症状完全消失(n=81).全部患者CYP2C19基因型经检测为*1/*1,并按照种族、性别和年龄进行匹配.本研究方案符合《赫尔辛基宣言》的原则,经天津市第五中心医院人类伦理委员会批准,所有受试者均获得知情同意.
1.2 方法 DNA序列分析及基因变异筛选:按照BloodZol试剂盒(北京全式金生物科技有限公司)说明书操作,从全部样本的外周血淋巴提取细胞基因组DNA.参考NCBI中从人类CYP2C19基因序列(NCBI,NC_000010.11),设计PCR引物,扩增CYP2C19基因启动子区(1665bp);PCR产物经ABI 3730基因分析仪进行Sanger测序分析并筛选基因变异.扩增和测序用引物序列在表1中.
1.3 细胞转染和双荧光素酶报告基因检测 将CYP2C19基因启动子片段(野生型/变异型)克隆到萤火虫荧光素酶报告基因载体pGL3 basic,并分别转染HEK 293T细胞;作为内参质粒,表达海肾素荧光素酶的载体pRL-TK同时进行共转染.细胞转染48 h后,按照双荧光素酶报告基因检测试剂盒(北京全式金生物科技有限公司)操作说明,检测萤火虫和海肾荧光素酶的荧光值.
统计学处理以测定的萤火虫萤光素酶荧光值除以海肾萤光素酶的荧光值,得到相对荧光值来反映CYP2C19基因启动子的转录活性,所有的实验均独立进行3次.数据采用非配对t检验进行处理和分析,P值小于0.05被认为具有统计学意义.
2 结果
2.1 3个新的基因变异被发现 本研究从3例实验组GERD患者CYP2C19基因(*1/*1)启动子序列中分别筛查并发现了3个新发杂合变异,g.94761364 T>A,g.94762112 T>A和 g.94762514 G>T,Sanger测序峰图如图1所示;对照组中没有发现基因变异.经NCBI dbSNP和PubMed数据库搜索比对,这3个基因变异均未曾报道过.
2.2 双荧光素酶报告基因检测 为了研究CYP2C19启动子区的3个基因变异对其转录活性的影响,我们构建了表达载体pGL3 basic-CYP2C19启动子(野生型/变异型),并与内参质粒pRL-TK分别共转染到HEK 293T细胞中,48 h后检测双荧光素酶的相对荧光值,分别为pGL3-basic (0.31);pGL3-CYP2C19 (4.21);pGL3-94761364A(4.47);pGL3-94762112A (3.97);pGL3-94762514T (3.89),用于评价CYP2C19启动子的转录活性.结果如图2所示,携带基因变异的CYP2C19启动子的活性均受到影响;其中携带94761364A变异位点的CYP2C19启动子,与野生型相比,其活性显著升高(P=0.034).
3 讨论
GERD是一种多因素疾病,发病机制复杂.随着高通量测序技术的快速发展和测序成本的降低,通过测序直接分析GERD的遗传因素成为可能,越来越多与GERD发病相关的基因多态性或变异被发现[17].

表1 用于PCR和Sanger测序的引物序列
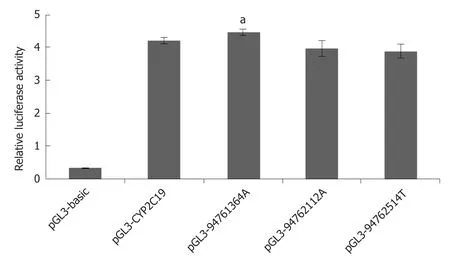
图2 pGL3-CYP2C19启动子(野生型/变异型)的相对荧光素酶活性.aP<0.05.
近期研究表明,人的GNB3基因发生突变后,将通过介导食管初级传入纤维末梢和中心对内脏刺激的反应,从而提高食管黏膜对胃酸的敏感性,可能成为GERD易感人群[18].白细胞介素-1 (IL-1)基因多态性及其单倍型与GERD的发生密切相关,GERD患者中IL-1基因TCCL单体型频率明显高于对照组(P=0.016);同时,GERD患者与对照组之间IL-1RN 1/2基因型差异有统计学意义[19].Lam发现FOXF1 rs9936833 (C allele)和MHC rs9257809 (A allele)的基因多态性与胃酸反流的存在相关性,有可能是一个潜在的遗传水平的GERD发病机制[20].BARX1基因和ADAMTS17基因在食管分化中起重要作用,Argyrou对来自希腊人群的160名GERD患者和180名健康对照受试者进行了前瞻性队列研究,发现了BARX1和ADAMTS17基因多态性(rs11789015和rs4965272)与GERD的发生发展显著相关[21].
细胞色素P450酶系(CYP450)对目前临床广泛使用的约70-80%的药物代谢起重要作用.CYP2C19作为重要的药物代谢酶,是CYP450超家族成员之一,参与约10%药物的体内代谢[22,23].CYP2C19基因多态性显著影响许多药物的疗效和安全性.例如,BMS-823778是治疗2型糖尿病的潜在候选药物,CYP2C19基因多态性显著影响该药物的在生物体内的代谢途径[13].CYP2C19基因型与氯吡格雷的抗凝作用密切有关,部分患者(*2/*2,*2/*3,*3/*3) 服用常规剂量氯吡格雷后会发生血栓性心血管不良事件;因此,对于经皮冠状动脉介入治疗合并药物洗脱支架植入术后的冠状动脉疾病患者,在使用氯吡格雷药物前,对患者进行CYP2C19基因多态性检测,并指导其调整用药剂量,具有重要的临床意义[24].
CYP2C19基因型与大多数主要通过CYP2C19代谢为非活性代谢物的PPIs的使用剂量、疗效和副作用密切相关.利用CYP2C19基因型数据指导PPI治疗的潜在好处包括:(1)通过基因型预测较低血药浓度的患者,为其开出更高剂量的处方,从而增加疗效的可能性;(2)通过基因型预测较高血药浓度的慢性治疗患者,为其开出低剂量的处方,以尽量减少与长期使用PPIs相关的毒性风险[25].
在本研究中,我们分别在3例散发性正常代谢型(*1/*1) GERD患者CYP2C19启动子基因序列中发现了3个新的杂合变异.细胞功能验证结果表明,三种变异均导致CYP2C19基因启动子转录活性的改变,其中携带94761364 T>A变异位点的CYP2C19启动子,其转录活性比野生型显著升高(P=0.034),有可能加快PPIs的代谢,并降低血药浓度,可能是患者治疗效果较差的因素之一;临床上可考虑更换非酶途径代谢的药物如雷贝拉唑等,开展进一步治疗.
4 结论
本实验的结果表明,CYP2C19启动子区碱基发生变异,也可能导致CYP2C19酶活性的改变,具有一定的临床意义,这一发现为中国人群中GERD患者的临床指导用药和治疗提供了新的思路.
文章亮点
实验背景
胃食管反流病(gastroesophageal reflux disease,GERD)是一种慢性疾病,主要治疗方法为口服质子泵抑制剂(proton pump inhibitors,PPIs),临床上常用的第一代PPIs,经肝脏中CYP2C19代谢,血药浓度逐渐降低.先前的研究已证明CYP2C19基因多态性导致PPIs在代谢速率、半衰期和药效等方面个体差异大,影响疗效.
实验动机
基因启动子区是控制基因表达的重要调控元件;CYP2C19启动子区如发生基因变异,可能影响基因表达,进而改变其生物学功能及PPIs在体内的代谢速率.
实验目标
在本研究中,我们将筛选正常代谢型(*1/*1)的GERD患者CYP2C19基因启动子区的变异,并在细胞水平验证基因变异对启动子功能的影响,进而分析CYP2C19启动子区功能改变与GERD经PPIs治疗效果的相关性.
实验方法
收集入院治疗的散发性GERD患者全血163例,实验组患者经PPIs诊断性治疗后,症状积分降低>50%,症状未完全消失(n=82);对照组患者治疗后症状完全消失(n=81);全部患者CYP2C19基因型经检测为*1/*1.利用PCR扩增并结合Sanger测序筛选入组患者CYP2C19启动子区的基因变异;将CYP2C19启动子片段克隆至pGL3 basic载体,并转染HEK 293T细胞,检测基因变异对启动子功能的影响.
实验结果
本研究在3个正常代谢型GERD患者的CYP2C19基因启动子中分别发现了3个新的杂合变异:g.94761364 T>A,g.94762112 T>A,g.94762514 G>T;与野生型相比,携带g.94761364 T>A变异的CYP2C19启动子的转录活性显著升高(P=0.034).
实验结论
CYP2C19启动子区碱基发生变异可能影响其转录活性,进而改变PPIs的代谢和血药浓度,这一发现为中国人群中GERD患者的临床用药和治疗提供了新的思路.
展望前景
本研究主要在分子和细胞水平对CYP2C19启动子区功能改变与GERD经PPIs治疗效果的相关性进行了研究,具有一定的临床意义,将为GERD的分子诊疗提供一定的理论依据.

