下调ClC-3通过抑制细胞自噬增强结直肠癌细胞对奥沙利铂化疗敏感性
段琼,浙江中医药大学药学院 浙江省杭州市 310053
段琼,陈斌辉,台州恩泽医疗中心(集团)恩泽医院药剂科 浙江省台州市 317000
林义,温岭市第一人民医院病理科 浙江省温岭市 317500
0 引言
结直肠癌(colorectal cancer,CRC)是常见的消化系统恶性肿瘤之一,尽管我国CRC发病率和死亡率低于发达国家水平[1],但随着经济的发展和人们饮食习惯的变更,我国近几年CRC的发病率正以年均4%以上的速度增长[2],且北京、上海、广州等发达地区的CRC发病率已和发达国家持平[3].大部分CRC患者确诊时已是中晚期,手术难以根除[4].目前临床上应用的FOLFOX方案是利用奥沙利铂(oxaliplatin,L-OHP)与5-氟尿嘧啶及亚叶酸联合用药作为CRC的一线、二线治疗[5],但多数患者在治疗一段时间后产生获得性耐药.且化疗不仅易出现耐药性,还极易出现毒副作用,导致临床上治疗效果不佳以及预后不良[6].因此如何逆转CRC细胞对奥沙利铂的耐药性,提高CRC细胞对奥沙利铂的敏感性,提高患者的生存率和减轻患者的毒副作用是目前研究的热点.
电压门控氯通道3(voltage-gated chloride channel 3,ClC-3)基因定位于4q33,编码760个氨基酸组成的蛋白质,广泛分布于心、脑、肝、肠、胰腺等组织.依赖ClC-3的容积调节性氯电流参与调控细胞容积变化,而细胞容积变化直接参与调控增殖、凋亡、细胞周期、细胞粘附、细胞动力学等多种生物学功能[7-9].实体肿瘤化疗时能使得实体肿瘤细胞内部微环境发生改变[10].在缺氧和缺营养的微环境高渗环境下,细胞发生调节性容量增加(regulatory volume increase,RVI)[8].有文献[11]提出稳定过表达ClC-3的宫颈癌细胞对顺铂敏感性降低;ClC-3 siRNA转染后,卵巢癌顺铂耐药细胞SKOV-3/DDP对顺铂敏感性增强[12].因此,我们推测ClC-3表达可能与对肿瘤细胞化疗相关.
由以上研究背景可见,ClC-3均与肿瘤化疗药物敏感性相关,但ClC-3在CRC癌奥沙利铂化疗中的研究却鲜有报道.本研究试图探究下调ClC-3是否可以调节CRC细胞对奥沙利铂化疗的敏感性,以及其中的机制.
1 材料和方法
1.1 材料 CRC组织耐药标本收集:收集我院经FOLFOX方案化疗后再次复发的CRC患者再次行肿瘤切除术的肿瘤组织和相应的癌旁组织(距离癌灶组织边缘2-3 cm)标本,肿瘤组织和相应的癌旁组织经过病理科验证.筛选出化疗耐药CRC组织(n=28例)和化疗敏感CRC组织(n=10例).其中,化疗耐药组织定义为经FOLFOX方案化疗后≤6 mo出现复发的CRC患者的CRC组织,化疗敏感组织定义为经FOLFOX方案化疗后>6 mo出现复发的CRC患者的CRC组织.本次收集的化疗耐药CRC组织为FOLFOX方案化疗后4.12 mo±1.13 mo再次复发的CRC患者再次行肿瘤切除术的结直肠组织,化疗敏感CRC组织为FOLFOX方案化疗后22.35 mo±4.25 mo再次复发的CRC患者再次行肿瘤切除术的结直肠组织.所有标本及临床资料的收集均符合伦理规范,同时征得患者或其家属同意并签署相关知情同意书.
1.2 方法
1.2.1 细胞培养及奥沙利铂耐药细胞模型构建:HT-29细胞(ATCC,美国)用含10%胎牛血清(Gibco,美国)和100 U/mL青/链霉素双抗的DMEM培养基(Thermo Fisher Scientific,美国)常规培养,2 d换一次液,每6 d按照1:3传代一次.取对数期HT-29细胞,将培养基换成含有2 μmol/L奥沙利铂(赛诺菲(杭州)制药有限公司)培养液,培养48 h,洗除药物,换正常培养基,每2 d换正常培养基一次,持续6 d,此为一个循环.每个浓度反复刺激3个循环.如此反复诱导、换液、传代,并逐渐增加奥沙利铂浓度(每次增加1 μmol/L)间歇诱导培养,最终获得能耐受20 μmol/L奥沙利铂的细胞,并将其培养在含有10 μmol/L奥沙利铂培养液中,直达细胞在10 μmol/L奥沙利铂培养液中稳定生长.最终获得奥沙利铂耐药的HT-29/L-OHP细胞.
1.2.2 转染:由Invitrogen 公司(美国)按照BLOCK-iT™ RNAi Designer设计合成人ClC-3 cDNA不同区域的RNAi(ClC-3 siRNA,序列为:5'-AUAAUAGCUAACCUCCUC CAAACUA-3'),以及无已知的基因编码的阴性对照siRNA(NC siRNA,序列为:5'-AAUUCUCCGAACGUGUCACGU-3').按照说明书步骤,用脂质体lipofectAMINE2000(Invitrogen,美国)分别将ClC-3 siRNA和NC siRNA通过瞬时转染法染入HT-29细胞和HT-29/L-OHP细胞,细胞继续在培养箱孵育48 h,收集细胞用于后续研究.
1.2.3 药物处理:用100 nmol/L雷帕霉素(自噬激动剂,上海阿拉丁生化科技股份有限公司)处理已/未转染ClC-3 siRNA的HT-29细胞和HT-29/L-OHP细胞30 min,再继续培养48 h后,收集细胞用于后续研究.
1.2.4 CCK-8实验:调整雷帕霉素已/未处理的已/未转染ClC-3 siRNA的HT-29细胞和HT-29/L-OHP密度为1×104个/孔,接种于96孔板,然后分别给予(0、4、8、16、32、64、100 μmol/L)奥沙利铂处理48 h,待测孔加入100 μL CCK-8工作液(江苏凯基生物技术股份有限公司),孵箱培养2 h.用酶标仪在490 nm处测量吸光值计算细胞活力.
1.2.5 Cyto-ID自噬率检测:将已转染ClC-3 siRNA或NC-siRNA的HT-29细胞和HT-29/L-OHP细胞调整密度为1×105个/mL接种于24孔板内,细胞处理后用PBS清洗3次,用4%多聚甲醛室温固定15 min,PBS清洗3次,加入Cyto-ID检测试剂(ENZO,美国)孵育45 min,激光共聚焦显微镜下观察,统计单个细胞中Cyto-ID的阳性自噬点数,每样本至少统计50个细胞.
1.2.6 免疫组化:取癌旁组织、CRC化疗耐药组织和化疗敏感组织组织,并用石蜡包埋.切为6 μm厚度的组织切片,并经脱蜡至水、阻断内源性过氧化物酶和封闭后,分别室温孵育抗ClC-3(1:150,Abcam,美国)和抗微管相关蛋白1Ⅱ轻链3(microtubule-associated protein 1Ⅱ light chain 3,LC3-Ⅱ)(1:100,Abcam,美国)2 h.PBS冲洗后,室温孵育酶标抗兔二抗(1:100,北京中山金桥生物技术有限公司)45 min.PBS冲洗后,用DAB液显色,苏木素复染后,显微镜白光视野下观察并拍照,用Image J软件统计阳性信号值.
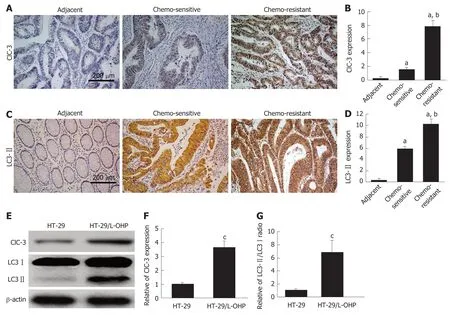
图1 ClC-3和LC3-Ⅱ在结直肠癌化疗耐药组织和奥沙利铂耐药细胞HT-29/L-OHP中表达情况.A-D:免疫组化检测癌旁组织(n=38)、结直肠癌(colorectal cancer,CRC)化疗耐药组织(n=28)和CRC化疗敏感组织(n=10)中ClC-3(A、B)和LC3-Ⅱ(C、D)的表达;与癌旁组织比较,aP<0.05;与化疗敏感组织比较,bP<0.05.(E-G)Western blot检测HT-29细胞和HT-29/L-OHP细胞中ClC-3表达(E、F)和LC3-Ⅱ/LC3-Ⅰ比率(E、G);n=4,与HT-29细胞比较,cP<0.05.
1.2.7 蛋白质免疫印迹:用RIPA细胞裂解液(上海碧云天生物技术有限公司)在冰上裂解细胞并提取蛋白.蛋白用BCA蛋白浓度检测试剂盒(上海碧云天生物技术有限公司)进行定量后,调整蛋白上样量(50 μg/样品),进行SDS-PAGE凝胶电泳分离.电泳结束,将PVDF膜覆盖于分离胶上,置于电转槽中用湿转法以200 mA恒流电转90 min.用含5%脱脂奶粉的TBST将PVDF膜在室温中封闭1 h.在室温下孵育针对ClC-3(1:1000,Abcam,美国)、Beclin1 (1:2000,Cell Signaling Technology,美国)、LC3(1:1500,Cell Signaling Technology,美国)和β-actin (1:5000,武汉博士德生物工程有限公司)的一抗2 h.洗膜后,孵育HRP标记的二抗(上海碧云天生物技术有限公司)1 h.洗膜后,用避光ECL超敏发光液(上海碧云天生物技术有限公司)显影.使用Image J软件分析条带光密度值.
统计学处理数据以mean±SD表示,用SPSS 21.0软件包对实验数据进行分析.两组数据比较采用t检验;多组间数据比较用方差分析,再采用SNK检验法进行均数的两两比较.以P<0.05为差异有统计学意义.
2 结果
2.1 CLC-3和LC3-Ⅱ在CRC化疗耐药组织和奥沙利铂耐药细胞HT-29/L-OHP中高表达 免疫组化染色结果显示,与化疗敏感组织比较,化疗耐药组织中ClC-3(图1A、B)和LC3-Ⅱ(图1C、D)的表达均明显增加(P<0.05),说明CLC-3和LC3-Ⅱ在CRC化疗耐药组织中呈现高水平.Western blot结果显示,与HT-29细胞比较,奥沙利铂耐药细胞HT-29/L-OHP中ClC-3表达(图1E、F)和LC3-Ⅱ/LC3-Ⅰ比率(图1E、G)均明显增加(P<0.05).以上结果提示,ClC-3表达和自噬可能与CRC奥沙利铂耐药相关.
2.2 抑制ClC-3表达可以增强奥沙利铂敏感性 用ClC-3 siRNA分别转染HT-29细胞和HT-29/L-OHP细胞,与对照组比较,ClC-3 siRNA组的HT-29细胞和HT-29/L-OHP细胞中ClC-3表达均明显降低(图2A、B;P<0.05),说明构建的ClC-3 siRNA转染细胞成功.用CCK-8法检测不同处理后细胞活力的变化,如图2C所示,相比于HT-29细胞,用ClC-3 siRNA处理的HT-29细胞的细胞活力明显下降,表明细胞对于奥沙利铂化疗的敏感性增加;同时,在奥沙利铂耐药细胞HT-29/L-OHP中抑制ClC-3后,细胞对奥沙利铂敏感性增强.总之,不管是否发生奥沙利铂耐药,抑制细胞中ClC-3表达均可以增强细胞对奥沙利铂的敏感性.
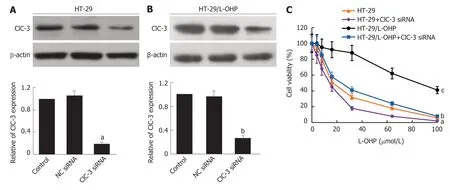
图2 抑制ClC-3表达对结直肠癌细胞奥沙利铂化疗敏感性的影响.A,B:Western blot鉴定HT-29细胞(A)和HT-29/L-OHP细胞(B)的ClC-3 siRNA的转染效率;C:CCK-8法检测不同组细胞活力;n=4;与HT-29细胞比较,aP<0.05,cP<0.05;与HT-29/L-OHP细胞比较,bP<0.05.
2.3 抑制ClC-3表达能抑制自噬 Cyto-ID染色结果(图3A、B)显示,在HT-29细胞和HT-29/L-OHP细胞中转染ClC-3 siRNA,转染ClC-3 siRNA后的两种细胞的细胞内Cyto-ID的阳性自噬点数均降低(P<0.05).进一步通过Western blot检测细胞内自噬关键蛋白的表达(图3C),结果(图3C-F)显示,不管是在HT-29细胞和HT-29/L-OHP细胞中,与转染NC siRNA比较,转染ClC-3 siRNA后的两种细胞中LC3-Ⅱ/LC3-Ⅰ比率(图3D)和Beclin1表达(图3E)均明显降低(P<0.05),同时p62表达(图3F)明显增加(P<0.05).以上结果说明,抑制ClC-3表达能降低CRC细胞的自噬水平.
2.4 雷帕霉素能逆转ClC-3 siRNA对奥沙利铂的增敏效应 CCK-8结果(图4A)显示,不管是在HT-29细胞和HT-29/L-OHP细胞中,与转染ClC-3 siRNA比较,用自噬激动剂雷帕霉素处理均能降低细胞对奥沙利铂的敏感性(P<0.05).Western blot结果(4B-E)显示,不管是在HT-29细胞和HT-29/L-OHP细胞中,与转染ClC-3 siRNA比较,用雷帕霉素处理后的两种细胞中LC3-Ⅱ/LC3-Ⅰ比率(图4B、C)和Beclin1表达(图4B、D)均明显增加(P<0.05),同时p62表达(图4B、E)明显降低(P<0.05);以上结果说明,促进自噬能逆转ClC-3 siRNA对CRC细胞的奥沙利铂的增敏效应.另外,结果(图4B、F)显示,不管是在HT-29细胞和HT-29/L-OHP细胞中,雷帕霉素对ClC-3表达无影响,这提示ClC-3是细胞自噬的上游调节分子.
3 讨论
自噬是实体肿瘤细胞在缺氧和缺营养的癌灶中生存的重要方式,而化疗药物往往能增强实体肿瘤细胞缺氧和缺营养的微环境[10].在自噬过程中,Beclin1上调能发挥启动自噬的作用;LC3-Ⅱ则是自噬体形成的标记物;p62可同自噬过程中的降解底物一起被自噬体结合并降解.且研究[13]已显示,在实体肿瘤化疗耐药组织切片中发现,其自噬关键标记物Beclin1和LC3-Ⅱ的蛋白水平升高.因此,自噬在实体肿瘤化疗敏感性中可能发挥着重要的作用.另外,缺氧和缺营养的微环境能促进细胞ClC-3表达[8].由此观之,在肿瘤化疗中,ClC-3表达、自噬水平和化疗敏感性三者之间可能具有一定的内部联系.因此,本研究关注ClC-3和细胞自噬的作用,以及它们在调控CRC化疗耐药细胞对奥沙利铂化疗的敏感性的作用.
ClC-3是电压门控性氯离子通道家族的成员,有研究[14]发现抑制ClC-3的表达,可抑制神经胶质瘤细胞U251的自噬,促进U251细胞对顺铂化疗敏感性.我们同样在CRC化疗耐药组织和奥沙利铂耐药的HT-29/L-OHP细胞株中发现ClC-3和LC3-Ⅱ高表达,由此推测ClC-3和LC3-Ⅱ表达可能与CRC奥沙利铂化疗敏感性相关.为证明ClC-3通过自噬参与结直肠的奥沙利铂化疗敏感性,本研究采用ClC-3 siRNA转染HT-29细胞和HT-29/L-OHP细胞,观察自噬水平和其奥沙利铂化疗敏感性变化,结果显示,不管是否发生奥沙利铂耐药,抑制ClC-3表达均能使结直肠细胞对奥沙利铂增敏,且其过程伴随自噬水平降低.且Sun等[15]发现在化疗耐药CRC细胞中抑制细胞自噬,奥沙利铂处理可以促使肿瘤细胞凋亡增加.比较直接的证据是Selvakumaran等[16]在CRC细胞研究中发现,给予自噬抑制剂氯喹预处理的CRC细胞或转染Beclin1 siRNA的CRC细胞对奥沙利铂的敏感性明显升高.为证明下调ClC-3对CRC细胞的奥沙利铂的增敏效应是否通过抑制细胞自噬,本研究进一步选用自噬激动剂雷帕霉素处理已转染ClC-3 siRNA的HT-29细胞和HT-29/L-OHP细胞,发现增强自噬能逆转ClC-3 siRNA对奥沙利铂的增敏效应,但其对ClC-3表达无影响,这一结果,更进一步证明了ClC-3是自噬的上游分子,抑制ClC-3是通过降低CRC细胞自噬水平来达到对奥沙利铂的增敏.
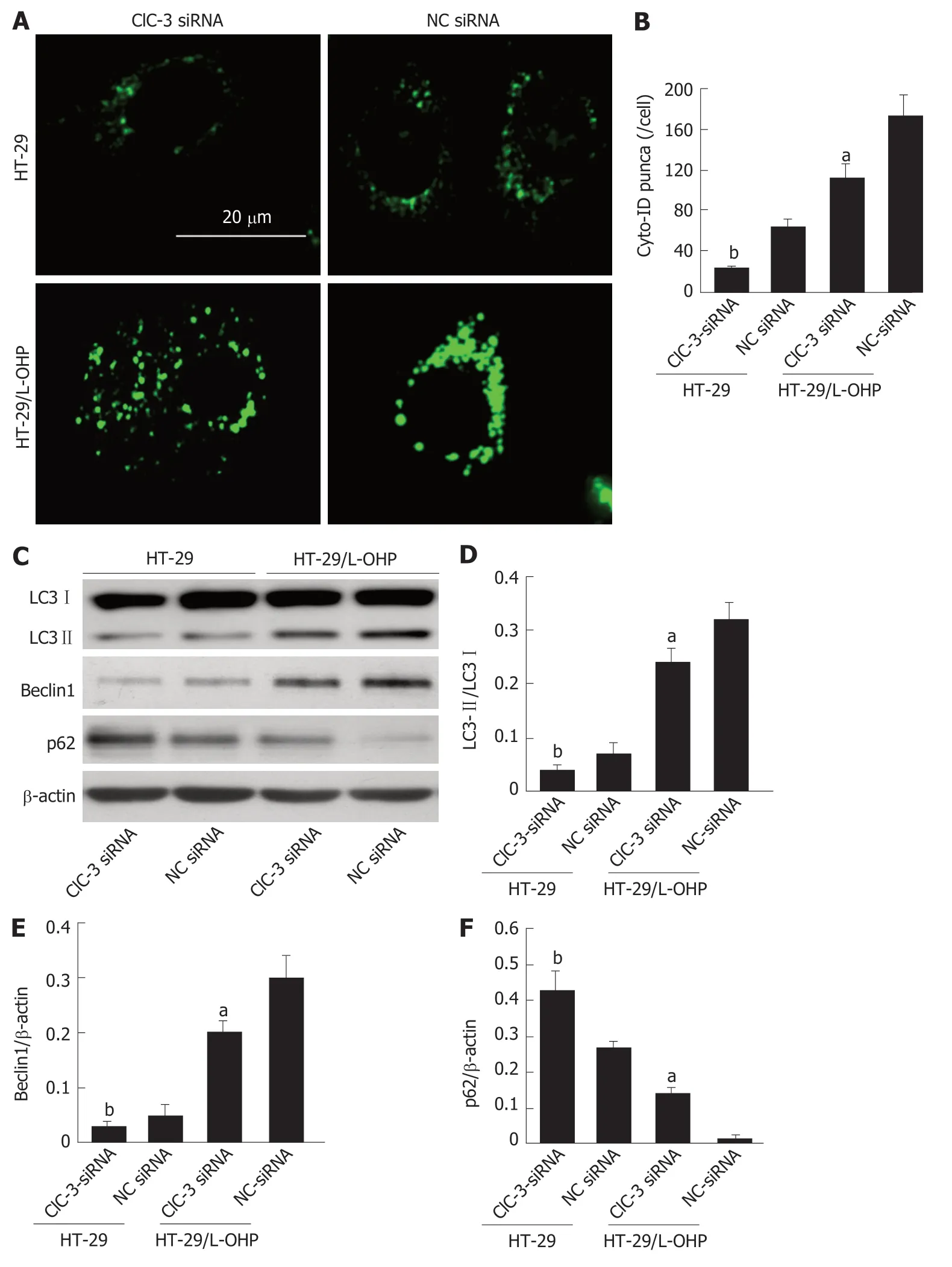
图3 抑制ClC-3表达对结直肠癌细胞自噬的影响.A,B:Cyto-ID染色观察不同组中自噬点形成;C-F:Western blot检测不同组中LC3-Ⅱ/LC3-Ⅰ比率(C、D)、Beclin1表达(C、E)和p62表达(C、F);n=4;与HT-29+NC siRNA比较,bP<0.05;与HT-29/L-OHP+NC siRNA比较,aP<0.05.
4 结论
总之,我们的研究发现下调ClC-3通过抑制细胞自噬从而增强了CRC细胞对奥沙利铂化疗的敏感性.我们的研究工作从组织学和细胞学两个方面探究ClC-3在CRC细胞奥沙利铂敏感性中的调控作用,明确下调ClC-3在CRC化疗中的作用机制,从一个新的角度为评估ClC-3参与CRC化疗作用提供了理论依据.
文章亮点
实验背景
化疗是肿瘤治疗的最主要的治疗策略之一.而化疗敏感性制约着肿瘤的化疗效果.因此,研究增加化疗敏感性的策略对肿瘤的化疗具有重大的意义.
实验动机
自噬是肿瘤细胞应对化疗的重要生存方式之一.已有报道表明电压门控氯通道3(voltage-gated chloride channel 3,ClC-3)在化疗耐药组织高表达.而在肿瘤化疗中,ClC-3表达、自噬和化疗药物敏感性三者之间的内部关系尚不完全清楚.
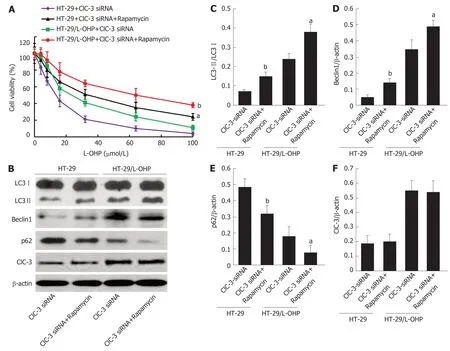
图4 促进自噬逆转ClC-3 siRNA对奥沙利铂的增敏效应.A:CCK-8法检测不同组细胞活力;B-F:Western blot检测不同组中LC3-Ⅱ/LC3-Ⅰ比率(B、C)、Beclin1表达(B、D)、p62表达(B、E)和ClC-3表达(B、F);n=3;与HT-29+ClC-3 siRNA比较,bP<0.05;与HT-29/L-OHP+ClC-3 siRNA比较,aP<0.05.
实验目标
研究结直肠癌(colorectal cancer,CRC)奥沙利铂化疗中,ClC-3表达、自噬和奥沙利铂敏感性三者之间的关系,并分析内在的机制.
实验方法
分别检测FOLFOX方案化疗后的CRC化疗耐药组织和化疗敏感组织以及CRCHT-29细胞和奥沙利铂耐药细胞(HT-29/L-OHP)中ClC-3和微管相关蛋白1Ⅱ轻链3(microtubule-associated protein 1Ⅱ light chain 3,LC3-Ⅱ)表达;敲减HT-29和HT-29/L-OHP中ClC-3的表达后,分别检测奥沙利铂敏感性和自噬水平的变化;用雷帕霉素处理上述细胞,再分别检测奥沙利铂敏感性、自噬水平和ClC-3表达的变化.
实验结果
CRC耐药组织以及奥沙利铂耐药细胞中均存在高表达的LC3Ⅱ和ClC-3.在HT-29和HT-29/L-OHP中,下调ClC-3表达均对奥沙利铂增敏并降低自噬;用雷帕霉素能部分消除敲减ClC-3对奥沙利铂的增敏效应.
实验结论
下调ClC-3通过抑制CRC细胞自噬水平来达到对奥沙利铂的增敏效应.
展望前景
在CRC化疗中,下调ClC-3表达可能会让患者获益.
——雷帕霉素

