食源性金黄色葡萄球菌相关毒力基因的时序性表达规律研究
魏 歆, 林芳明,雷生妍, 张红见,贾彩惠, 葛丽萍, 赵 静
(1.青海大学农牧学院, 青海西宁810016 ; 2.青海省食品检验检测院, 青海西宁810008 ; 3. 陕西省畜牧技术推广总站, 陕西西安710016)
金黄色葡萄球菌肠毒素引起的食物中毒是一个全球性问题,对食品安全和人类健康造成重大威胁。当食品被金黄色葡萄球菌污染后,会分泌如金黄色葡萄球菌肠毒素(Staphylococcal enterotoxins,SE)、耐热核酸酶(nuc)等各种毒素,大大增加了其侵袭性和致病力。据报道[1],全球由金黄色葡萄球菌5种肠毒素SEA~SEE引起的食物中毒的比例高达95%,而nuc的致病性与SE的相关性达到95%,可作为是否是金黄色葡萄球菌引起的食物中毒的指标。金黄色葡萄球菌因菌株的来源不同,其分泌的肠毒素及耐热核酸酶的类型也各异,即使分泌同一种肠毒素或耐热核酸酶,其产生量往往也会因生长环境不同而有差异[2],给因金黄色葡萄球菌引起的食物中毒的预防及流行控制带来很大难度,一直以来也都是食源性污染监测的重点对象。目前有大量的SE基因分型和食源性疾病的研究[3-4],但涉及SE及nuc表达规律的研究却鲜有报道。本试验利用RT-qPCR在mRNA水平对西宁市不同区域食品中检出率最高的SEA、SEB、SEE三种SE及nuc基因在不同生长阶段的表达模式,二者之间的相关性进行研究,以期为金黄色葡萄球菌污染的防控以及食品安全监控和风险评估提供理论依据。
1 材料与方法
1.1 样品的采集 按照食品微生物检验采样的要求,于2017年8月—2018年3月分别从西宁市的集贸市场、超市、路边摊点采集牛乳类(生鲜牛乳、包装牛乳);猪肉制品(香肠);果蔬类(橙子;豆角、蘑菇、西红柿、豆腐、茄子、黄瓜、胡萝卜、西兰花、青菜);肉类(鸡腿、鸡爪、鸡翅、羊肉、猪肉、牛肉);海鲜类(鱼、虾),共计169份。
1.2 菌株来源 试验菌株为通过革兰染色、镜检、生化试验以及PCR,从169份样品中分离鉴定得到的121株金黄色葡萄球菌。
1.3 主要试剂培养基及试剂 TSB培养基,购自北京康为世纪生物科技有限公司;SYBR PremixExTaq试剂盒,购自北京全式金生物技术有限公司;PrimeScriptTMRT reagent Kit with gDNA Eraser、细菌总RNA 提取试剂盒,均购自TaKaRa有限公司。
1.4 试验方法
1.4.1 3株金黄色葡萄球菌菌株SAn5、SAxj、SAn2生长曲线测定 根据分离的121株菌株和利用PCR对检测出的SEA、SEB、SEE三种SE基因,分别以SAn5、SAxj、SAn2作为目标菌株测定生长曲线。各目标菌株接种及OD值的测定见参考文献[5]。
1.4.2 金黄色葡萄球菌总RNA提取及检测 按细菌RNA试剂盒操作说明书进行,提取的RNA进行2%琼脂糖凝胶电泳并观察,利用微量核酸蛋白检测仪检测其浓度和纯度。
1.4.3 反转录-荧光定量PCR(RT-qPCR)
1.4.3.1 引物设计 参考于宏伟等[5]文献设计nuc基因、内参(16S rRNA)基因及SEA、SEB、SEE三个肠毒素基因的特异性引物,由西安擎科泽西生物科技有限责任公司合成,见表1。
1.4.3.2 RT-qPCR 以细菌总RNA为模板,用试剂盒合成cDNA,进行RT-qPCR反应,各目标基因做3个平行。反应体系为:正、反向引物各0.5 μL,SYBR PremixExTaq10.0 μL,cDNA模板1.0 μL,RNase free dH2O 8.0 μL,总体积20.0 μL。反应条件:94 ℃预变性30 s;95 ℃变性5 s,58 ℃退火延伸15 s,共45个循环。反应结束后,获取Ct值及相关曲线。
1.5 数据处理 根据Ct值,采用2-△△Ct法计算各目标基因在不同时期的相对表达量。获取检测样本和内参基因的Ct值,二者差异为△Ct,检测样本△Ct和对照样本的差异为△△Ct;倍数差异=2-△△Ct。结果以一株菌的目标基因在某时期的表达对于其迟缓期的相对表达量为校准样本,利用SPSS软件进行分析。

表1 金黄色葡萄球菌肠毒素基因、耐热核酸酶及内参基因引物Table 1 The primers of SE,nuc and 16S rRNA gene
2 结果
2.1 SAn5、SAxj、SAn2三株菌生长曲线测定 选择含有SEA、SEB、SEE基因的3株目标菌株接种后,前10 h每隔1 h取样,之后每隔2 h取样,直至16 h;以培养时间(h)、OD600吸光度值作为横纵坐标,绘制生长曲线,见图1。
3株菌的5个生长时期对应的吸光度值为:SEA:a:迟缓期OD600=0.2;b:对数前期OD600=1.2;c:对数后期OD600=2.7;d:稳定前期OD600=3.0;e:稳定后期OD600=3.5;SEB:a:迟缓期OD600=0.016;b:对数前期OD600=0.025;c:对数后期OD600=2.28;d:稳定前期OD600=2.33;e:稳定后期OD600=2.35;SEE:a:迟缓期OD600=0.03;b:对数前期OD600=0.13;c:对数后期OD600=2.3;d:稳定前期OD600=2.3;e:稳定后期OD600=2.28。
由图1可知,3株菌分别在经过1 h、2 h、2 h的迟缓期后进入对数生长期,在5 h后逐渐达到稳定前期;SEA和SEB一直处在稳定前期和稳定后期,没有下降的趋势,这可能与菌株有关系;SEE在14 h时逐渐呈下降趋势,进入稳定后期。
2.2 RT-qPCR试验结果 在3株菌分别达到5个生长时期(迟缓期、对数前期、对数后期、稳定前期、稳定后期)对应吸光度值时,收集菌体并提取细菌总RNA,以反转录的cDNA为模板,同时以16S rRNA作为内标基因,分别以SEA、SEB、SEE、nuc四个基因进行RT-qPCR,绘制溶解曲线,如中插彩版图2、3、4。由图可知,所有溶解曲线均产生单一峰图,不存在非特异性扩增,表明引物特异性良好,可进行后续表达规律研究。
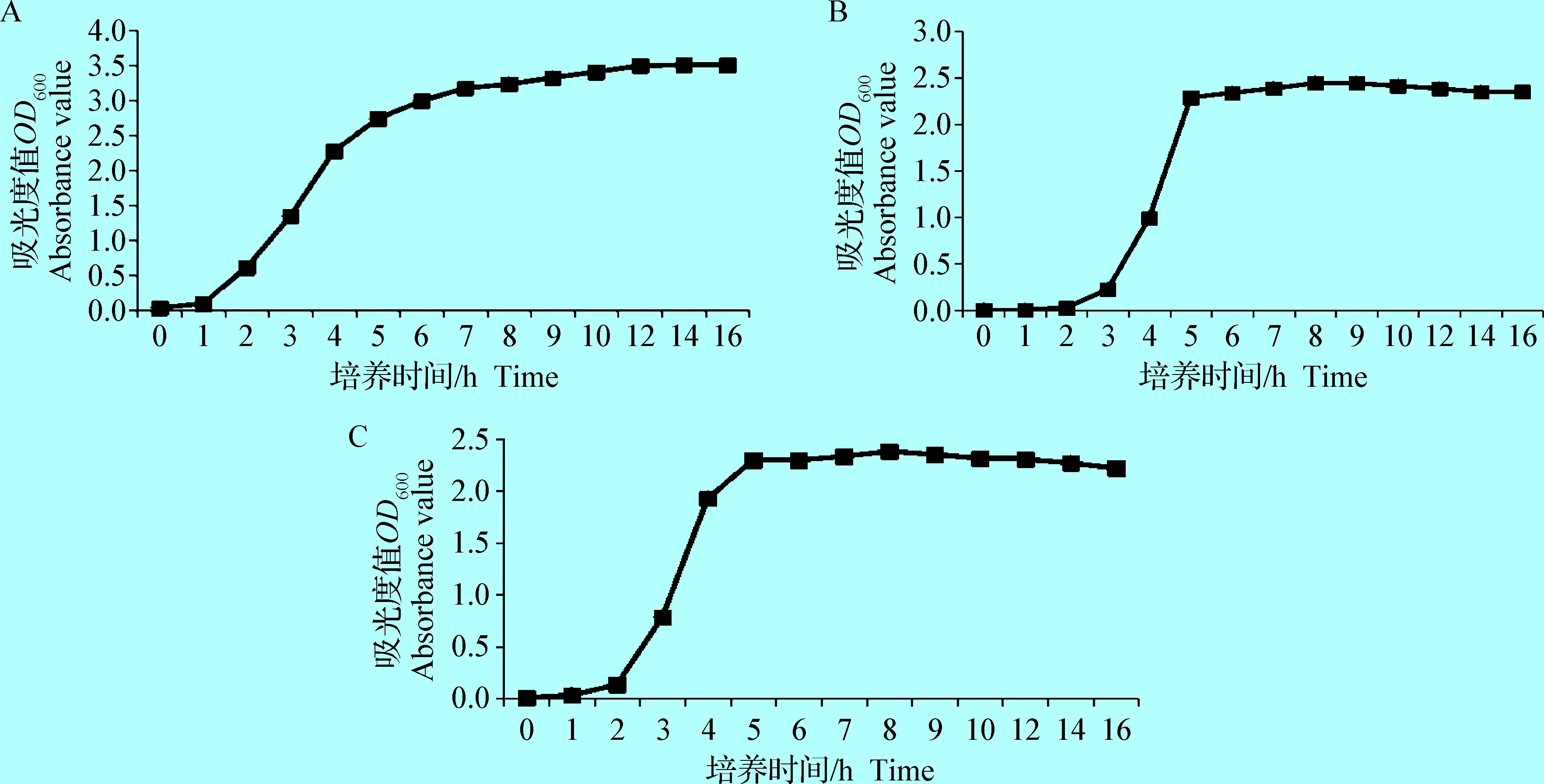
图1 金黄色葡萄球菌肠毒素基因A、B、E在液体培养基中的生长曲线Fig.1 Growth curve of SEA、SEB、SEE in liquid medium
2.3SEA、SEB、SEE及nuc基因的表达规律 由图5、6、7可知,4种基因均出现二次表达现象;SEA对应的nuc基因呈现基本一致的表达趋势,SEA在稳定前期表达量最高,nuc基因在对数后期表达量最高;nuc基因表现为二次升高;SEB在对数前期呈现升高,在对数后期却又下降,在稳定期高表达,表现为二次降低,与nuc基因的表达趋势相反;SEE在稳定后期达到峰值,表现为二次升高,也与nuc基因的表达一致;综上,3种SE和nuc基因均出现二次升高或降低的现象,SEA与nuc基因的相对表达基本一致,SEB与nuc基因的相对表达相反,SEE与nuc基因的相对表达一致。
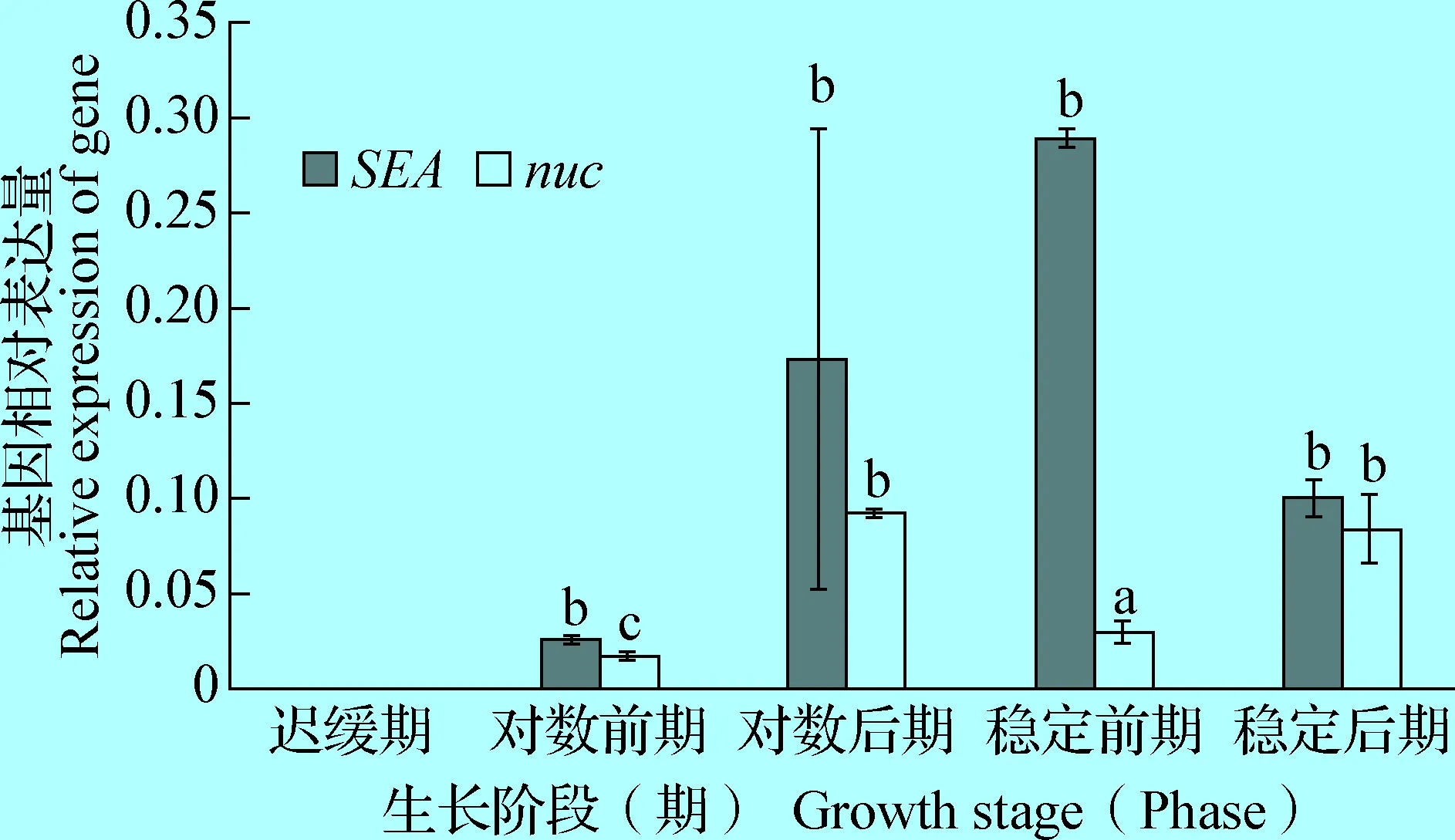
图5 SEA及nuc基因在TSB培养基的表达规律Fig.5 Expression patterns of SEA and nuc gene in TSB注:结果以一株菌的目标基因在某时期的表达对于迟缓期的相对表达量为校准样本;相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05);下图同Note: According to the relative expression of the target gene of a strain in a certain period for its slow period was used as the calibration sample; same letter indicate insignificant (P>0.05); difference letters indicate significant (P<0.05). The same as following figures

图6 SEB及nuc基因在TSB培养基的表达规律Fig.6 Expression patterns of SEB and nuc gene in TSB

图7 SEE及nuc基因在TSB培养基的表达规律Fig.7 Expression patterns of SEE and nuc gene in TSB
3 讨论
3.1 本试验利用RT-qPCR对金黄色葡萄球菌SEA、SEB、SEE和nuc共4个毒力基因的表达模式进行了研究,结果表明不同肠毒素基因在某一时期的相对表达量差异较大,SEA和SEE的相对表达量要明显低于SEB。Duquenne等[6]利用RT-qPCR研究奶酪中SEA和SED的表达情况,发现不同菌株在某一时期的表达量不同,细菌的浓度随着SE基因的表达量而变化,导致其侵袭力也随之升高或降低;SEA在稳定前期达到高峰,在稳定后期趋于平稳;SEB在稳定前期分泌量最大;SEE在对数后期高表达。Bergdoll等[7]也发现SEB的分泌量显著高于其他SE,说明不同菌株的生长速度不同导致达到一定时期需要的时间不同,进而使每个基因在不同阶段的表达有差异,这可能与金黄色葡萄球菌为了适应不断变化的外界环境,其分泌的肠毒素及耐热核酸酶的表达会随着生长不同阶段和环境因素的变化不断调整所致[8]。
3.2 目前涉及SE及nuc表达规律相关性的研究鲜有报道。本试验发现不同SE和nuc基因在某一时期的相对表达量差异较大,以SEB高表达,且与耐热核酸酶基因的表达显著相关;SEA在稳定前期表达量最高,SEB在对数前期呈现升高,在对数后期却又下降,在稳定期高表达,表现为二次降低,SEE在稳定后期达到高峰值,表现为二次升高,而与这3个基因相比,nuc基因在金葡菌生长的对数后期和稳定期高表达,这与Smeltzer等[9]的研究结果一致,说明耐热核酸酶能够与肠毒素在基本相同的条件下合成,并且在食物储存与加工的各种条件下都能保持和肠毒素相似的稳定性,检测食品中的耐热核酸酶可以了解金黄色葡萄球菌肠毒素的污染情况,从而判定是否有引发食物中毒的可能性。同时本试验结果还表明,4种基因均出现二次表达现象,推测可能与菌株中存在对其表达有激活或抑制作用因子相关。据报道SE和nuc基因在金黄色葡萄球菌中的表达由多个调控元件协调[10],其中sae基因可以直接或者间接的上调耐热核酸酶和SEB的表达,为下一步研究二者在金黄色葡萄球菌毒力调节,生理代谢及功能上的直接作用及调控机制提供了研究思路。

